多发性骨髓瘤患者血清中lncRNA PCAT- 1的表达水平与临床预后研究*
盘国雄,谭才燕,何嘉颖,梁梓钊
(肇庆市第二人民医院,广东肇庆 526060)
多发性骨髓瘤(multiple myeloma,MM)属于浆细胞恶性肿瘤,发病率为15%,居于血液恶性肿瘤第二位,近年来调查显示其发病率呈逐年上升的趋势,治愈较难,患者预后差,因此探究其发病机制对于其治疗、预后十分有必要[1,2]。长链非编码RNA(long non- coding RNA,lncRNA)在机体的生长发育以及组织分化中发挥重要的调控功能,近年来较多研究显示lnc RNA与肿瘤的发生、发展密切相关,在正常组织以及肿瘤组织中能够特异性表达,可作为肿瘤的预测因子[3]。目前有研究显示lncRNA与MM患者病情进展以及预后有关[4]。本研究通过检测MM患者血清中lncRNA转录产物1(prostate cancer- associated transcript1,PCAT1)的表达,旨在探究其临床意义以及与患者预后的相关性。
1 材料与方法
1.1研究对象选取2013年2月~2014年6月在我院进行初步确诊的72例MM患者作为研究对象,所有患者均符合《血液病诊断及治疗标准》中MM诊断标准,男性41例,女性31例,年龄43~79岁,平均年龄59.34±7.26岁,临床分期I期33例,II期24例,III期15例;疾病分型IgG型30例,IgA型21例,IgD型9例,轻链型11例,不分泌型1例。另选取同期在本院进行体检的60例正常者作为对照组,其中男性37例,女性23例,年龄44~79岁,平均年龄58.64±8.31岁,两组在性别、年龄方面对比,差异无统计学显著性意义(P>0.05)。纳入标准:①年龄≤80岁;②符合张之南《血液病诊断及治疗标准》(2007年)中诊断与分期标准[5];③均经临床诊断、骨髓象、骨骼X线等检测确诊;④患者知情同意。排除标准:①接受抗骨髓瘤治疗;②HIV阳性者;③存在严重感染性疾病;④痴呆、癫痫等精神障碍者。
1.2仪器和试剂ND- 2000核酸测定仪购自美国Thermo Scientific公司;96孔PCR仪购自Bio- Rad公司;5418低温离心机购自德国Eppendorf公司;RNA反转录试剂盒购自美国Thermo Scientific公司;SYBR Mix购自日本Taraka公司。
1.3方法
1.3.1血清样本采集:清晨空腹状态下,采集受试者3 ml静脉血,置于离心机中3 000 r/min离心15 min,收集血清溶液,置于-80℃冰箱中保存备用。
1.3.2RT- PCR法测定血清中lncRNA PCAT- 1表达:采用Trizol法提取血清中总RNA,并用核酸测定仪测定RNA含量,取2 μg用RNA反转录试剂盒将RNA反转录为cDNA。lncRNA PCAT- 1以及内参GAPDH引物由广州Invitrogen公司合成。lncRNA PCAT- 1上游引物为5’- AATGGCATGAACCTGGGAGGCG- 3’,下游引物为5’- GGCTTTGGGAAGTGCTTTGGAG- 3’;β- actin序列:F:5’- CCTTACGCCAACACAGTGC- 3’,R:5’- ATACTCCTGCTTGCTGATCC- 3’。反应体系为20 μl包括:10 μl 2×SYBR Mix,10×cDNA 1 μl,上下游引物各1 μl,H2O 8 μl,每个样品为3个重复。PCR反应程序:95℃预变性5 min;95℃30 s,60℃30 s,72℃1 min,40 cycles;72℃延伸10 min。在荧光定量PCR仪上进行反应。反应结束后利用CFX manager 3.0软件对结果进行Cq值分析,以GADPH作为内参按照2- ΔΔCq算法进行基因相对表达量分析。
1.3.3治疗方法:患者采用VAD方案进行治疗,静脉推注0.5 mg长春新碱(山西振东泰盛制药有限公司;批号:C14200031673,规格:1 mg),第1~4天;静脉滴注10 mg多柔比星(上海复旦张江生物医药股份有限公司;批号:C14207011976,规格:2 mg),第1~4天;口服20 mg地塞米松(浙江仙琚制药股份有限公司,批号:C14200004087,规格:0.75 mg),第1~4天,9~12天,17~20天,28天为1个疗程。
1.3.4疗效评价标准:根据国际骨髓瘤规定的MM疗效国际统一标准,主要分为严格完全缓解、完全缓解、部分缓解、病情稳定、病情进展,肿瘤治疗有效率=(严格完全缓解+完全缓解+部分缓解)/治疗总例数×100%。
1.3.5随访:所有患者进行三年随访,采用电话以及复查方式进行随访。主要记录①无生存进展期(progression free survival,PFS):患者接受治疗到发现肿瘤进展或死亡这一段时间;②总体生存时间(overall survival,OS):患者接受治疗到末次随访或死亡这段时间。

2 结果
2.1两组血清中PCAT- 1mRNA表达量相比较MM组血清中PCAT- 1mRNA表达量(2.65±0.64)高于对照组(1.06±0.23),差异有统计学意义(t=18.276,P=0.000)。
2.2MM患者PCAT- 1mRNA表达与临床特点的关系见表1。根据MM组血清测定平均值,将PCAT- 1mRNA>平均值的44例患者作为高表达组,≤平均值的28例患者作为低表达组,两组在性别、临床分期、病理分型在血红蛋白、浆细胞、血小板、清蛋白、β2- MG,CRP方面对比,差异无统计学意义(χ2=0.001~3.345,均P>0.05)。Ca2+≥10 mg/dl高表达组患者比例(57.14%)明显高于低表达组(27.27%),差异有统计学意义(χ2=5.229,P=0.022)。

表1 PCAT- 1mRNA表达与MM患者临床特点的关系[n(%)]
2.3MM患者PCAT- 1mRNA表达与患者治疗效果关系PCAT- 1mRNA低表达组治疗有效39例,高表达组治疗有效21例,两组治疗有效率对比(88.64% vs 75.00%),差异无统计学意义(χ2=2.291,P=0.130)。
2.4MM患者PCAT- 1mRNA表达与患者预后的关系PCAT- 1高表达、低表达组无生存进展(PFS)和总体生存(OS)对比,差异有统计学意义(χ2=7.269,P=0.007;χ2=9.190,P=0.002),见图1。将单因素分析中年龄,Ca2+水平以及PCAT- 1mRNA表达纳入COX风险回归多因素分析,显示年龄、PCAT- 1mRNA表达量为影响患者预后的独立因素(OR=3.275,P=0.025,95%CI:2.691~3.761;OR=2.136,P=0.046,95%CI:2.034~2.685)。见表2。
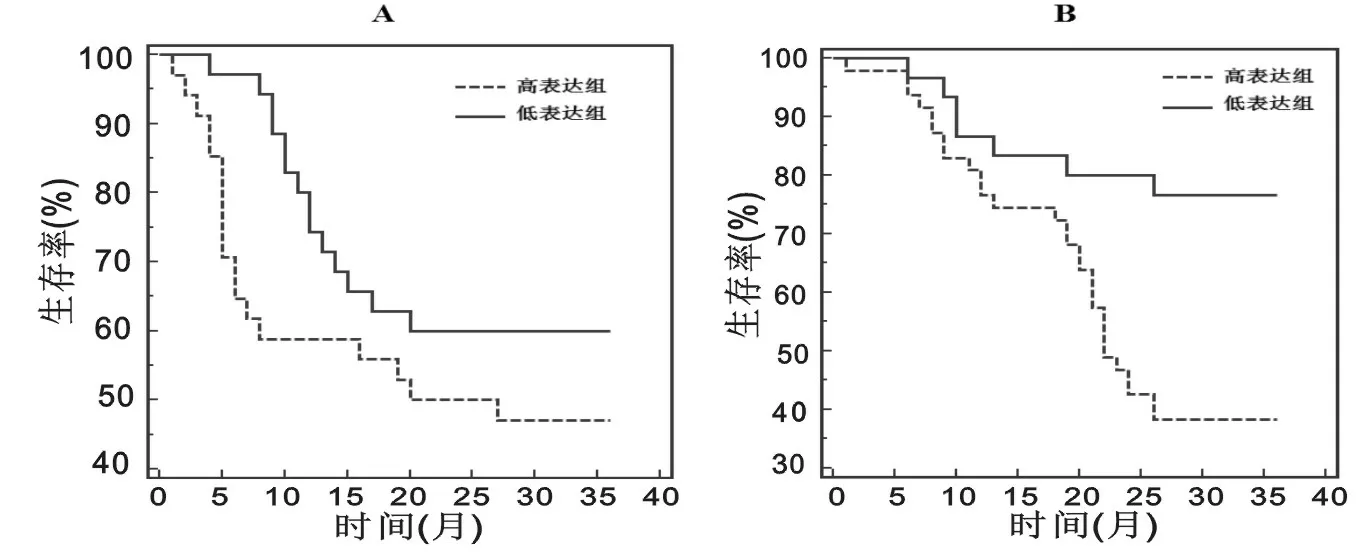
注:A.两组PFS曲线对比;B.两组OS曲线对比

表2 MM患者COX风险回归分析
3 讨论
长链非编码RNA属于非编码蛋白质,但具有重要的调控功能。较多研究显示其在机体内生命活动中发挥着重要功能,能够通过改变染色体的结构以及稳定mRNA结构,对mRNA翻译以及蛋白的合成、加工等过程进行调控[6,7]。近年来研究显示lncRNA PCAT- 1参与基因组印记、染色体X沉默以及转录激活与干扰等多种细胞生理过程[8]。另外也有研究提示部分lncRNA在病灶组织与正常组织中表达具有明显差异性,可能参与肿瘤的发生,如前列腺癌、膀胱癌、肺癌、脑膜瘤、胰腺癌等肿瘤[9],但在MM中研究的较少。
本研究结果显示MM患者血清中PCAT- 1mRNA表达量高于对照组,这与Shen等[10]研究结果相似,表明PCAT- 1 mRNA表达异常可能与MM的发生有关。PCAT- 1是近期在前列腺癌中发现的RNA序列,主要定位于人染色体8q24区域。临床已被证实作为前列腺癌的致癌因子,能够诱导癌细胞的增殖,并且影响化疗敏感性[11]。目前在其它肿瘤中也有相关研究,Prensner等[12]报道其在原发性肝细胞癌和结直肠癌组织中呈上调表达,此外研究还显示PCAT1能够抑制BRCA2的表达(BRCA2是抑癌基因),使其对PARP1抑制剂极其敏感,因此在同源重组时造成功能性缺陷。Liu等[13]研究显示降低PCAT- 1表达能够诱导人膀胱癌细胞凋亡。Zhao等[14]研究显示在非小细胞肺癌组织PCAT- 1mRNA表达量明显高于癌旁组织,体外研究也显示PCAT- 1在非小细胞肺癌细胞株A549,SPC- A- 1中mRNA表达量明显高于正常人支气管上皮细胞16HBE。另外有研究显示PCAT- 1过表达可显著促进非小细胞肺癌细胞的增殖、迁移和侵袭,进一步说明PCAT- 1具有致癌作用[15]。以上研究均说明PCAT- 1参与肿瘤的发生以及进展,并且有可能参与MM的发生。
本研究结果MM患者PCAT- 1mRNA表达与患者年龄以及血钙含量相关,提示高龄患者以及血清中钙含量较高者易出现PCAT- 1 mRNA高表达。PCAT- 1与肿瘤患者临床病理参数关系密切,有研究显示肺癌组织中PCAT- 1表达与患者性别、年龄、是否吸烟、淋巴结转移以及肿瘤分化程度不相关,而与肿瘤大小、病理分级以及临床分期呈显著正相关,表明PCAT- 1参与肺癌的发展过程[12]。Shen等[10]研究显示MM患者血清中PCAT- 1与血清β2- MG以及LDH活性呈显著性正相关,间接说明PCAT- 1可作为MM诊断指标。而治疗效果对比方面,MM PCAT- 1不同表达患者无明显差异,说明PCAT- 1表达与患者治疗效果无相关性,后期可能需要进一步扩大样本进行验证。
在不同肿瘤中PCAT- 1mRNA的表达与患者的预后密切相关。Ge等[16]研究显示在大肠癌患者中PCAT- 1高表达与肿瘤远处转移相关,认为PCAT- 1mRNA高表达为大肠癌患者独立预后因素。Yan等[17]研究显示在肝癌患者中,PCAT- 1呈现高表达并且与临床分期以及预后相关。Shi等[18]研究认为PCAT- 1mRNA的高表达与食管鳞癌患者的临床分期与预后密切相关。本研究随访结果显示PCAT- 1高表达者PFS,OS低于低表达组,说明PCAT- 1高表达者预后较差,生存率较低。进一步进行COX风险回归分析,结果显示年龄、PCAT- 1mRNA表达量为影响患者OS的独立性预后因素,提示高龄以及PCAT- 1mRNA高表达者是影响患者生存的危险因素,应提前进行预防治疗以提高患者生存率。
综上所述,PCAT- 1mRNA在MM患者中呈高表达,并且与患者PFS,OS相关,推测PCAT- 1可作为 MM诊断和预后的标志物,可能为MM治疗的靶点,但具体分子机制还有待后续深入研究。
参考文献:
[1]王路,张翼鷟.伴髓外病变的多发性骨髓瘤研究进展[J].中国实验血液学杂志,2016,24(3):945- 948.
Wang L,Zhang YZ.Research progress on multiple myeloma with extramedullary disease- review[J].Journal of Experimental Hematology,2016,24 (3):945- 948.
[2]李护君,李振宇,徐开林.多发性骨髓瘤的分层及微小残留病检测[J].国际输血及血液学杂志,2016,39(3):185- 190.
Li HJ,Li ZY,Xu KL.Stratification and minimal residual disease detection of multiple myeloma[J].International Journal of Blood Transfusion and Hematology,2016,39(3):185- 190.
[3]胡倩,姚和瑞.长链非编码RNA与肿瘤研究现状[J].中华肿瘤防治杂志,2014,21(21):1746- 1750.
Hu Q,Yao HR.Review on long non- coding RNA in tumor research[J].Chinese Journal of Cancer Prevention and Treatment,2014,21(21):1746- 1750.
[4]李春玲,叶龙,陈林,等.血清长链非编码RNACRNDE- h,GAS5检测诊断多发性骨髓瘤的价值分析[J].中国实验诊断学,2016,20(11):1844- 1848.
Li CL,Ye L,Chen L,et al.The value of serum long non- coding RNA CRNDE- h and GAS5 in diagnosis of multiple myeloma[J].Chinese Journal of Laboratory Diagnostics,2016,20(11):1844- 1848.
[5]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007:232- 234.
Zhang ZN,Shen T.Blood disease diagnostic and curative standard[M].3th Ed.Beijing:Science Press,2007:232- 234.
[6]罗杨婧婷,唐圣松.长链非编码RNA MEG3对肿瘤细胞调控作用的研究进展[J].临床与病理杂志,2016,36(2):185- 189.
Luoyang JT,Tang SS.Research advancement of long non- coding RNA MEG3 in regulating tumor cell apoptosis[J].International Journal of Pathology and Clinical Medicine,2016,36(2):185- 189.
[7]朱昆鹏,张春林.长链非编码RNA对肿瘤耐药作用的研究进展[J].肿瘤研究与临床,2015,27(1):69- 72.
Zhu KP,Zhang CL.Research progress of long non- coding RNA in tumor drug resistance[J].Cancer Research and Clinic,2015,27(1):69- 72.
[8]石永国,王科明.lncRNA在消化系统肿瘤中的研究进展[J].中国肿瘤临床,2013,40(15):938- 940.
Shi YG,Wang KM.Long noncoding RNA in digestive system neoplasms[J].Chinese Journal of Clinical Oncology,2013,40(15):938- 940.
[9]郭倚天,许斌,陈明.长链非编码RNA在前列腺癌中的作用及研究进展[J].医学研究生学报,2017,30(2):199- 203.
Guo YT,Xu B,Chen M.Long no- coding RNAs in prostate cancer[J].Journal of Medical Postgraduatesm,2017,30(2):199- 203.
[10]Shen X,Zhang Y,Wu X,et al.Upregulated lncRNA- PCAT1 is closely related to clinical diagnosis of multiple myeloma as a predictive biomarker in serum[J].Cancer Biomarkers,2017,18(3):257- 263.
[11]党强,周小果,仝建.前列腺癌相关长链非编码RNA转录产物1在非小细胞肺癌组织中的表达及意义[J].中华实验外科杂志,2016,33(5):1387- 1389.
Dang Q,Zhou XG,Tong J.Expression of prostate cancer- associated long non- coding RNA transcripts 1 and its significance in non- small cell lung cancer[J].Chinese Journal of Experimental Surgery 2016,33(5):1387- 1389.
[12]Prensner JR,Chen W,Iyer MK,et al.PCAT- 1,a lo- ng noncoding RNA,regulates BRCA2 and controls homologous recombination in cancer[J].Cancer Research,2014,74(6):1651- 1660.
[13]Liu L,Liu Y,Zhuang C,et al.Inducing cell growth arrest and apoptosis by silencing long non- coding RNA PCAT- 1 in human bladder cancer[J].Tumor Biology,2015,36(10):7685- 7689.
[14]Zhao B,Hou X,Zhan H.Long non- coding RNA PC AT- 1 over- expression promotes proliferation and metastasis in non- small cell lung cancer cells[J].International Journal of Clinical & Experimental Medicine,2015,8(10):18482- 18487.
[15]Yan K,Arfat Y,Li D,et al.Structure prediction:ne- w insights into decrypting long noncoding RNAs[J].International Journal of Molecular Sciences,2016,17(1):594- 602.
[16]Ge X,Chen Y,Liao X,et al.Overexpression of long noncoding RNA PCAT- 1 is a novel biomarker of poor prognosis in patients with colorectal cancer[J].Med Oncol,2013,30(2):588.
[17]Yan TH,Yang H,Jiang JH,et al.Prognostic significance of long non- coding RNA PCAT- 1 expression in human hepatocellular carcinoma[J].Int J Clin Exp Pathol,2015,8(4):4126- 4131.
[18]Shi WH,Wu QQ,Li SQ,et al.Upregulation of the long noncoding RNA PCAT- 1 correlates with advanced clinical stage and poor prognosis in esophageal squamous carcinoma[J].Tumour Biol,2015,36(4):2501- 2507.

