oxi-HA/oxi-CMC/PAH水凝胶的制备及性能
盛雪英 李 娴, 李孟婷 张人义 邓 双 常冠军 叶 旭,
(1. 西南科技大学材料科学与工程学院 四川绵阳 621010;2. 四川省非金属复合与功能材料重点实验室-省部共建国家重点实验室培育基地 四川绵阳 621010)
透明质酸(HA)和羧甲基纤维素(CMC)基天然高分子生物医用水凝胶具有无毒、可生物降解、良好的生物相容性和低免疫原性等优点,已广泛应用于组织工程、创伤敷料、药物释放、生物传感器、细胞封装等众多领域[1-5]。文献[6]通过氧化羧甲基纤维素(OCMC)与琥珀酸酐改性壳聚糖(NSC)原位交联制备了可注射OCMC/NSC水凝胶,研究了羧甲基纤维素氧化率对水凝胶药物释放行为的影响,在可注射药物传输系统中用于蛋白药物的持续释放。文献[7]通过己二酸二酰肼改性透明质酸(HAX)与聚磷酸盐(PolyP)交联制备了具有生物活性的HAX-PolyP水凝胶,该水凝胶可作为可注射活性支架在临床上应用于骨移植和骨再生。
席夫碱反应具有反应条件温和、反应迅速、操作简便、不需要外加催化剂和引发剂等优点,同时席夫碱可与其它可逆共价键或超分子相互作用形成自组装水凝胶,已成为制备化学交联水凝胶的重要手段[8-9]。由于亚胺键易水解,导致许多由改性天然高分子与氨基化合物通过席夫碱反应制备的水凝胶稳定性较差、药物释放速度较快,限制了其应用[10-11]。聚丙烯酰肼(PAH)含有大量酰肼基团,常被用作交联剂制备环氧树脂、水凝胶、药物传输基质、传感器等[12-15]。本文用高碘酸钠对HA和CMC进行部分开环氧化,分别制备了oxi-HA和oxi-CMC,同时制备了具有多酰肼基团交联位点的高分子交联剂PAH,通过席夫碱反应,化学交联制备了系列oxi-HA/oxi-CMC/PAH水凝胶,并对其微观形貌、溶胀率、降解行为、流变学性能以及药物模型BSA的体外释放行为进行了研究。
1 实验部分
1.1 试剂与仪器
羧甲基纤维素钠(CMC,800~1 200 mPa·s),高碘酸钠、牛血清蛋白(BSA)、考马斯亮蓝G250,AR,上海阿拉丁生物化学科技股份有限公司;透明质酸钠(HA,190 kDa),AR,山东银河生物科技有限公司;丙烯酸甲酯(ω,98%)、水合肼(ω,≥80%)、亚硫酸氢钠(ω,99%)、溴酸钾(ω,99%)、四丁基溴化铵(ω,98%),AR,成都市科龙化工试剂厂;磷酸盐缓冲溶液(PBS,pH值7.4),实验室配制。
ULUP-IV-100L型超纯水器,四川优普超纯科技有限公司;FD 5-5型冷冻干燥机,西盟国际集团;Nicolet-5700型傅里叶变换红外光谱仪,美国热电仪器公司;Bruker Avance 600型核磁共振波谱仪,瑞士布鲁克公司;Wyatt DAWN HELEOSⅡ 型十八角度激光光散射仪,美国怀雅特公司;Agilent 1200型高效液相色谱仪,美国安捷伦公司;HAAKE RheoStress 600型流变仪,赛默飞世尔科技有限公司;TM-1000型扫描电子显微镜,日本日立公司;UV752N型UV-vis分光光度计,上海佑科仪器设备有限公司。
1.2 水凝胶的制备
1.2.1oxi-HA及oxi-CMC的制备
以高碘酸钠为氧化剂,对HA和CMC部分开环氧化,分别制备oxi-HA和oxi-CMC[16-17]。称取6.0 g HA溶解于600 mL蒸馏水中,缓慢加入100 mL 0.15 mol·L-1的高碘酸钠水溶液,室温避光反应24 h。加入过量乙二醇终止反应,用截留分子量(MWCO)为8~14 kDa的普通干型透析袋超纯水透析,冷冻干燥,得到oxi-HA。采用碱消耗法[18]测定oxi-HA双醛基的含量,HA的氧化率约为58%。采取相同方法,将6.0 g CMC溶解于600 mL蒸馏水中,缓慢加入100 mL 0.12 mol·L-1的高碘酸钠水溶液氧化改性,制得oxi-CMC,并测定其双醛基的含量,CMC的氧化率约为43%。
1.2.2PAH的制备

1.2.3oxi-HA/oxi-CMC/PAH水凝胶的制备
将8.00 g氯化钠、0.20 g氯化钾、1.44 g磷酸氢二钠和0.24 g磷酸二氢钾溶解于超纯水中,控制pH值为7.4,定容至1 L,得到pH值7.4的PBS溶液。以PBS溶液为溶剂,分别配制0.06,0.08,0.10 g/mL的oxi-HA溶液和oxi-CMC溶液以及0.01,0.02,0.03 g/mL的PAH溶液。在37 ℃条件下,将0.1 mL oxi-HA溶液、0.1 mL oxi-CMC溶液和0.185 mL PAH溶液混合均匀,制备系列oxi-HA/oxi-CMC/PAH水凝胶。
1.3 水凝胶的溶胀行为和降解动力学研究
将冻干水凝胶样品(w0)浸泡在37 ℃的PBS溶液中,在不同时间点取出样品,用润湿滤纸吸干表面水分并称重(ws),计算水凝胶的溶胀率SR=(ws-w0)/w0。与溶胀率测定方法相似,将冻干水凝胶样品(w0)浸泡在37 ℃的PBS溶液中,在设定时间点取出样品,冷冻干燥后称重(wd),计算水凝胶的降解百分数PD=(w0-wd)/w0×100%。式中w0为水凝胶样品的初始干重,ws为不同时间点水凝胶样品的湿重,wd为不同设定时间点水凝胶样品的干重。平行测定3次。
1.4 水凝胶的流变学性能研究
在振动模式下用HAAKE RheoStress 600型流变仪(转子直径20 mm,板间距1 mm)研究37 ℃时水凝胶的流变学性能。将水凝胶样品置于流变仪平板上15 min,设置流变应力为10 Pa,角频率(ω)范围为1~100 rad·s-1,在动态频率扫描模式下测定水凝胶的储能模量(G' )和损耗模量(G'' ),评价水凝胶的黏弹性。将水凝胶样品置于流变仪平板上30 min,设置流变频率为1 Hz,在应力扫描模式下测定G' 和G'' 随剪切应力(τ)的变化,评价水凝胶的力学强度。
1.5 冻干水凝胶的微观形貌表征
将冻干oxi-HA6/oxi-CMC6/PAH3水凝胶用液氮脆断,断面喷金后,用扫描电子显微镜(SEM)观察断面的微观形貌。
1.6 水凝胶的体外药物控释性能研究
以PBS溶液为介质,在37 ℃下测定不同时刻载药水凝胶中药物模型BSA的累积释放百分数,研究水凝胶的体外药物控释性能。采用考马斯亮蓝法(Bradford法)[19]测定BSA的浓度。
2)交互功能。利用微信的聊天功能,可以设立多个微信圈,微信群是一个即时的交流平台,在群中可以发文字、视频和音频,实现良好的交流效果。微信圈创建简单,可以设立学生群,师生群,学习互助群等,微信群交流方便,可实现语音交流和视频交流,学生可以针对学习的疑惑随时向同学和老师求助,教师和同学也可随时进行回答,是释疑解惑的绝佳平台。
将100 mg考马斯亮蓝G250用50 mL 95%(ω)的乙醇溶解后,加入100 mL 85%(ω)的磷酸,用超纯水定容至1 L,过滤,得到考马斯亮蓝G250溶液。准确配制0~1.0 mg·mL-1BSA标准系列溶液,取标准系列溶液0.1 mL置于试管中,分别加入5 mL 0.1 mg·mL-1考马斯亮蓝G250溶液,混合均匀。以0.1 mL PBS溶液与5 mL考马斯亮蓝G250溶液的混合物作参比,用UV-vis分光光度计测定溶液在595 nm处的吸光度A。结果表明,在0~0.020 mg·mL-1浓度范围内,溶液吸光度A与BSA浓度c(mg·mL-1)具有良好的线性关系:A=34.205c+ 0.0517(R2=0.9991)。
将35 mg BSA溶于3 mL 0.03 g/mL的PAH溶液中,移取该溶液0.185 mL,加入到0.10 mL 0.06 g/mL的oxi-HA和0.10 mL 0.06 g/mL的oxi-CMC的混合液中,制备oxi-HA6/oxi-CMC6/PAH3载药水凝胶,冷冻干燥。将冻干载药水凝胶样品置于5 mL 37 ℃的PBS溶液中,在设定时间点取出0.1 mL释放液(同时向释放体系加入0.1 mL PBS溶液,确保介质总体积始终保持5 mL),测定t时刻释放液中BSA的浓度ct,计算t时刻BSA的累积释放量Mt=ct×5+∑ct-1×0.1和累积释放百分数Mt/M0×100%(M0为水凝胶样品中BSA的初始负载量)。
2 结果与讨论
2.1 结构表征

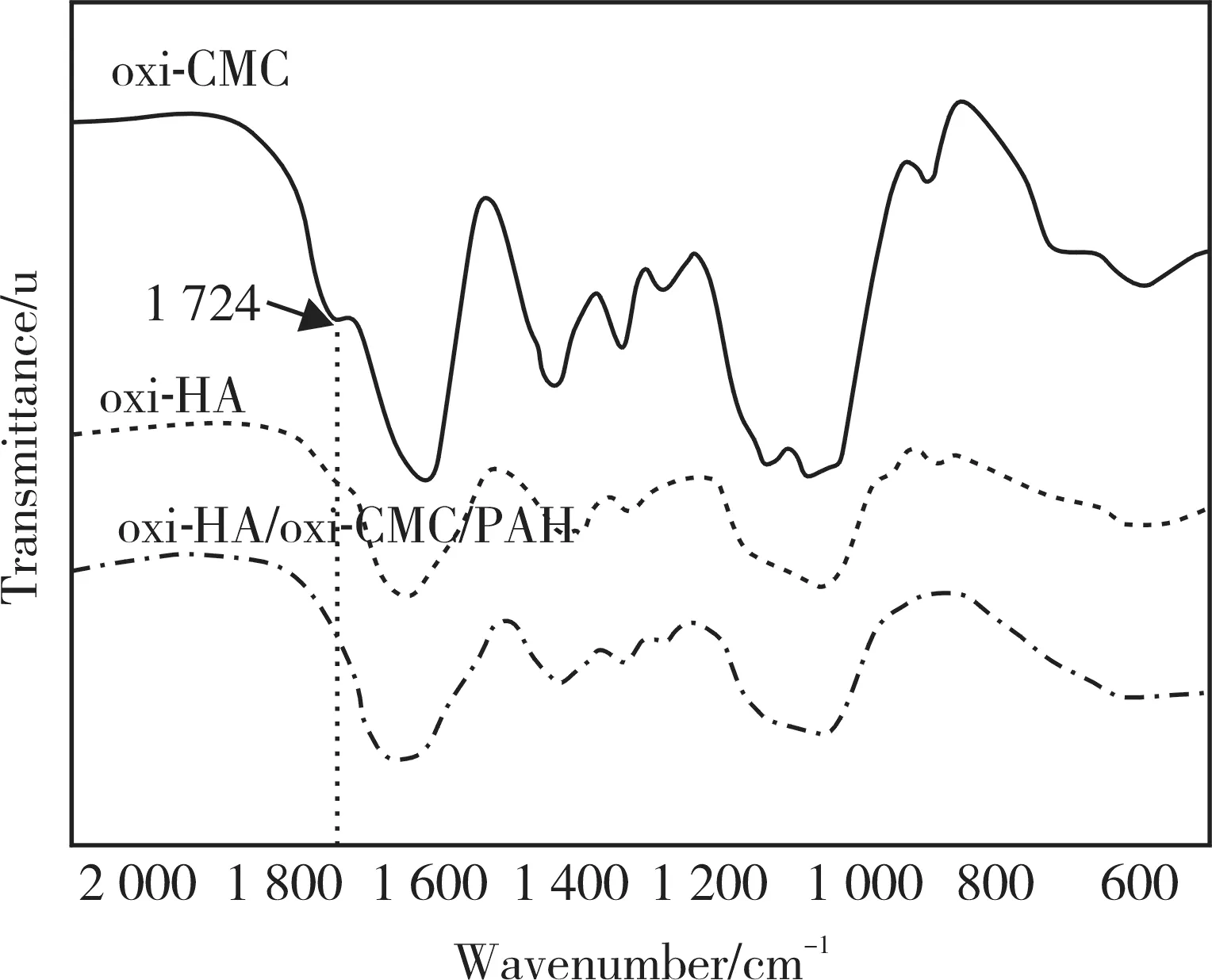
图1 oxi-CMC,oxi-HA和冻干oxi-HA/oxi-CMC/PAH水凝胶的FT-IR图Fig.1 FT-IR spectra of oxi-CMC, oxi-HA and lyophilized oxi-HA/oxi-CMC/PAH hydrogels
2.2 水凝胶的溶胀及降解行为
由表1和图2(a)-图2(c)可知,系列oxi-HA/oxi-CMC/PAH水凝胶在37 ℃ PBS溶液中均能快速溶胀,5 h接近溶胀平衡,溶胀率介于10~19之间。当oxi-HA和oxi-CMC浓度一定时,PAH浓度越高,所提供的化学交联位点(酰肼基团)越多,形成的网络结构越致密,水分子进入凝胶内部扩张三维网络结构越困难,溶胀率越小;当PAH浓度一定时,随着前驱体oxi-HA和oxi-CMC浓度的升高,前驱体提供的醛基越多,同时分子链间相互缠绕越紧密,形成的网络结构越致密,溶胀率越小。
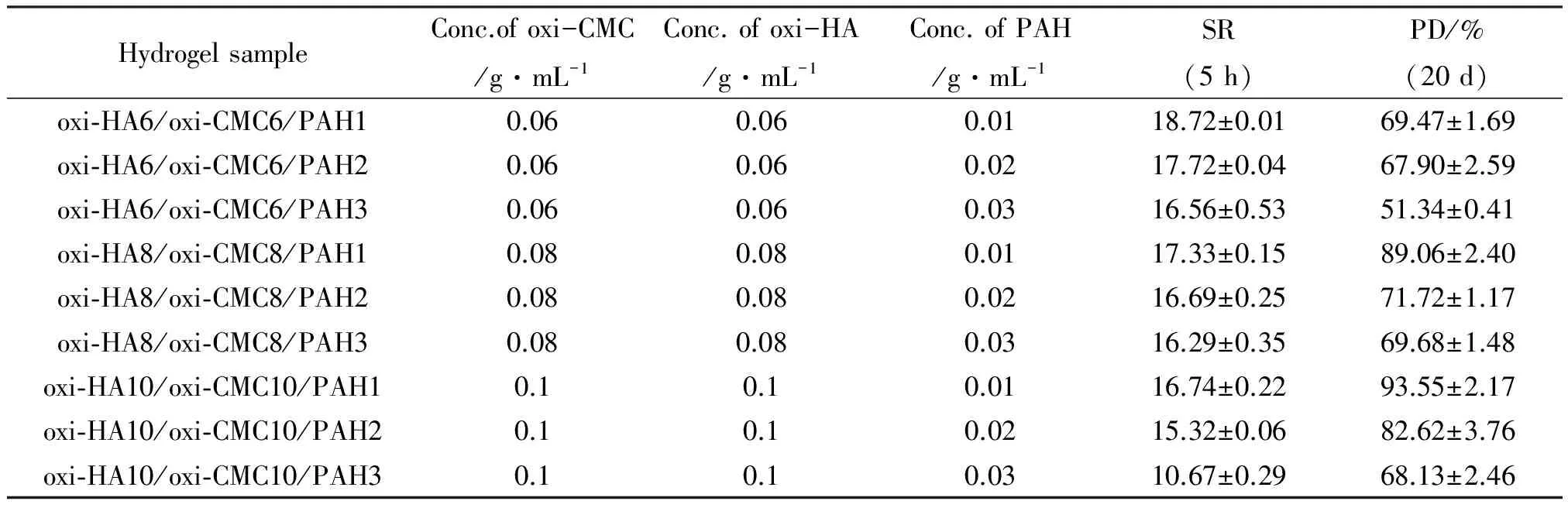
表1 oxi-HA/oxi-CMC/PAH水凝胶的溶胀率(5 h)和降解百分数(20 d)Table 1 Swelling ratio (5 h) and degradation percentage (20 d) of oxi-HA/oxi-CMC/PAH hydrogels
从表1可以看出,系列oxi-HA/oxi-CMC/PAH水凝胶在37 ℃ PBS溶液中20 d降解百分数介于50%~96%之间,其中oxi-HA6/oxi-CMC6/PAH3水凝胶的20 d降解百分数最低,为51%左右。由图2(d)-图2(f)可知,当oxi-HA和oxi-CMC浓度一定时,PAH浓度越高,网络结构越致密,降解速度越慢,20 d降解百分数越小;PAH浓度一定时,交联剂所提供的化学交联位点(酰肼基团)数量一定,oxi-HA和oxi-CMC浓度越高,水凝胶的亲水性越强,水凝胶更容易在PBS溶液中由于溶蚀而失重,表现出更快的降解速度,20 d降解百分数越大。

图2 oxi-HA/oxi-CMC/PAH水凝胶在37 ℃ PBS溶液中的溶胀率和降解百分数Fig. 2 Swelling ratio and degradation percentage of oxi-HA/oxi-CMC/PAH hydrogels in PBS at 37 ℃
不难看出,oxi-HA6/oxi-CMC6/PAHx(x=1, 2, 3)水凝胶5 h溶胀率介于16~19之间,20 d降解百分数介于50%~72%之间,具有良好的吸水性和较好稳定性。
2.3 水凝胶的流变学性能
由图3(a)可知,oxi-HA6/oxi-CMC6/PAHx(x=1,2,3)水凝胶的储能模量G' 明显大于损耗模量G'',在一定角频率范围内(ω=1~100 rad·s-1),G' 和G'' 变化不大,表明水凝胶具有较完整的三维网络结构和一定的耐剪切性;PAH浓度越高,G' 和G'' 越大,水凝胶黏弹性越好。图3(b)为oxi-HA6/oxi-CMC6/PAHx(x=1,2,3)水凝胶的抗屈服能力测试曲线,前驱体浓度一定时,PAH浓度越高,水凝胶屈服应力值越大,其中oxi-HA6/oxi-CMC6/PAH3水凝胶屈服应力值最大,达到371 Pa。
溶胀、降解行为及流变学性能研究结果表明,oxi-HA6/oxi-CMC6/PAH3水凝胶的综合性能最好。
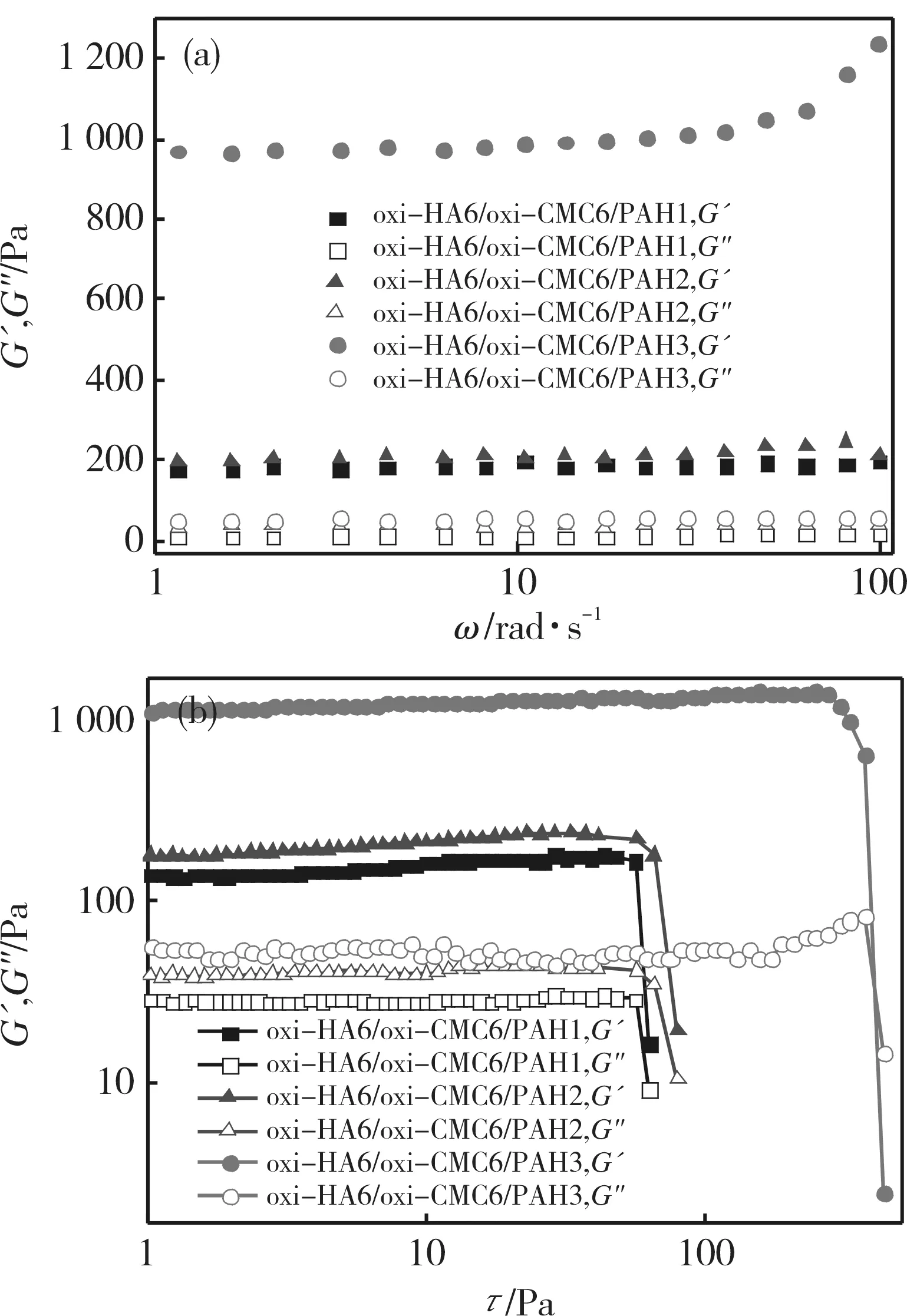
图3 oxi-HA6/oxi-CMC6/PAHx(x=1,2,3)水凝胶的G' 和G'' 随角频率和剪切应力的变化曲线Fig. 3 Plots of G' and G'' versus ω(1-100 rad·s-1) and versus τ of oxi-HA6/oxi-CMC6/PAHx(x=1,2,3) hydrogels
2.4 冻干水凝胶的微观形貌
冻干oxi-HA6/oxi-CMC6/PAH3水凝胶断面的微观形貌如图4所示,可以看出,水凝胶表现出连续的三维网络结构,其平均孔隙直径为80~200 μm,该结构有利于oxi-HA6/oxi-CMC6/PAH3水凝胶潜在应用于药物传输和细胞封装等领域。

图4 oxi-HA6/oxi-CMC6/PAH3水凝胶的SEM图Fig.4 SEM image of oxi-HA6/oxi-CMC6/PAH3 hydrogel
2.5 水凝胶的体外药物控释性能
载药水凝胶的药物释放机制有扩散控制、溶胀控制、降解控制、渗透压控制、化学反应控制等,物理方式载药的水凝胶体系,其主要药物释放机制为扩散控制、溶胀控制和降解控制等[20-21]。
oxi-HA6/oxi-CMC6/PAH3载药水凝胶中蛋白药物模型BSA在37 ℃ PBS溶液中的释放曲线如图5所示。在初始阶段,BSA释放较快,表现出一定程度的“突释”现象,24 h时累积释放达到52%左右,这主要是由于水凝胶在37 ℃的PBS溶液中能够快速达到溶胀平衡(5 h左右),水凝胶网络结构被快速扩张,同时水凝胶内部与外部介质间存在较大的BSA浓度梯度,而干凝胶的孔隙尺寸(80~200 μm)远大于BSA的流体动力学直径(7.2 nm)[22],因此BSA分子可在水凝胶三维网络结构中自由扩散,并快速扩散到外部介质中,此阶段BSA的释放主要通过扩散机制和溶胀机制控制。
随着时间延长(24 h以后),BSA释放速度明显减缓,这主要是由于在初始阶段(24 h以内)的快速释放,使载药水凝胶内部与外部介质之间的BSA浓度差减小,扩散释放速度明显减缓,此时BSA的释放速度主要决定于BSA的扩散速度和水凝胶的降解速度,BSA的释放由扩散机制和降解机制共同控制。由图2(d)可以看出,oxi-HA6/oxi-CMC6/PAH3水凝胶在第7 d的降解百分数为38%左右,而载药水凝胶中BSA的7 d累积释放达到86%左右,因此可以推断,扩散控制在BSA的释放机制中仍然占据十分重要的地位。
综上所述,在37 ℃ PBS溶液中,oxi-HA6/oxi-CMC6/PAH3载药水凝胶中药物模型BSA的释放通过扩散机制、溶胀机制和降解机制共同控制,表现出较好的药物控释能力,可应用于蛋白类药物的短期控释。

图5 载药oxi-HA6/oxi-CMC6/PAH3水凝胶在37 ℃ PBS溶液中BSA的释放曲线Fig.5 The BSA release profiles from drug-loaded oxi-HA6/oxi-CMC6/PAH3 hydrogel in PBS at 37 ℃
3 结论
以HA和CMC为原料,通过高碘酸钠部分开环氧化,制备了oxi-HA和oxi-CMC;以丙烯酸甲酯为原料,制备了具有多酰肼基团交联位点的高分子交联剂PAH,通过席夫碱反应制备了系列改性天然高分子基水凝胶oxi-HA/oxi-CMC/PAH。结果表明,在37 ℃ pH值7.4的PBS溶液中,系列水凝胶均能快速溶胀,oxi-HA6/oxi-CMC6/PAH3水凝胶5 h溶胀率达到16左右;oxi-HA6/oxi-CMC6/PAH3水凝胶的稳定性最好,20 d降解率约为51%;载药oxi-HA6/oxi-CMC6/PAH3水凝胶中BSA的7 d累积释放率为86%左右,蛋白药物模型BSA的释放通过扩散机制、溶胀机制和降解机制控制。基于oxi-HA6/oxi-CMC6/PAH3水凝胶较好的综合性能,有望应用于药物传输和细胞封装等领域。
[1]REEVES R, RIBEIRO A, LOMBARDO L, et al. Synthesis and characterization of carboxymethyl-cellulose-methacrylate hydrogel cell scaffolds [J]. Polymers, 2010, 2(3): 252-264.
[2]MINABERRY Y, CHIAPPETTA D A, SOSNIK A, et al. Micro/nanostructured hyaluronic acid matrices with tuned swelling and drug release properties [J]. Biomacromolecules, 2013, 14(1): 1-9.
[3]BORUAH M, GOGOI P, MANHAR A, et al. Biocompatible carboxymethylcellulose-g-poly(acrylic acid)/OMMT nanocomposite hydrogel for in vitro release of vitamin B12[J]. RSC Advances, 2014, 4(83): 43865-43873.
[4]PRESTWICH G D, MARECAK D M, MARECEK J F, et al. Controlled chemical modification of hyaluronic acid: synthesis, applications, and biodegradation of hydrazide derivatives [J]. Journal of Controlled Release, 1998, 53(1-3): 93-103.
[5]YAO J, FAN Y, DU R H, et al. Amphoteric hyaluronic acid derivative for targeting gene delivery [J]. Biomaterials, 2010, 31(35): 9357-9365.
[6]LÜ S Y, LIU M Z, NI B L. An injectable oxidized carboxymethylcellulose/N-succinyl-chitosan hydrogel system for protein delivery [J]. Chemical Engineering Journal, 2010, 160(2):779-787.
[7]WU A T, AOKI T, SAKODA M, et al. Enhancing osteogenic differentiation of MC3T3-E1 cells by immobilizing inorganic polyphosphate onto hyaluronic acid hydrogel [J]. Biomacromolecules, 2015, 16(1):166-173.
[8]SCHIFF H. Mittheilungen aus dem Universitätslaborato rium in Pisa: Eine neue Reihe organischer Basen [J]. European Journal of Organic Chemistry. 1864, 131(1): 118-119.
[9]ZHANG H W, QADEER A, CHEN W. In situ gelable interpenetrating double network hydrogel formulated from binary components: thiolated chitosan and oxidized dextran [J]. Biomacromolecules, 2011, 12(5): 1428-1437.
[10] SHEN Y Q, LI X, HUANG Y W, et al. pH and redox dual stimuli-responsive injectable hydrogels based on carboxymethyl cellulose derivatives [J]. Macromolecular Research, 2016, 24(7): 602-608.
[11] LI N N, FU C P, ZHANG L M. Using casein and oxidized hyaluronic acid to form biocompatible composite hydrogels for controlled drug release [J]. Materials Science & Engineering C-Materials for Biological Applications, 2014, 36(1): 287-293.
[12] KUMAR A, UJJWAL R R, MITTAL A, et al. Polyacryloyl hydrazide: An efficient, simple, and cost effective precursor to a range of functional materials through hydrazide based click reactions [J]. ACS Applied Materials & Interfaces, 2014, 6(3): 1855-1865.
[13] GODULA K, BERTOZZI C R. Synthesis of glycopolymers for microarray applications via ligation of reducing sugars to a poly(acryloyl hydrazide) scaffold [J]. Journal of the American Chemical Society, 2010, 132(29): 9963-9965.
[14] BAE Y, NISHIYAMA N, FUKUSHIMA S, et al. Preparation and biological characterization of polymeric micelle drug carriers with intracellular pH-triggered drug release property: tumor permeability, controlled subcellular drug distribution, and enhanced in vivo antitumor efficacy [J]. Bioconjugate Chemistry, 2013, 16(1): 122-130.
[15] BAE Y, FUKUSHIMA S, HARADA A, et al. Design of environment-sensitive supramolecular assemblies for intracellular drug delivery: polymeric micelles that are responsive to intracellular pH change [J]. Angewandte Chemie International Edition, 2003, 42(38): 4640-4643.
[16] BULPITT P, AESCHLIMANN D. New strategy for chemical modification of hyaluronic acid: preparation of functionalized derivatives and their use in the formation of novel biocompatible hydrogels [J]. Journal of Biomedical Materials Research, 1999, 47(2):152-169.
[17] SHENG X Y, LI X, LI M T, et al. An injectable oxidized carboxymethyl cellulose/polyacryloyl hydrazide hydrogel via Schiff base reaction [J]. Australian Journal of Chemistry, 2017, https://doi.org/10.1071/CH17214.
[18] HOFREITER B T, ALEXANDER B H, WOLFF I A. Rapid estimation of dialdehyde content of periodate oxystarch through quantitative alkali consumption [J]. Analytical Chemistry, 1955, 27(12):1930-1931.
[19] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantites of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(1-2): 248-254.
[20] MARTELLINI F, MEI L H I, BALIO J L, et al. Water and drug transport in radiation-crosslinked poly(2-methoxyethyl-acrylate-co-dimethylacrylamide) and poly(2-methoxyethylacrylate-co-acrylamide) hydrogels [J]. Radiation Physics and Chemistry, 2003, 66(2): 155-159.
[21] CHANGEZ M, BURUGAPALLI K, KOUL V, et al. The effect of composition of poly(acrylic acid)-gelatin hydrogel on gentamicin sulphate release: in vitro [J]. Biomaterials, 2003, 24(4): 527-536.
[22] BAE K H, WANG L S, KURISAWA M. Injectable biodegradable hydrogels: progress and challenges [J]. Journal of Materials Chemistry B, 2013, 1(40): 5371-5388.

