打碗花根状茎介导的自我/非我识别研究
朱 莉,苗文秀,李竟才,干建平,郑永良,项 俊
动物具有神经系统,可以进行自我/非我身份识别[1],并且做出灵敏反应以使自身利益最大化。植物固着生长且没有神经系统,但植物进化出了一系列可塑性机制来适应周围生物和非生物的异质性环境[2]。根据达尔文进化论,自然选择会选择固定那些使植物自身竞争(植株各部分之间或者同一克隆分株之间)最小化的机制,以最大化自身适合度;而区分自我和非我植株个体是植物最小化竞争行为的生理基础,因此,自然选择同时会选择固定那些使植物可以识别自我/非我的机制。最终,当异己存在时植株会对自身的生长模式进行适当的调整,来提高个体的适合度。
研究发现,有些植物根系在接触同种其他个体根系时,相比接触自身根系,其生长会受到抑制[3],或者产生相互分离现象[4]。多种豆科植物在与同种邻居共同生长时,则会产生根系增生现象,且导致繁殖分配下降,因此豆科植物响应根系自我/非我识别的现象被认为是一种“公地悲剧”[5-7]。 克隆植物野草莓的相连分株相比不相连分株,根系之间会相互分离且积累更多生物量[8]。克隆植物野牛草同一个体相连分株相比来自不同个体分株,会产生更少和更短的根系;而相连分株断开则导致产生更多、更长的根系[9]。这两项研究不仅表明克隆植物可以进行自我/非我识别,还表明识别是通过分株间的物理连接实现的。
根状茎是打碗花(Calystegia hederacea)的主要繁殖方式,其易折断且每一小段都可以长成新株的特性使打碗花可以作为研究自我/非我识别的理想材料[10]。近年来,国内外关于根系可塑性研究广受关注[11],但对自我/非我识别现象学界尚存质疑且未得出一致结论[12-14]。 另外,打碗花是危害中国玉米、小麦等作物的一种常见、顽固杂草[15]。日本学者研究表明,打碗花根状茎越冬时发生自然折断的特性,使其可以在每年进行犁耕的一年生作物田里生长[16]。国内关于打碗花的研究主要集中在除草剂除杂及打碗花除草剂抗性等方面[15],也有一些研究从形态学及营养生理学方面探讨了打碗花作为地被植物及野生蔬菜的可能性[17],而生态学方面的研究国内尚不多见。本研究以打碗花为材料开展控制试验,试图初步判断打碗花是否具备自我/非我识别能力,以及根状茎连接是否介导了这种识别行为,并为打碗花的田间除杂及农业应用提供科学依据。
1 材料与方法
1.1 材料
试验选用的研究对象打碗花(Calystegia hederacea)为旋花科打碗花属植物,多年生草质藤本,以根状茎和种子繁殖,根状茎易折断,但每一小段都可以长成新的植株。长江流域3-4月出苗,花果期5-7月。2017年3月,于黄冈师范学院北校区和校外2 km处荒地分别挖取打碗花出土3 cm以内及相连根状茎,移植至南区绿园同质种植。
1.2 方法
2017年4月,待移植的打碗花生出不定根后,选取生长一致的幼苗开展温室控制试验。种植基质是泥炭土,花盆(上口直径28 cm,下口直径23 cm,高24 cm)底部用棉花塞住出水孔,避免根系下扎至花盆外。试验设置3个处理,分别是取根状茎相连的两株打碗花幼苗,一起移植至花盆(connected ramets,处理CR),取根状茎相连的两株打碗花幼苗,从连接处断开根状茎,再一起移植至花盆(unconnected ramets,处理UCR),分别取一株来自校内的幼苗和一株来自校外的幼苗,一起移植至花盆(ramets from different genets,处理 RFDG)。 处理 CR、处理 UCR重复4次,处理RFDG重复10次。搭设攀爬架,每个花盆有单独一根包塑铁丝供打碗花向上缠绕。打碗花生长过程中只保留主茎,基部分枝一经长出即去除。
4月26日至5月14日,每隔1~3 d测量茎长;5月2日至5月14日,每隔1~2 d数叶片数目;记录每日去除的分枝数。5月14日收获打碗花的地上茎、叶和地下部分,地下根和根状茎用自来水冲洗干净,各部分生物量分别烘干称重。
用标准化主轴法(standarized major axis tests)对打碗花茎长、叶数随时间变化进行线性回归分析,并比较不同处理斜率差异是否显著[18]。该分析使用软件 “STANDARDIZED MAJOR AXIS TESTS and ROUTINES VERSION 2.0”进行。用 ANOVA 分析不同设置下各生物量及生物量分配是否有显著性差异,并用最小显著性差异法(LSD法)进行两两比较。数据分析之前,每盆两株取均值。ANOVA分析使用软件 SPSS 17.0进行。
2 结果与分析
2.1 不同处理打碗花地上茎长随时间变化
从图1可以看出,3组不同处理的打碗花地上茎长都随时间的延长而增加,且与时间有很好的线性关系(CR:R2=0.967;UCR:R2=0.743;RFDG:R2=0.987)。 处理 CR、处理 UCR、处理 RFDG 回归线的斜率分别是 1.477、0.286、2.131。 SMA 分析显示,根状茎断开处理(UCR)的斜率显著小于根状茎相连处理(CR)(P=0.003)和来自不同克隆分株的处理(RFDG)(P=0.002), 而后两者(UCR 和 RFDG)无显著差异(P=0.741)。
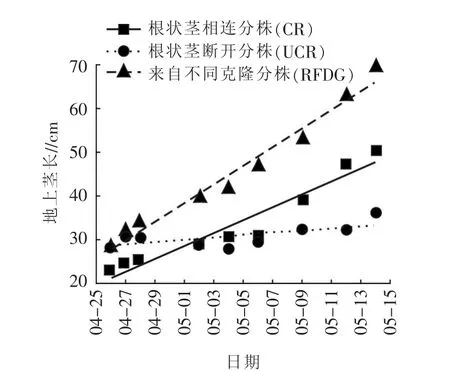
图1 不同处理打碗花地上茎长随时间变化
2.2 不同处理下打碗花叶片数目随时间的变化
从图2可以看出,3组处理的叶片数目都和时间有很好的线性关系(CR:R2=0.974 78;UCR:R2=0.931 74;RFDG:R2=0.986)。 处理 CR、处理 UCR、处理 RFDG 回归线的斜率分别是 1.467、1.202、1.581。但SMA分析显示3个处理斜率无显著差异,即3个处理叶片数目增加的速度无差异(P=0.487)。但 3条回归线的截距不同,RFDG组显著大于CR和UCR组,CR、UCR之间无差异。

图2 不同处理打碗花叶片数目随时间变化
2.3 不同处理打碗花各部分生物量及生物量分配比较
ANOVA分析显示,处理 CR、处理 UCR、处理RFDG的打碗花地下部分生物量均值分别为0.132、0.134 和 0.278 g,但统计学三者无显著性差异(F=1.327,P=0.313)。 地上茎生物量均值分别为 0.120、0.047和 0.177 g,两两比较仅 UCR 和 RFDG 差异显著(P=0.008)。 叶生物量均值分别是 0.199、0.080 和0.320 g,两两比较仅UCR组和RFDG组差异显著(P=0.004)。 三组总生物量均值分别是 0.450、0.262和0.776 g,两两比较仅UCR组和RFDG组差异显著(P=0.029)(图 3)。

图3 不同处理打碗花各部分生物量比较
由于样本量太小,生物量绝对值统计结果无差异,因此进一步比较不同处理生物量分配数据,发现处理UCR的地下生物量分配显著大于处理CR和处理RFDG,且处理CR、处理RFDG无差异。处理UCR的地上茎分配显著小于处理CR和处理RFDG,且处理CR大于处理RFDG。处理UCR的叶分配显著小于处理CR和处理RFDG,且处理CR和处理RFDG无显著差异(图4)。
另外,将每株打碗花不同时间点去除的分枝数加合,计算每株打碗花基部总分株数目。处理CR、处理UCR、处理RFDG打碗花的基部分枝数均值分别是 3.625、0.75 和 1,两两比较发现,处理 CR 分枝数目明显大于处理 UCR(P=0.015)和处理 RFDG(P=0.009),后两者无显著性差异(P=0.595)。

图4 不同处理打碗花的各部分生物量分配比较
3 小结与讨论
试验结果显示,根状茎断开的同一克隆分株相比根状茎相连分株,虽然地下生物量(包括根状茎和根系)无显著变化,但地下生物量分配显著增加,且显著影响了地上部分生长,包括茎的生长速度下降,基部分枝显著减少,地上茎分配和叶分配都下降。这说明,同一克隆分株间根状茎连接的断开抑制了地上部分的生长,且改变了打碗花的资源分配策略,使得资源分配向地下部分倾斜。分析原因,同一克隆分株间的连接可能是打碗花的一种自我/非我识别方式,分株之间通过横走茎连接实现自我身份的认同,将资源更多投入到地上资源;而根状茎的断开阻碍了这种身份识别,从而抑制了地上部分的生长。本试验结果显示,同一克隆相连分株的分枝能力大于其他两个不相连处理,这可能体现出物理连接使得打碗花保持高的分株能力。若保留这些分株,很可能相连分株的地上茎叶分配会进一步提高,根系分配进一步下降。
克隆植物的生理整合是指资源(如光合同化物、矿质养分和水分等)和信息在相互连接的分株间实现转移与共享,这不仅可有效缓解因资源的异质性所致的克隆分株在资源获得上的差异性,同时可使克隆植物通过克隆生长实现空间的移动与拓展,是克隆植物有效利用异质分布的资源,提高其存活率与生长的一种重要的适应对策[19-21]。本试验结果支持了该理论,表明根状茎连接介导了打碗花的生理整合,从而最大化克隆植株的适合度。
Gruntman等[9]发现,野牛草同一克隆相连分株断开时间越久,越表现得像不同克隆分株,表明是物理连接而不是遗传身份介导了邻株之间的身份识别。而本试验中,相连分株断开后的生长模式并未趋向不同克隆分株的生长模式,因此表明,对于打碗花,基于遗传身份的亲缘识别,可能与基于根状茎连接的自我/非我识别,共同决定了相邻植株的身份识别系统并指导植株生长策略。植物的自我/非我识别和亲缘识别可能是两个不同的过程。Biedrzycki等[22]报道当液态培养介质中存在分泌物抑制剂时,拟南芥的亲缘识别能力被阻止,而自我/非我识别能力没有受到影响。另外,植物的自我/非我识别和亲缘识别二者可能在识别和响应的机制上有所不同[23]。
试验的不足之处是未收集打碗花繁殖生物量数据,而繁殖分配及种子数目等是衡量个体适合度的关键指标。同时,打碗花是克隆植物,由横走茎上发出新的分株是其主要繁殖方式,也是衡量适合度的重要方面。试验未区分土壤中的横走茎、新分枝及根系,所以无法衡量不同处理之间繁殖分配的差异。后续试验应在这两个方面进一步改善。
参考文献:
[1] BOEHM T.Quality Control in Self/Nonself Discrimination [J].Cell,2006,125(5):845.
[2] SULTAN S E.Plant developmental responses to the environment:E co-devo insights[J].Current Opinion in Plant Biology,2010,13(1):96-101.
[3] MAHALL B E,CALLAWAY R M.Effects of regional origin and genotype on intraspecific root communication in the desert shrub Ambrosia dumosa(Asteraceae)[J].American Journal of Botany,1996,83(1):93-98.
[4] SCHENK H J,CALLAWAY R M,MAHALL B E.Spatial root segregation:Are plants territorial[J].Advances in Ecological Research,1999,28(8):145-180.
[5] O'BRIEN E E,BROWN J S.Games roots play:effects of soil volume and nutrients[J].Journal of Ecology,2008,96(3):438-446.
[6] MAINA G G,BROWN J S,GERSANI M.Intra-plant versus inter-plant root competition in beans:avoidance,resource matching or tragedy of the commons[J].Plant Ecology,2002,160:235-247.
[7] GERSANI M,BROWN J S,O'BRIEN E E,et al.Tragedy of the commons as a result of root competition[J].Journal of Ecology,2001,89(4):660-669.
[8] HOLZAPFEL C,ALPERT P.Root cooperation in a clonal plant:connected strawberries segregate roots[J].Oecologia,2003,134(1):72-77.
[9] GRUNTMANM,NOVOPLANSKYA.Physiologically mediated self/non-self discrimination in roots[J].Proceedings of the National Academy of Science,2004,101(11):3863-3867.
[10] CHEN B J,VERMEULEN P J,DURING H J,et al.Testing for disconnection and distance effects on physiological selfrecognition within clonal fragments of Potentilla reptans [J].Frontiers in Plant Science,2015,6(215):215.
[11] HODGE A.Plant Root Interactions[M].Springer Berlin Heidelberg,2012.157-169.
[12] MILLA R,FORERO D M,ESCUDERO A,et al.Growing with siblings:a common ground for cooperation or for fiercer competition among plants?[J].Proceedings Biological Sciences,2009,276(1667):2531.
[13] SMY C KA J,HERBEN T.Phylogenetic patterns of tragedy of commons in intraspecific root competition[J].Plant and Soil,2017,417(1-2):1-11.
[14] NORD E A,ZHANG C C,LYNCH J P.Root responses to neighbouring plants in common bean are mediated by nutrient concentration rather than self/non -self recognition [J].Functional Plant Biology,2011,38(12):941-952.
[15]刘 延,崔海兰,黄红娟,等,抗草甘膦杂草及其抗性机制研究进展[J].农药学学报,2008,10(1):10-14.
[16] ITO M,TAKAGI K,YOSHINO M.Rhizome dynamics in Calystegia japonica Choisy and Calystegia hederacea Wall.in relation to overwintering[J].Weed Biology & Management,2010,5(3):137-142.
[17]何功秀,张 琳,湖南大围山区几种森林蔬菜营养成分分析[J].北方园艺,2009(10):77-79.
[18] WARTON D I,WRIGHT I J,FALSTER D S,et al.Bivariate line-fitting methods for allometry[J].Biological Reviews of the Cambridge Philosophical Society,2006,81(2):259-291.
[19] LIU H D,YU F H,HE W M,et al.Are clonal plants more tolerant to grazing than co-occurring non-clonal plants in inland dunes?[J].Ecological Research,2007,22(2):502-506.
[20] COOK RE.Growth and D evelopment in C lonal P lant P opulations[M].New Haven: Yale University Press,1985,259-296.
[21]董 鸣.异质性生境中的植物克隆生长:风险分摊[J].植物生态学报,1996,20(6):543-548.
[22] BIEDRZYCKI M L,JILANY T A,BAIS S A,et al.Root exudates mediate kin recognition in plants[J].Communicative &Integrative Biology,2010,3(1):28.
[23] CALLAWAY R M,MAHALL B E.Plant ecology:F amily roots[J].Nature,2007,448(7150):145-147.

