肾透明细胞癌中长链非编码RNA SNHG12的生物信息学分析
张晓彤,周亚男,朱玉翠,胡成进,曹源
1.潍坊医学院 医学检验学系,山东 潍坊261053,2.济南市第三人民医院 检验科,山东 济南250132;3.济南军区总医院 实验诊断科,山东 济南250031
肾癌是常见癌症之一,其中肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)占70%~80%,是最具代表性的亚型,发病率逐年上升[1-2]。较其他癌症而言,肾癌相关生物标志物较少,早期诊断困难,且肾癌患者对常规化疗和放射治疗反应差,缺乏靶向治疗药物,导致晚期患者(Ⅳ期)的五年生存率较低[3]。因此,寻找诊断及伴随诊断相关生物学标志物、探索发病机制以及找到新的治疗靶点至关重要。长链非编码RNA(long non-coding RNA,lncRNA)作为新的潜在生物学标志物和癌症治疗靶点成为研究热点。lncRNA是一类长度大于200 个碱基且无蛋白质编码能力的转录物,参与基因表达的多级调节,其异常表达和突变与肿瘤发生、转移密切相关[4-7]。此外,lncRNA 能在癌症中特异表达,并稳定存在于循环体液中[8-10],可作为癌症的新型生物学标志物和治疗靶标,具有很强的应用前景。SNHG12是小核仁RNA 宿主基因,作为一种新的lncRNA,被证实在肺腺癌、结直肠癌、乳腺癌、人骨肉瘤细胞、鼻咽癌细胞、人子宫内膜癌等多种癌症类型中上调,在癌细胞增殖和迁移中发挥重要作用[11]。然而,肾透明细胞癌中SNHG12的表达水平及其临床意义尚不清楚。本研究旨在探讨SNHG12在肾透明细胞癌中的表达水平及意义,利用生物信息学方法进行靶基因预测,为后续SNHG12在ccRCC中的机制研究提供借鉴。
1 材料与方法
1.1 SNHG12在ccRCC中的表达及生存分析
利用UALCAN 数据库分析ccRCC 中SNHG12的表达水平,分析其与种族、性别、肿瘤分级之间的关系,并对SNHG12进行生存分析。采用logrank检验,运用Kaplan-Meier(KM plotter,http://www.kmplot.com)绘制生存曲线。
1.2 预测与SNHG12相互作用的microRNA
通过RegRNA2.0(http://regrna2.mbc.nctu.edu.tw/index.html)预测SNHG12序列上可能存在的mi⁃croRNA 结合位点。以最小折叠自由能(minimum folding freeenergy,MFE)≤-20、score 值≥150 为标准进 行 预测,score值为lncRNA 与microRNA 配对得分,得分越高表示两者的结合能力越强。同时,通过HMDD v3.0(http://www.cuilab.cn/hmdd)检索分析与ccRCC 有关的microRNAs,取此2 种分析结果的交集预测在ccRCC 中可能与SNHG12相互作用的microRNAs。用starBase v3.0 数据库(http://starbase.sysu.edu.cn/index.php)探究SNHG12与mi⁃croRNA 表达水平的相关性。
1.3 预测microRNA靶基因
用starBase v3.0数据库、Targetscan(http://www.targetscan.org/vert_61/)及microT-CDS(http://www.microrna.gr/webServer)在线分析平台预测mi⁃croRNA 的靶基因。取3个平台预测交集以避免产生过多假阳性结果,进一步分析其调控网络。
1.4 SNHG12-microRNAs-mRNAs相互作用网络的构建
分别预测SNHG12潜在调控的microRNAs,分析其可能调控的mRNAs,通过Cytoscope 平台整合SNHG12、microRNAs 和mRNAs 三者信息,构建SN⁃HG12-microRNAs-mRNAs 网络调控关系。
1.5 microRNA靶基因的功能分析
靶基因的生物学功能分析利用FunRich(http://www.funrich.org/)平台进行,Gene Ontology(GO)中的细胞组分(cell component)、分子功能(molec⁃ular function)和生物过程(biological process)条目以及Pathways 中的KEGG 通路条目被用于分析。
2 结果
2.1 SNHG12在ccRCC中的表达水平及与患者生存时间的关系
利用UALCAN 数据库分析发现ccRCC 中的SNHG12表达量明显增高(图1A,P<0.001),各肿瘤分级均比正常对照表达增高(图1B,P值均小于0.001),但分级之间SNHG12的表达水平无差异(图1B,P值均大于0.05)。SNHG12表达量在男女性别之间有差异,男性患者的表达更高(图1C,P<0.001)。此外,不同人种ccRCC 患者间SNHG12的表达无明显差异(图1D,P值均大于0.05)。生存曲线结果显示SNHG12高表达患者的总生存期(overall survival,OS)较低表达患者明显缩短(图2,P=0.0049)。
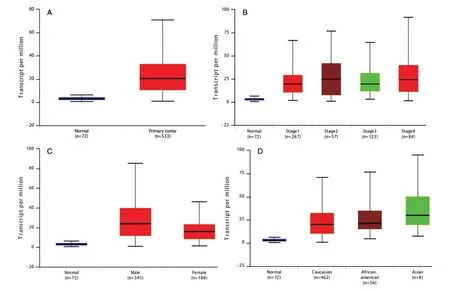
图1 SNHG12 在ccRCC 中的表达水平
2.2 与SNHG12相互作用的microRNAs
RegRNA2.0 生物学软件预测显示,共有273 个microRNAs 能 够 与SNHG12结 合。HMDD v3.0 数据库检索发现18 个与肾肿瘤有关的microRNAs,分别为hsa-mir-106a、hsa-mir-138、hsa-mir-141、hsa-mir-155、hsa-mir-183、hsa-mir-192、hsa-mir-200c、hsa-mir-203、hsa-mir-21、hsa-mir-215、hsamir-23b、hsa-mir-27a、hsa-mir-381、hsa-mir-454、hsa-mir-590、hsa-mir-34a、hsa-mir-362、hsa-mir-497。其 中,hsa-miR-138-5p、hsa-miR-454-3p、hsa-miR-497-5p与SNHG12结合的可能性非常大。用starBase v3.0 数据库探究SNHG12与mi⁃croRNA 表达水平的相关性,结果显示SNHG12在ccRCC 中的表达水平与hsa-miR-138-5p、hsamiR-454-3p、hsa-miR-497-5p均呈正相关(r值分别为0.124、0.094、0.085,P值均小于0.05)(图3)。
2.3 microRNAs-mRNAs调控网络
通 过targetscan、starBase v3.0 及microT-CDS平台共同预测这3 个microRNAs 的靶基因,结果显示可能存在288 个靶基因受这3 个microRNAs调控。其中,hsa-miR-138-5p、hsa-miR-454-3p和hsa-miR-497-5p的靶基因分别有171、52、65 个。hsa-miR-138-5p的靶基因数量较多,可能参与更为复杂的调控通路。
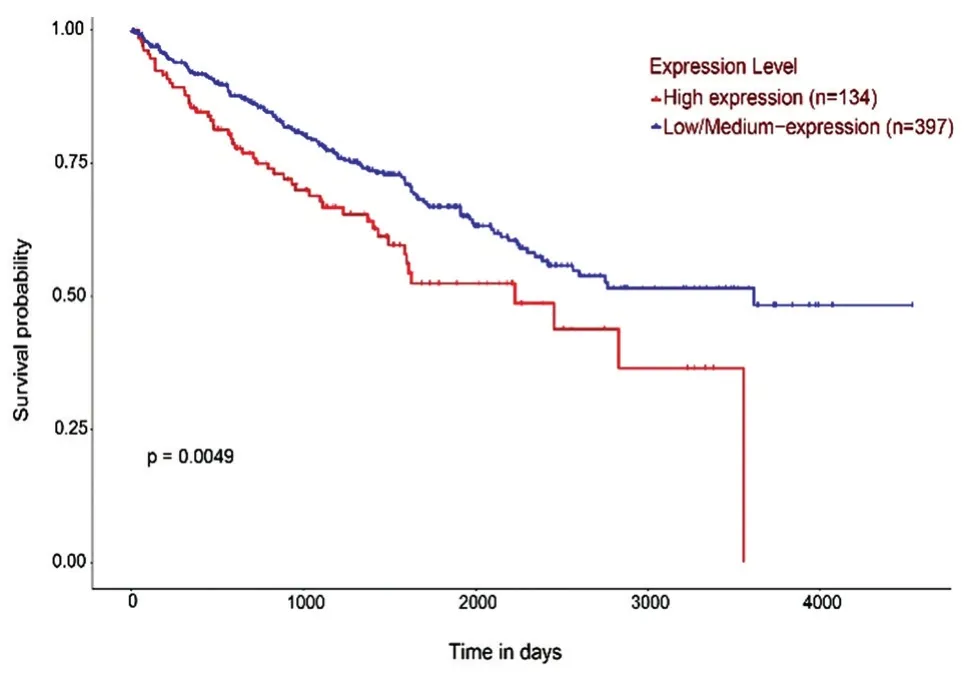
图2 SNHG12 的表达与ccRCC 患者的生存关系
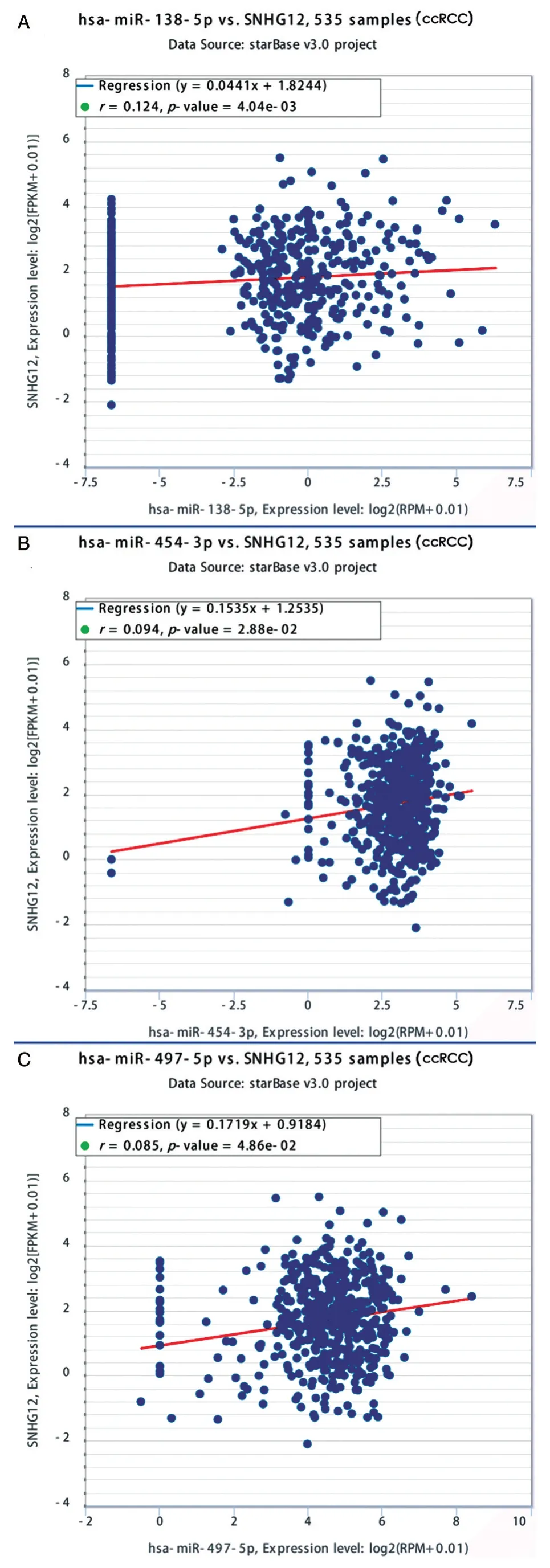
图3 SNHG12 与3 种microRNAs 的相关性分析
2.4 SNHG12-microRNAs-mRNAs调控网络
结合以上SNHG12-microRNAs与microRNAsmRNAs网络,最终建立了SNHG12在ccRCC中的SNHG12-microRNAs-mRNAs调控网络,包括283个节点和291条边,283个节点代表1个SNHG12、3个microRNAs和279个mRNAs,291条边表示它们之间存在291种相互作用关系(图4)。SNHG12位于该网络中心,调节与之结合的hsa-miR-138-5p、hsa-miR-454-3p、hsa-miR-497-5p,进而调控下游279个靶基因。其中hsa-miR-138-5p与hsamiR-454-3p共同调节CNOT6L、ZNF275、PLLP、ADCY1、ZEB2,hsa-miR-138-5p与hsa-miR-497-5p共同调节CCND3、PAPPA、MINK1,hsa-miR-454-3p与hsa-miR-497-5p共同调节ZNF609。
2.5 microRNA靶基因的功能分析
为预测SNHG12可能参与的生物过程以及信号通路,将参与SNHG12-microRNAs-mRNAs的3个microRNAs靶基因提交到FunRich平台,进行GO及KEGG pathway功能分析。GO分析结果显示,microRNA靶基因在碱基、核苷、核苷酸和核酸代谢调节过程高度富集(图5)。KEGG pathway分析显示,microRNA靶基因高度富集到内皮素(endothelins)、IFN-γ等介导的信号通路。
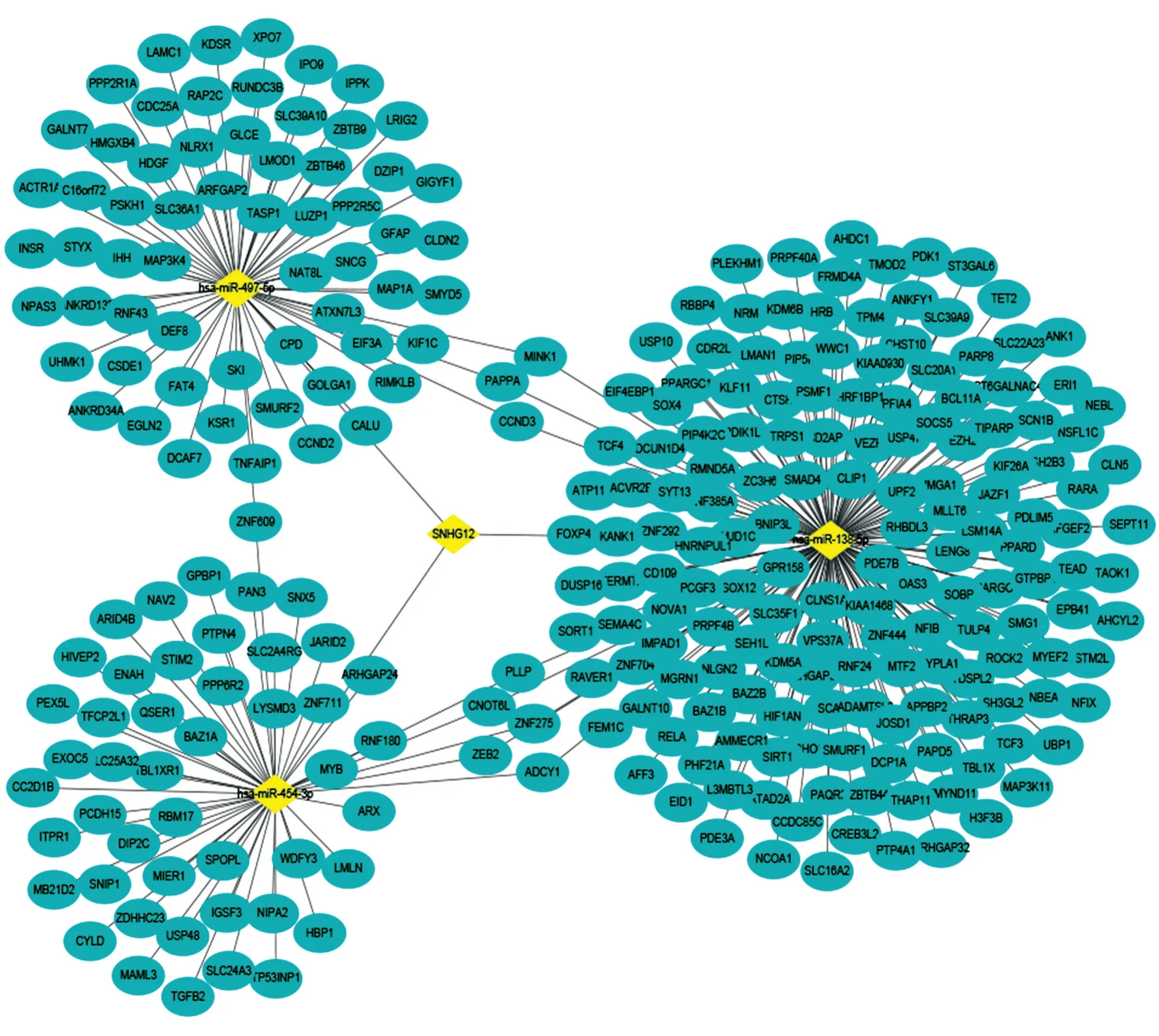
图4 SNHG12-microRNAs-mRNAs 网络调控图
3 讨论
后基因组时代,lncRNA 已经成为阐明癌症复杂机制的研究重点[12]。lncRNA 参与一系列生物学功能[13],迄今已有数千种lncRNA 被证实通过与其他分子的相互作用来驱动许多重要的癌症表型[12,14-15]。带有microRNA 结合位点的RNA 转录物可以作为竞争性内源RNA(competing endogenous RNAs,ceRNAs),特异性竞争microRNA 相互作用并调节彼此的表达水平[16]。ceRNA 调节模式在各种癌症中被证实[17],表明肿瘤发生过程中lncRNA和microRNA 之间存在相互作用。癌与对应癌旁组织中具有差异表达的lncRNA、microRNA 和mRNA 可为ccRCC 中潜在生物标志物提供更多的信息。SNHG12是小核仁RNA 宿主基因的成员,位于染色体1p35.3,在子宫内膜癌中被首次报道在癌组织中上调[18]。SNHG12还可通过与HuR 结合,促进神经胶质瘤细胞的增殖和迁移[19];作为miR-424-5p的内源性分子海绵促进宫颈癌细胞的增殖、迁移和侵袭[20];通过结合miR-195-5p上调Notch2促进骨肉瘤的肿瘤发生和转移[21];c-MYC 诱导SNHG12上调促进细胞增殖并抑制三阴性乳腺癌细胞凋亡,并通过调节乳腺癌中MMP13的表达促进细胞迁移[22];在肝细胞癌中,SNHG12通过与miR-199a/b-5p作用调节MLK3的表达并影响NF-κB 途径来促进肿瘤发生和转移[23]。然而,SNHG12在ccRCC 中的表达和功能尚不清楚。
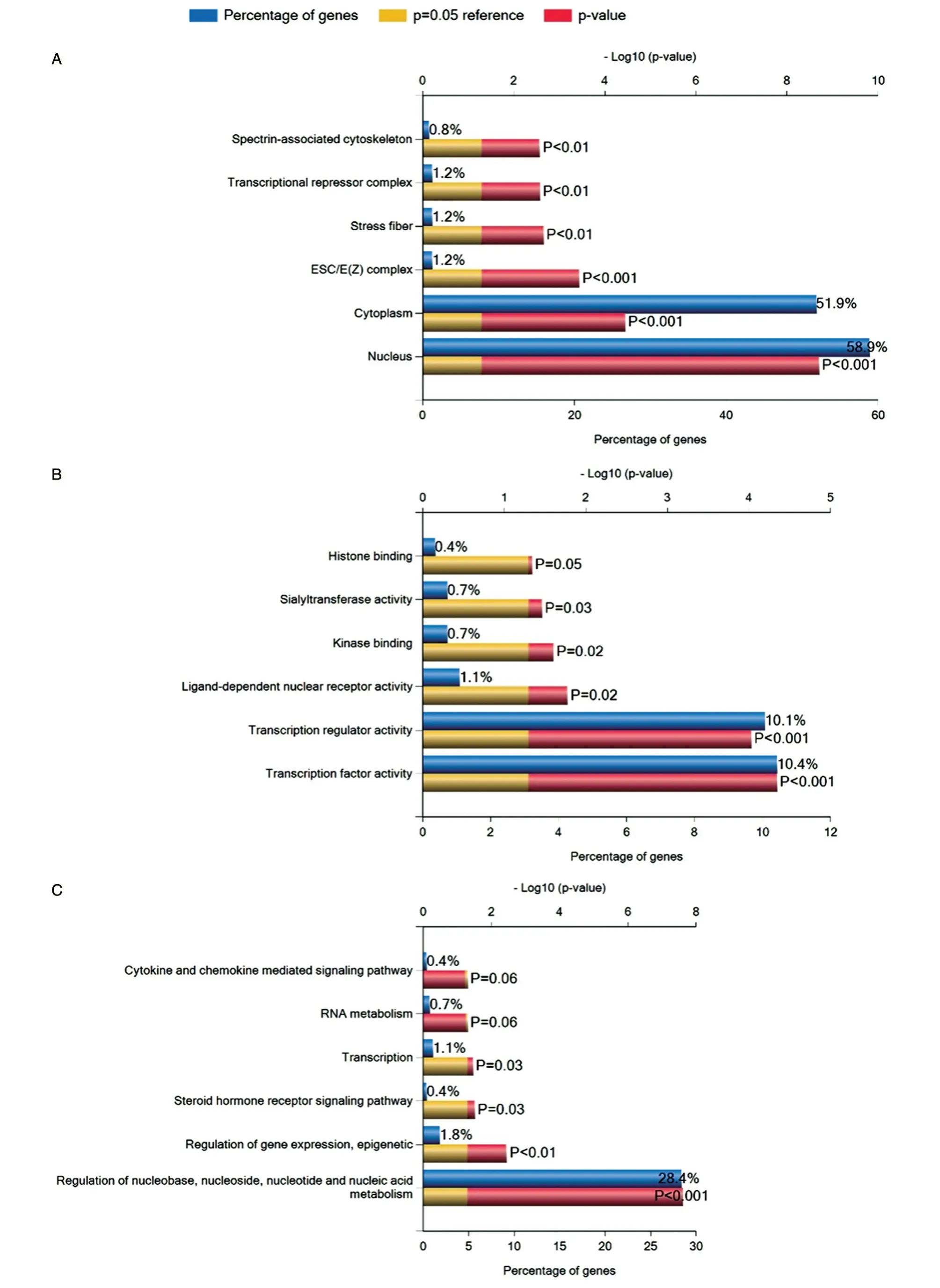
图5 microRNA 靶基因的GO 聚类分析
本研究以SNHG12为目标基因,利用UALCAN数据库分析SNHG12在ccRCC 中的差异表达,并对SNHG12进行生存分析。结果表明,ccRCC 组织中SNHG12的表达明显高于癌旁正常组织,各肿瘤分级均比正常对照表达增高,但SNHG12的表达与肿瘤分级无关,男性患者表达量高于女性患者,表达量具有性别差异,为SNHG12成为ccRCC的生物标志物奠定了基础。此外,SNHG12高表达ccRCC 患者的总生存期明显短于低表达患者,表明SNHG12具有作为评估ccRCC 预后的潜力。
通过功能分析和生物信息学预测探讨了SN⁃HG12的调节信息轴。用RegRNA2.0 生物学软件、HMDD v3.0 及starBase v3.0 数 据库,发现SNHG12上 存在hsa-miR-138-5p、hsa-miR-454-3p、hsamiR-497-5p这3 种 与ccRCC 相 关microRNAs 的 可能结合位点,从而调节下游的288 个靶基因,构成SNHG12-microRNAs-mRNAs 调控网络,它们相互作用并调节彼此的表达水平,为研究SNHG12在ccRCC 中的作用机制提供了基础。microRNA 靶基因在碱基、核苷、核苷酸和核酸代谢调节过程中高度富集,表明其在生物学过程中发挥作用。KEGG pathway 分析中,microRNA 参与内皮素、IFN-γ等介导的信号通路,这些信号通路均与肿瘤 相 关[24]。von Brandenstein 等[25]报 道,内 皮 素-1可诱导产生NF-κBp65/MAPKp38α/PKCα 转 录复合物,PKCα 通过 与pri-miRNA 茎环 结合而阻 止microRNA 成熟,从而对肾细胞癌、乳腺癌和黑色素瘤等多种肿瘤进行调节。此外,内皮素-1 信号通路可通过EDNRA和EDNRB起作用,并在多发性骨髓瘤中过表达[26]。
本研究阐明了SNHG12具有作为ccRCC 生物标志物的潜力,利用生物信息学方法进行靶基因预测,构建了SNHG12-microRNAs-mRNAs 相互作用网络,为后续SNHG12在ccRCC 中的机制研究提供了借鉴。但值得注意的是,本研究仍存在一定的局限性。SNHG12的生物学作用尚未通过体内实验确定,通过生物分析软件及在线预测软件对lncRNA 靶标预测可能存在假阳性,该分析结果还需要进一步分析或实验验证。

