血清结肠癌转移相关基因-1在胃癌患者化疗疗效预测中的效果
陈 莉
(江苏省苏北人民医院 肿瘤科, 江苏 扬州, 225001)
胃癌是世界上常见的恶性肿瘤之一,发病率和死亡率均位于所有恶性肿瘤的前5位[1]。根据2015年中国癌症统计数据报告[2], 每千人新增癌症患者中就有679人被诊断为胃癌,每千人癌症死亡患者中有498例死于胃癌。晚期胃癌预后差, 5年生存率不足10%。目前外科手术切除是胃癌主要的根治手段,而对Ⅳ期及非根治术、术后复发或转移的晚期患者而言,化疗是主要的治疗方法。目前临床上仍存在部分患者不能从化疗中受益,无法早期判断化疗疗效。MACC1是由Stein等[3]对结肠黏膜、结肠癌原发灶、转移灶通过差异分析基因表达时发现的,其与肿瘤的远处转移相关,并且高表达可以诱导肿瘤细胞体外增殖、侵袭及转移。除了发挥促进肿瘤增殖、侵袭和转移作用外, MACC1还与肿瘤的糖代谢有关。Lin L等[4]研究发现, MACC1可增强胃癌细胞的葡萄糖无氧酵解过程(warburg效应),并且在各种应激因子(代谢应激、化疗、放疗等)作用下,反应性增高,增高后的MACC1可通过促进warburg效应抗凋亡促增殖。因此,血清MACC1有可能作为胃癌临床化疗疗效早期预测的有效指标[5]。本研究探讨MACC1 在胃癌患者对5-Fu为基础的化疗耐药中的作用及其与化疗疗效的关系,现报告如下。
1 资料与方法
1.1 材料与试剂
人胃癌细胞系BGC-823、MACC1 ELISA试剂盒、RMPI-1640 培养基、胰酶、嘌呤霉素等购于武汉库克金生物科技有限公司,胎牛血清购于武汉柏能达科生物科技有限公司,采购SYBR, 含MACC1过表达和干扰的重组慢病毒颗粒, MACC1和GAPDH上下游引物。
1.2 临床资料
选取2016年1月—2017年4月本院诊治的40例晚期胃癌初治患者治疗前血清样本。所有患者均经病理学诊断为胃腺癌。入院常规检查包括血常规、肝肾功能、腹部CT等。其中男28例,女12例,平均年龄(53.0±6.58)岁。化疗方案为以5-氟尿嘧啶(5-Fu)为基础的联合化疗,化疗周期为4~6周。
1.3 细胞培养与稳转细胞株的构建
人胃癌细胞株BCG-823常规培养于含有10%胎牛血清的RMPI-1640培养基中,置于 37 ℃、5% CO2的恒温培养箱中培养。当细胞融合至90%, 即对数生长期时胰酶消化,取2 mL接种于六孔板中,细胞密度为2×105个/孔,置于培养箱中继续培养,待细胞融合度达50% 时,用含过表达(pLV-Puro-MACC1)和干扰(pLVshRNA-Puro-MACC1) MACC1的慢病毒颗粒分别感染BCG-823细胞,感染48 h后用含嘌呤的培养基进行筛选,浓度为0.5 μg/mL, 每2天更换一次培养基,设置正常BCG-823细胞为对照组,第5天撤去药物,得到过表达MACC1细胞株pLV-MACC1/BCG-823和干扰MACC1细胞株pLVsh-MACC1/BCG-823, 扩增细胞用于实验。
1.4 RT-PCR检测细胞中MACC1的mRNA表达 水平
Trizol法提取对照组(BCG-823), 过表达组(pLV-MACC1/BCG-823)和干扰组(pLVsh-MACC1/BCG-823)的胃癌细胞总RNA, 逆转录成cDNA, 以得到的cDNA为模板进行荧光定量PCR实验,以GAPDH为内参。MACC1上游引物序列为5'-ATCCGCCACACATGCTTAA-3', 下游引物序列为5'-CTTCAGCCCCAATTTTCATC-3', GAPDH上游引物序列为5'-A CCACAGTCCATGCCATCAC-3', 下游引物序列为5'-TCCACCACCCTGTTGCTGTA-3'。反应体系如下: SYBR Premix Ex Taq(2x)10 μL, 基因上游引物(10μmol/L) 0.5 μL, 下游引物(10μmol/L) 0.5 μL, 模板1 μL, ddH2O补足至20 μL; 反应条件为: 95 ℃变性30 s, 95 ℃ 5 min, 55 ℃ 20 s, 72 ℃ 20 s, 重复40个循环。每组样本设置3个复孔,将同一样本中目的基因的Ct值减去GAPDH的Ct值,得到目的基因的△Ct值。2(-△Ct)即为目的基因的标准化表达量。
1.5 通过ELISA法测定细胞培养液、胃癌病人 血清中MACC1蛋白表达水平
待对照组(BCG-823), 过表达组(pLV-MACC1/BCG-823)和干扰组(pLVsh-MACC1/BCG-823)的细胞生长至80%~90%时,小心收集各组细胞上清液,低温离心后-80 ℃保存; 用血清分离管抽取胃癌患者外周血5 mL, 室内凝结30 min后, 1 000×g低温离心15 min, 取上清-80 ℃保存。按照 ELISA试剂盒说明书检测MACC1蛋白表达水平,具体为: 将不同稀释浓度的标准品,样品和空白对照各100 μL加到包被MACC1抗体的96空板上37 ℃孵育2 h, 吸净每孔,然后用洗涤缓冲液洗涤3次。然后每孔加100 μL抗体检测液, 37 ℃孵化2 h。吸干每个孔,洗涤缓冲液洗涤3次,每孔加入100 μL的检测试剂A, 37 ℃孵育2 h, 再次洗涤后,每孔加入100 μL的底物稀释液, 37℃避光孵育15 min后每孔加入100 μL终止液终止反应。轻轻拍打混匀后, 30 min内上机检测,在450 nm处读取每个孔OD值,同时设调零孔。所有实验设置6个复孔。
1.6 MTT 法检测细胞对5-Fu的敏感性
收集处于对数生长期的对照组(BCG-823), 过表达组(pLV-MACC1/BCG-823)和干扰组(pLVsh-MACC1/BCG-823)细胞铺96孔板,每孔加入100 μL, 细胞密度为9 000个/孔,过夜培养后弃去上清,加入不同浓度的5-Fu, 设7个浓度梯度,分别为0、3.125、6.25、12.5、25、50、100、200 μg/mL, 每组设6个复孔,继续培养48 h后,每孔加入10 μL MTT溶液(5 mg/mL)终止培养,继续孵育4 h。小心吸去孔内培养液,加入150 μL二甲基亚砜,置摇床上低速振荡10 min, 使结晶物充分溶解。在490 nm处检测各孔的吸光度OD值,同时设置调零孔(培养基、MTT、二甲基亚砜)。
1.7 化疗疗效评定
根据治疗前后胃癌患者影像学资料(增强CT)评价化疗疗效,采用实体瘤疗效评价标准RECIST 1.1[6]。完全缓解(CR): 所有靶病灶消失,全部病例淋巴结(包括靶结节和非靶结节)短径必须减少至<10 cm; 部分缓解(PR): 靶病灶直径之和比基线水平减少至少30%; 疾病进展(PD): 靶病灶直径之和相对增加至少20%; 疾病稳定(SD): 靶病灶减小或增加的程度介于PR和PD。疾病控制率(DCR)= CR+PR+SD。
1.8 统计学方法
结果采用 SPSS 17.0 统计软件进行处理,实验数据以均数±标准差表示,两组间数据均数比较采用t检验,多组间均数比较采用单因素方差分析( One-way ANOVA), 检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 生存分析
作者在KM plotter数据库[7-8]中分析发现, MACC1的表达量和预后呈明显负相关,在mRNA水平上, MACC1低表达的患者的总生存时间显著高于MACC1高表达患者(P<0.05), 见图1。同时分析了TCGA数据库中MACC1在不同期别病人中的表达量的差异[9], 结果发现,其在不同期别病人中的表达量存在差异,但差异无统计学意义,但与正常组织相比, MACC1的表达量存在显著差异(P<0.05), 见图2。
2.2 RT-PCR法检测细胞中MACC1的mRNA 表达水平
RT-PCR结果显示,与对照组(BCG-823)相比,过表达组(pLV-MACC1/BCG-823)细胞中mRNA水平显著上调,干扰组(pLVsh-MACC1/BCG-823)细胞的MACC1 mRNA表达水平下调,差异有统计学意义(P<0.05)。见图3。

图1 基于KMplotter数据库的胃癌患者生存曲线
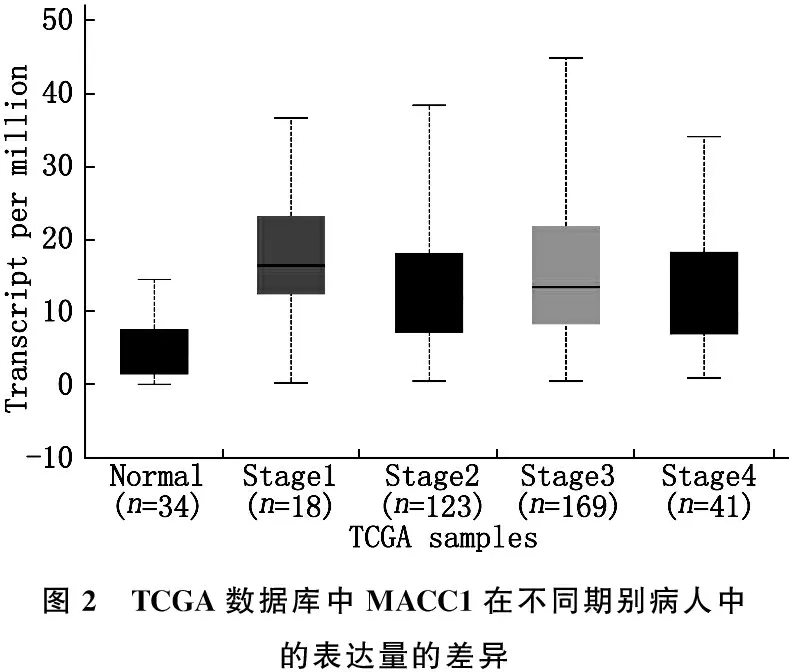
图2 TCGA数据库中MACC1在不同期别病人中的表达量的差异

图3 RT-PCR法检测细胞中MACC1的mRNA表达水平
2.3 ELISA法检测细胞株培养液中MACC1蛋白 表达水平
ELISA检测对照组(BCG-823)、过表达组(pLV-MACC1/BCG-823)和干扰组(pLVsh-MACC1/BCG-823)细胞培养液中MACC1水平,过表达组(pLV-MACC1/BCG-823)细胞培养液中MACC1蛋白水平较其他两组明显升高,而干扰组(pLVsh-MACC1/BCG-823)细胞培养液中的MCCC1蛋白水平明显降低,低于对照组和过表达组,且差异具有统计学意义(P<0.05), 与细胞中MACC1 mRNA水平呈正相关。见图4。
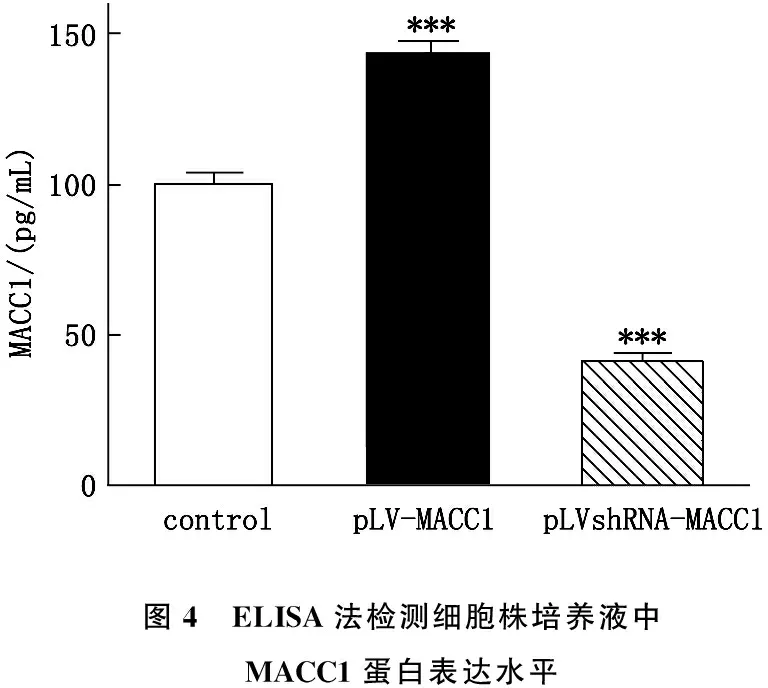
图4 ELISA法检测细胞株培养液中MACC1蛋白表达水平
2.4 稳定转染后各组细胞对顺铂敏感性影响
加入不同浓度的5-Fu药物作用48 h后发现,对照组(BCG-823), 过表达组(pLV-MACC1/BCG-823)和干扰组(pLVsh-MACC1/BCG-823)的细胞存活分数随着药物浓度的增加而减少,且三组细胞对5-Fu的敏感性存在差异。过表达组(pLV-MACC1/BCG-823)细胞对5-Fu的敏感性最差,当干扰MACC1后, BCG-823细胞对5-Fu的敏感性增加,细胞存活率降低。5-Fu药物浓度越大,其抑制干扰组(pLVsh-MACC1/BCG-823)细胞增殖作用越明显,高于对照组(BCG-823)和过表达组(pLV-MACC1/BCG-823), 差异有统计学意义(P<0.05)。见图5。

图5 不同5-Fu浓度下细胞存活分数的差异
2.5 疗效评价
根据增强CT进行临床化疗疗效评价,结果显示,临床上晚期胃癌患者对以5-Fu为基础的化疗疗效存在差异。疗效评价为PR和PD的2例患者CT结果显示患者行胃癌根治术后发生肝转移,予以化疗。化疗前,患者门静脉主干栓子形成和肝脏转移,化疗后可见门静脉海绵样变性,肝脏转移灶变小,化疗疗效好。而诊断为初治胃癌肺转移患者化疗后肺转移病灶无明显变化,胃原发病灶进展,化疗疗效差。
2.6 ELISA法检测患者血清中MACC1蛋白表达 水平
ELISA法检测不同胃癌患者治疗前血清中MACC1蛋白含量,作者发现不同患者的血清样本中的MACC1水平存在差异。结合化疗后影像学检查结果发现,化疗前血清MACC1含量低的患者对以5-Fu为基础的化疗效果较好,而MACC1含量高的患者的化疗疗效较差,见表1。

表1 晚期胃癌患者化疗前血清 MACC1
与疾病进展组相比, *P<0.01。
3 讨 论
目前,胃癌是全世界常见的致死性肿瘤之一,每年约有70万人死于胃癌,尤其在亚洲东部国家[10]。在中国,每年就有超过40万人被诊断为胃癌,死亡人数超过新发病例的一半。胃镜在临床上的普遍使用使得胃癌的早期诊断率有了很大的提高,但是大部分患者在诊断时已是晚期,中位生存期不超过一年[11-12], 且胃镜属于侵入性检查,其作为常规检查手段不为大部分患者所接受,因此在西方国家,仍有80%诊断为胃癌的患者临床分期为Ⅳ期[13]。目前胃癌的主要治疗手段为手术治疗,辅以化疗或放疗,但治疗后仍有很高的肿瘤复发率和远处转移率。临床症状复发,诊断较晚期,缺乏个体化精准治疗的评估策略使得胃癌的死亡率居高不下[14]。遗传病因学,组织学等分子特征的差异导致胃癌患者对化疗敏感性存在较大差异[15], 晚期患者化疗或靶向治疗后的五年生存率不超过5%。因此,寻找能够预测化疗疗效的高效应、低损伤的生物标记物就显得尤为迫切。
结肠癌转移相关基因-1(MACC1)功能的发挥主要依赖于SH3结构域和SH3结合位点,这两种结构对下游c-Met的激活十分关键[16], 此外, MACC-1羧基端两个死亡结构域调控炎症、凋亡以及侵袭等生物学过程[17]。最初MACC1的研究局限于其对结肠癌侵袭迁移的作用,近年来MACC1也被发现在肝癌、胰腺癌、肺癌、食管癌、前列腺癌、脑胶质瘤以及卵巢癌等肿瘤组织中高表达,与患者不良预后相关[18-25], 可以预测患者的预后。Wang L等[26]报道MACC1在胃癌的表达水平高于正常组织,并发挥促进肿瘤细胞的生长和转移,控细胞周期的作用。目前有关MACC1对肿瘤发生发展的研究很广泛,但主要集中在组织及细胞水平,急需寻找一种即时、便捷、无创的方式检测MACC1的表达进而早期预测胃癌患者化疗疗效及预后。
本研究构建MACC1过表达、低表达稳转细胞系pLV-MACC1/BCG-823和pLVsh-MACC1/BCG-823, 检测细胞中MACC1 mRNA水平确认稳转细胞系构建成功并比较不同细胞内MACC1 mRNA的差异。检测细胞上清中MACC1蛋白含量并与mRNA水平对比,并比较不同细胞分泌的MACC1含量的差异。过表达组(pLV-MACC1/BCG-823)细胞分泌的MACC1蛋白水平明显高于干扰组(pLVsh-MACC1/BCG-823)和对照组(BCG-823), 并且和细胞内MACC1 mRNA表达趋势一致,证明胃癌细胞分泌的MACC1蛋白水平与细胞中MACC1水平呈正相关,这为通过检测血清MACC1水平了解胃癌恶性生物学行为奠定了细胞学基础。通过MTT实验作者发现,三种细胞株对5-Fu敏感性存在差异。当干扰MACC1后, BCG-823细胞对5-Fu敏感性增加,细胞存活率降低,上调MACC1后, BCG-823对5-Fu的敏感性降低。通过检测40例晚期胃癌患者治疗前血清中MACC1水平发现,化疗前不同患者血清中的MACC1含量存在差异。通过影像学资料对比分析发现,化疗前MACC1含量低的患者化疗疗效优于MACC1含量高的患者,这提示MACC1可以先于CT预测胃癌患者对以5-Fu为基础的化疗疗效。因此,血清MACC1有可能作为胃癌临床化疗疗效早期预测的有效指标。
Stein等[27]通过检测结直肠癌患者血液中循环MACC1的mRNA水平来预测高危结肠癌病人。Wang G等[25]通过检测胰腺癌病人血清中的MACC1含量发现其具有促进肿瘤细胞耐药作用,但有关胃癌血清中MACC1的表达水平与化疗耐药、病人预后的关系未见报道。本文通过过表达、干扰MACC1测定胃癌细胞株对5-Fu耐药的影响,通过检测血清中MACC1含量,阐明血清MACC1水平是胃癌化疗疗效评价的即时、便捷、无创的生物标志物,将为寻求新的胃癌化疗疗效预测指标提供新的实验依据。
[1] Chen W, Zheng R, Zhang S, et al. Cancer incidence and mortality in China in 2013: an analysis based on urbanization level[J]. Chung-kuo yen cheng yen chiu, 2017, 29(1): 1-10.
[2] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[3] Stein U, Walther W, Arlt F, et al. MACC1, a newly identified key regulator of HGF-MET signaling, predicts colon cancer metastasis[J]. Nat Med, 2009, 15(1): 59-67.
[4] Lin L, Huang H, Liao W, et al. MACC1 supports human gastric cancer growth under metabolic stress by enhancing the Warburg effect[J]. Oncogene, 2015, 34(21): 2700-2710.
[5] Koppenol W H, Bounds P L, Dang C V. Otto Warburg′s contributions to current concepts of cancer metabolism[J]. Nature Reviews Cancer, 2011, 11(5): 325-337.
[6] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1. 1)[J]. Eur J Cancer, 2009, 45(2): 228-247.
[7] Lánczky A, Nagy, Bottai G, et al. miRpower: a web-tool to validate survival-associated miRNAs utilizing expression data from 2178 breast cancer patients[J]. Breast Cancer Res Treat, 2016, 160(3): 439-446.
[8] Szász A M, Lánczky A, Nagy, et al. Cross-validation of survival associated biomarkers in gastric cancer using transcriptomic data of 1, 065 patients[J]. Oncotarget, 2016, 7(31): 49322-49333.
[9] Chandrashekar D S, Bashel B, Balasubramanya SAH, et al. UALCAN: A Portal for Facilitating Tumor Subgroup Gene Expression and Survival Analyses[J]. Neoplasia, 2017, 19(8): 649-658.
[10]Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386.
[11]Chang Y R, Han D S, Kong S H, et al. The value of palliative gastrectomy in gastric cancer with distant metastasis[J]. Ann Surg Oncol, 2012, 19(4): 1231-1239.
[12]遆军锋. 扩大根治手术治疗进展期胃癌60例临床分析[J]. 吉林医学, 2014, 35(23): 5210-5211.
[13]Malvezzi M, Bertuccio P, Levi F, et al. European cancer mortality predictions for the year 2014[J]. Annals of Oncology, 2014, 25(8): 1650-1656.[
[14]Leung W K, Wu M S, Kakugawa Y, et al. Screening for gastric cancer in Asia: current evidence and practice[J]. Lancet Oncol, 2008, 9(3): 279-287.
[15]Vogelaar I P, van der Post R S, Bisseling T M, et al. Familial gastric cancer: detection of a hereditary cause helps to understand its etiology[J]. Hereditary Cancer in Clinical Practice, 2012(1): 18-25.
[16]Stein U, Dahlmann M, Walther W. MACC1 - more than metastasis Facts and predictions about a novel gene[J]. J Mol Med, 2010, 88(1): 11-18.
[17]Lv Q, Wang W, Xue J, et al. DEDD interacts with PI3KC3 to activate autophagy and attenuate epithelial-mesenchymal transition in human breast cancer[J]. Cancer Res, 2012, 72(13): 3238-3250.
[18]何彬, 吴长利, 胡海龙, 等. MACC1及c-Met在前列腺癌组织中的表达[J]. 天津医药, 2015, 43(2): 175-178, 228.
[19]贺亚龙. 人脑胶质细胞瘤中MACC1基因的表达及其RNAi对生物学特性的影响[D]. 第四军医大学, 2012.
[20]梁荣, 聂少麟, 谢小雪, 等. MACC1蛋白在鼻咽癌组织中的表达及与预后的关系[J]. 实用医学杂志, 2016, 32(20): 3394-3397.
[21]王建军, 洪强, 胡丛岗, 等. 结肠癌转移相关基因1蛋白在食管癌组织中的表达及其意义[J]. 中华医学杂志, 2013, 93(32): 2584-2586.
[22]周娜, 吴宜林. MACC1、c-Met蛋白在宫颈癌中的表达及与盆腔淋巴结转移的关系研究[J]. 实用妇产科杂志, 2014, 30(3): 199-203.
[23]Chundong G, Uramoto H, Onitsuka T, et al. Molecular diagnosis of MACC1 status in lung adenocarcinoma by immunohistochemical analysis[J]. Anticancer Res, 2011, 31(4): 1141-1145.
[24]Qiu J, Huang P, Liu Q, et al. Identification of MACC1 as a novel prognostic marker in hepatocellular carcinoma[J]. Journal of Translational Medicine, 2011, 9(1): 166-173.
[25]Wang G, Kang M X, Lu W J, et al. MACC1: A potential molecule associated with pancreatic cancer metastasis and chemoresistance[J]. Oncol Lett, 2012, 4(4): 783-791.
[26]Wang L, Wu Y, Lin L, et al. Metastasis-associated in colon cancer-1 upregulation predicts a poor prognosis of gastric cancer, and promotes tumor cell proliferation and invasion[J]. Int J Cancer, 2013, 133(6): 1419-1430.
[27]Stein U, Burock S, Herrmann P, et al. Circulating MACC1 transcripts in colorectal cancer patient plasma predict metastasis and prognosis[J]. PLoS ONE, 2012, 7(11): e49249-e40257.

