清肺膏的质量标准研究
韩 毅,于 艳,吴振起,王清华
(辽宁中医药大学附属医院中医药实验中心,沈阳 110032;*通讯作者,E-mail:zhenqiwu@163.com)
清肺膏是由辽宁中医药大学附属医院吴振起主任医师新研制的外用制剂,处方以《温病条辨》中宣白承气汤为基础加黄柏构成,该方由大黄、石膏、苦杏仁、瓜蒌皮、黄柏五味中药组成,该制剂具有清热解毒宣肺、通腑泄热通络的作用,外敷背腧穴区治疗儿童肺炎取得了较好的疗效。为了有效控制清肺膏的质量,以保证良好的治疗效果,本试验采用薄层色谱法对清肺膏中的大黄[1,2]、瓜蒌皮、黄柏[3]进行薄层色谱鉴别研究,采用高效液相色谱法对方中苦杏仁苷[4-6]含量进行定量检测,为清肺膏的进一步开发利用奠定基础。
1 仪器与试药
1.1 实验仪器
Agilent 1100系列高效液相色谱仪;E-240电子分析天平(上海梅特勒-托力多仪器有限公司);KQ5200DE型数控超声波清洗机(昆山市超声仪器有限公司);DZ-2BC型干燥箱(天津泰斯特仪器有限公司)。
1.2 试药及试剂
苦杏仁苷对照品(含量测定用,批号:110720-200404)、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品(鉴别用,批号:110796-201113,110795-200605,110757-200206,110783-201113,110796-200615)、盐酸黄柏碱对照品(鉴别用,批号:111895-201202)大黄对照药材(批号:120902-200609)、黄柏对照药材(批号:121510-201105),均购自中国食品药品检定研究院;瓜蒌皮对照药材(批号:121185-201503),购自上海士峰生物科技有限公司;甲醇、乙腈(色谱纯,Fisher公司),水为纯净水,其余试剂均为分析纯;清肺膏(批号:20160401,20160402,20160403,20170301,20170302,20170303),由辽宁中医药大学附属医院实验中心提供。
2 方法与结果
2.1 大黄的薄层色谱鉴别
2.1.1供试品溶液的制备取清肺膏8 g,加甲醇25 ml搅拌均匀,超声处理30 min,滤过,滤液蒸干,残渣加水30 ml使溶解,再加盐酸2 ml,置电热套中加热回流30 min,冷却,用乙醚振摇提取3次,每次15 ml,合并乙醚提取液,蒸干,残渣加甲醇l ml使溶解,作为供试品溶液。
2.1.2对照药材溶液的制备取大黄对照药材0.2 g,按“2.1.1”项下方法制成对照药材溶液。
2.1.3对照品溶液的制备分别取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品,加甲醇制成每l ml各含l mg的混合溶液,作为对照品溶液。
2.1.4阴性对照溶液的制备取除大黄外的阴性样品,按供试品制备方法制成阴性对照溶液。
2.1.5薄层色谱鉴别照2015版《中国药典》四部(通则0502)及有关文献试验,吸取供试品、对照药材、阴性对照溶液各10 μl,对照品溶液5 μl,分别点于同一硅胶H薄层板上,以正己烷-甲酸乙酯-甲酸(30 ∶10 ∶0.5)为展开剂,展开,取出,晾干,置氨蒸气中熏后,在日光下检视。
2.1.6鉴别结果清肺膏供试品色谱中,在与大黄对照药材色谱相应的位置上,显相同的5个红色主斑点;在与对照品溶液色谱相应的位置上,显相同的红色斑点(见图1)。
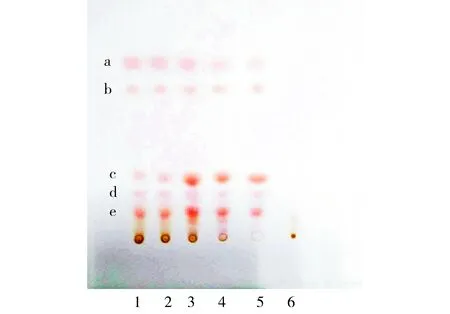
1.清肺膏(批号:20170301);2.清肺膏(批号:20170302);3.清肺膏(批号:20170303);4.大黄对照药材溶液;5.混合对照品溶液;6.缺大黄的阴性对照溶液;a.大黄酚;b.大黄素甲醚;c.大黄素;d.大黄酸;e.芦荟大黄素图1 大黄薄层色谱鉴别Figure 1 Thin layer chromatogram of Rhei Radix Et Rhizoma
2.2 黄柏的薄层色谱鉴别
2.2.1供试品溶液的制备取清肺膏10 g,置锥形瓶中,加1%醋酸甲醇溶液30 ml,在60 ℃条件下,超声处理30 min,滤过,滤液浓缩至1 ml,作为供试品溶液。
2.2.2对照药材溶液的制备取0.1 g黄柏对照药材,加1%醋酸甲醇溶液20 ml,同法制成对照药材溶液。
2.2.3对照品溶液的制备取盐酸黄柏碱对照品,加甲醇制成每1 ml含0.5 mg的溶液,作为对照品溶液。
2.2.4阴性对照溶液的制备取不含黄柏的药材,按处方取其他药材制备阴性样品,按供试品制备方法制成阴性对照溶液。
2.2.5薄层色谱鉴别照2015版《中国药典》四部(通则0502)试验,分别吸取供试品、对照药材、阴性对照溶液各10 μl,盐酸黄柏碱对照品溶液5 μl,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-水(30 ∶15 ∶4)的下层溶液为展开剂,置氨蒸气饱和的展开缸内,展开,取出,晾干,喷以稀碘化铋钾试液。
2.2.6鉴别结果清肺膏供试品色谱中,在与黄柏对照药材色谱和盐酸黄柏碱对照品色谱相应的位置上,显相同颜色的橙黄色斑点,阴性液位置无斑点干扰(见图2)。
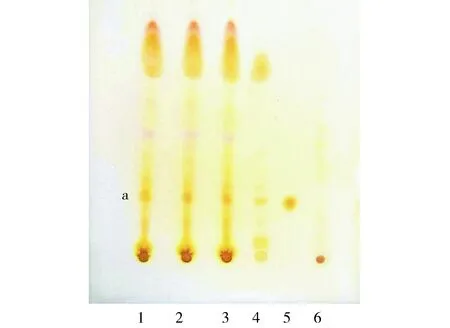
1.清肺膏(批号:20170301);2.清肺膏(批号:20170302);3.清肺膏(批号:20170303);4.黄柏对照药材溶液;5.盐酸黄柏碱对照品溶液;6.缺黄柏的阴性对照溶液;a.盐酸黄柏碱图2 黄柏薄层色谱鉴别Figure 2 Thin layer chromatogram of Cortex Phellodendri
2.3 瓜蒌皮的薄层色谱鉴别
2.3.1供试品溶液的制备取清肺膏15 g,加乙醇30 ml,超声处理15 min,滤过,滤液蒸干,残渣加甲醇2 ml使溶解,作为供试品溶液。
2.3.2对照药材溶液的制备取瓜蒌皮对照药材2 g,加乙醇20 ml,同上法制成对照药材溶液。
2.3.3阴性对照溶液的制备取不含瓜蒌皮的药材,按处方取其他药材制备阴性样品,按供试品制备方法制成阴性对照溶液。
2.3.4薄层色谱鉴别照2015版《中国药典》四部(通则0502)试验,吸取供试品、阴性对照液溶液各10 μl,瓜蒌皮对照药材溶液5 μl,分别点于同一硅胶G薄层板上,以石油醚(60-90 ℃)-乙酸乙酯(4 ∶1)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,加热至斑点显色清晰。
2.3.5鉴别结果清肺膏供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,阴性液位置无干扰出现(见图3)。
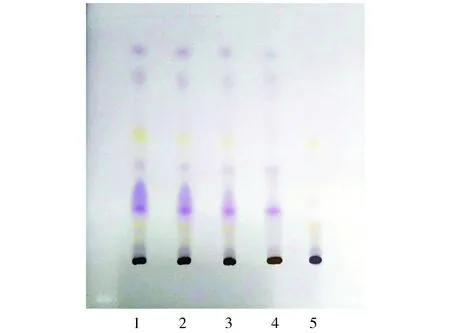
1.清肺膏(批号:20170301);2.清肺膏(批号:20170302);3.清肺膏(批号:20170303);4.瓜蒌皮对照药材溶液;5.缺瓜蒌皮的阴性对照溶液图3 瓜蒌皮薄层色谱图Figure 3 Thin layer chromatogram of Pericarpium Trichosanthis
2.4 苦杏仁苷含量测定[7]
2.4.1色谱条件及系统适用性试验色谱柱:采用Agilent TC-C18(250 mm×4.6 mm,5 μm),苦杏仁苷色谱峰可基线分离;紫外全程扫描,确定苦杏仁苷在210 nm处有最大吸收,故选择210 nm为检测波长;以乙腈-0.05%磷酸水溶液(20 ∶80)为流动相,色谱图显示苦杏仁苷色谱峰保留时间适宜,与其他色谱峰分离度大于1.5,理论塔板数按苦杏仁苷峰计不得低于7 000。
2.4.2对照品溶液的制备精密称取苦杏仁苷对照品13.06 mg,置10 ml棕色容量瓶中,加甲醇溶解并稀释至刻度,摇匀,得质量浓度为每1 ml含1.306 mg的对照品储备液。精密吸取对照品储备液1.5 ml,置10 ml棕色容量瓶中,加甲醇制成每1 ml含0.196 mg的溶液,摇匀,即得。
2.4.3供试品溶液的制备取本品约0.25 g,精密称定,置具塞锥形瓶中,精密加入甲醇20 ml,密塞,称定质量,超声处理(功率250 W,频率40 kHz)30 min,取出,放冷,再称定质量,加甲醇补足减失质量,摇匀,滤过,取续滤液,作为供试品溶液。
2.4.4阴性液干扰试验取方中除苦杏仁外的各药材,按供试品项下方法制备成缺苦杏仁阴性液。精密吸取对照品溶液、供试品溶液及阴性液各5 μl,注入液相色谱仪,绘制液相色谱图,结果在与对照品色谱峰相应的位置上供试品溶液具有相同保留时间的色谱峰,阴性液在此峰位无吸收(见图4)。
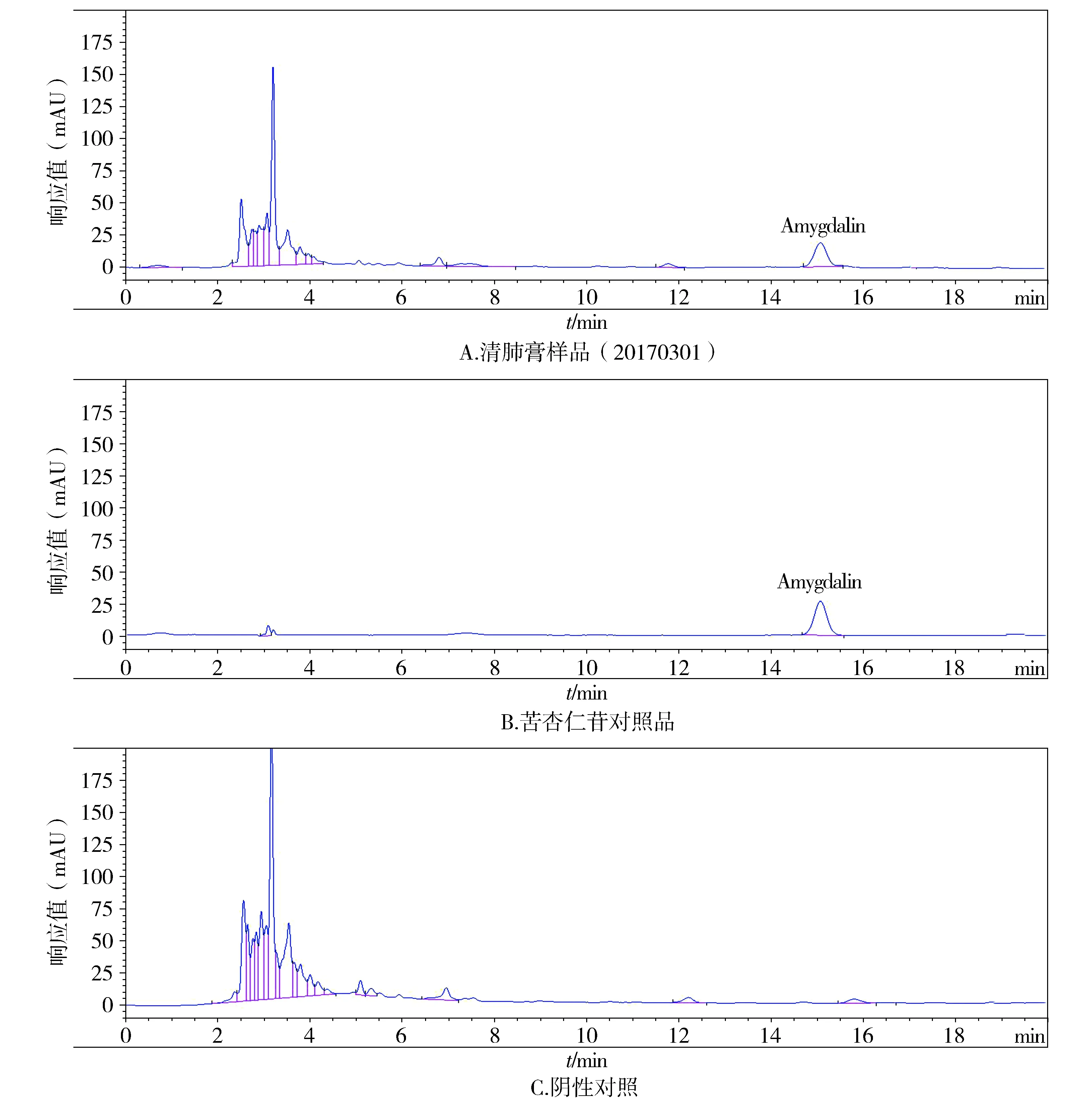
图4 清肺膏中苦杏仁苷HPLC图Figure 4 High performance liquid chromatogram of amygdalin in Qingfei paste
2.4.5含量测定方法分别精密吸取对照品溶液与供试品溶液各5 μl,注入高效液相色谱仪,测定,即得。
2.4.6线性范围考察分别精密量取对照品储备液0.1,0.5,1.0,1.5,2.0,3.0 ml,置于10 ml量瓶中,加甲醇稀释至刻度,摇匀,制成质量浓度分别为1 ml含13.06,65.30,130.60,195.90,261.20,391.80 μg的系列对照品溶液。精密吸取上述对照品溶液各5 μl,按“2.4.1”项下色谱条件进样测定峰面积,以质量浓度(x,μg/ml)为横坐标,峰面积(y)为纵坐标,得苦杏仁苷的回归方程为y=639.45x-2.764,r=0.999 9,结果表明,苦杏仁苷在13.06-391.80 μg/ml范围内线性关系良好。
2.4.7检测限与定量限考察取“2.4.2”项下苦杏仁苷对照品溶液,逐步稀释后进样,记录峰面积。当信噪比分别为3 ∶1和10 ∶1时,测得检测限和定量限。试验结果,苦杏仁苷的检测限和定量分别为0.13,2.61 μg/ml。
精密度试验:精密吸取对照品溶液5 μl,连续进样6次,结果峰面积值的RSD为0.61%,表明仪器精密度较高。
2.4.8重复性实验取供试品6份,按“2.4.3”项下方法平行制备供试品溶液,按“2.4.1”色谱条件进样测定,结果苦杏仁苷平均含量为1.53 mg/g,峰面积的RSD为1.63%,表明本方法重复性较好。
2.4.9稳定性试验精密吸取同一供试品溶液,分别于制备后0,2,4,6,8,10,12 h依“2.4.1”法进行测定,结果12 h内苦杏仁苷峰面积值的RSD为1.28%,表明供试品溶液在12 h内稳定性较好。
2.4.10加样回收率试验分别称取6份已知含量的供试品0.125 g,精密称定,精密加入苦杏仁苷对照品溶液1.0 ml(相当于苦杏仁苷0.196 mg),按“2.4.3”项下方法制备供试品溶液,按“2.4.1”项下色谱条件进行测定,试验结果见表1。
表1苦杏仁苷回收率试验结果(n=6)
Table1ResultsofrecoverytestofamygdalininQingfeipaste(n=6)
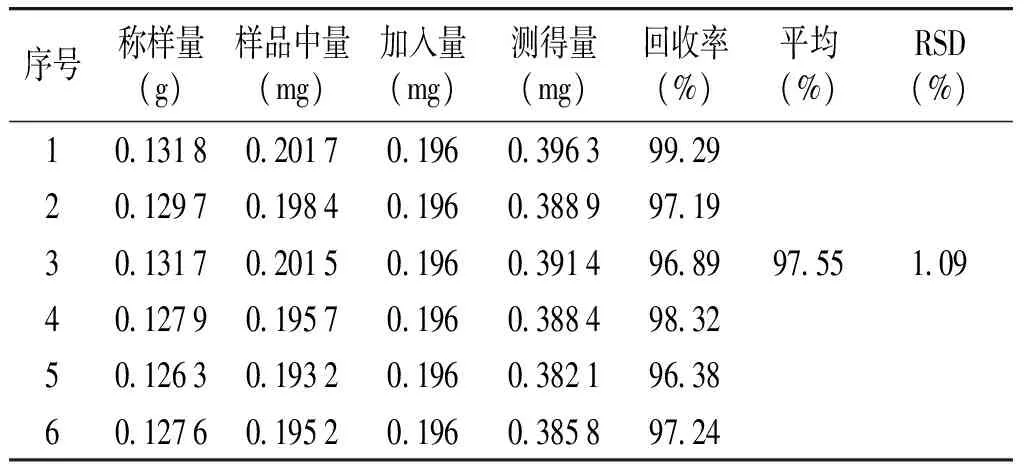
序号称样量(g)样品中量(mg)加入量(mg)测得量(mg)回收率(%)平均(%)RSD(%)1013180201701960396399292012970198401960388997193013170201501960391496899755109401279019570196038849832501263019320196038219638601276019520196038589724
2.4.11样品含量测定取6批样品(批号:20160401,20160402,20160403,20170301,20170302,20170303),按上述“2.4.2”和“2.4.3”项下方法分别制备对照品溶液和供试品溶液,依法进样测定,结果6批样品中苦杏仁苷的含量分别为1.56,1.50,1.49,1.48,1.51,1.53 mg/g,平均含量为1.51 mg/g。
3 讨论
本制剂中大黄、黄柏及瓜蒌皮的薄层鉴别方法参照2015版《中国药典》[8]一部及有关文献资料,在对大黄的薄层色谱研究中,采用药典鉴别方法,吸取供试品、对照药材、阴性对照溶液各10 μl,对照品溶液5 μl,分别点于同一硅胶H薄层板上,以石油醚(30-60 ℃)-甲酸乙酯-甲酸(15 ∶5 ∶1)的上层溶液为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视,结果在紫外光灯下观察及在氨蒸气中熏后,在日光下检视,斑点均不清晰。后改用正己烷-甲酸乙酯-甲酸(30 ∶10 ∶0.5)为展开剂,展开,取出,晾干,置氨蒸气中熏后,在日光下检视,薄层斑点更加清晰。
在测定苦杏仁苷的成分含量时,预试验曾采用甲醇-乙腈-0.1%磷酸溶液及甲醇-0.2%磷酸溶液以不同比例为流动相进行洗脱,结果两个组分无法达到基线分离,后改用乙腈-0.05%磷酸溶液(20 ∶80)洗脱后,得到较好的分离效果。
本实验所建立的薄层色谱法能快速、准确地鉴别出清肺膏中的大黄、黄柏及瓜蒌皮,其鉴别方法简便实用,薄层斑点清晰度高,分离度好。高效液相色谱法测定清肺膏方中苦杏仁苷的含量,结果测定方法准确,线性关系和重现性好。上述研究可作为清肺膏的质量控制方法。
参考文献:
[1]贺婕,张爱荣,姜建芬.复方黄葵颗粒的薄层鉴别研究[J].山西医科大学学报,2017,48(3):260-262.
[2]温馨,姜耀伦,陈素珍,等.大七厘散中大黄及当归薄层色谱鉴别方法改进[J].中国药业,2017,26(14):7-9.
[3]陈利娟,张家连.消糜栓质量标准研究[J].现代中药研究与实践,2017,31(1):48-55.
[4]王迎春,麻景梅,李斯,等.苦杏仁配方颗粒中苦杏仁苷的定量分析及特征图谱研究[J].中国中医药信息杂志,2016,23(5)::87-90.
[5]毕丹,陈育鹏,王淑静,等.HPLC法测定连花淸瘟胶囊中苦杏仁苷的含量[J].中国药房,2016,27(21):2978-2980.
[6]刘睿,王宁,刘志辉.RP HPLC同时测定宣肺止咳口服液中盐酸麻黄碱、盐酸伪麻黄碱及苦杏仁苷的含量[J].中国实验方剂学杂志,2011,17(16):91-93.
[7]刘彬果,张楠.高效液相色谱法测定止咳化痰颗粒中苦杏仁苷含量[J].中国药业,2016,25(15):68-70.
[8]国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:23,305,201,114.

