过表达CD82基因对口腔鳞癌OSCC-25细胞增殖、侵袭和凋亡的影响
柴 娟,孙沫逸,马 超,李 昀,刘 宁,黄 硕
(1西安医学院口腔系口腔颌面外科教研室,西安 710021;2第四军医大学口腔医院口腔颌面外科;*通讯作者,E-mail:chaijuan82@126.com)
头颈恶性肿瘤包括唇癌、口腔癌、鼻腔癌、鼻窦癌、咽喉癌等,为世界第六大恶性肿瘤[1]。其中90%的头颈恶性肿瘤为鳞状细胞癌,其发生和发展主要是癌基因的存在和抑癌基因的缺失[2]。在全球恶性肿瘤中口腔鳞癌患者呈上升趋势[3]。CD82也被称为KAI1基因、R2抗原、C33、IA4、4F9。很多学者发现并证实,CD82与多种组织肿瘤细胞的发生发展有相关性[4-7]。为了研究基因CD82在口腔鳞状细胞癌发生发展中的作用,课题组在前期成功构建了真核表达质粒pIRES2-EGFP-CD82[8],在本次实验中将其转染至OSCC-25细胞中,利用MTT、Transwell小室及Annexin Ⅴ-FITC/PI双染细胞凋亡实验方法检测其对OSCC-25细胞增殖、侵袭及周期的影响变化。
1 材料和方法
1.1 细胞株和质粒
口腔鳞癌OSCC-25细胞购于美国菌种保藏中心ATCC,真核表达质粒pIRES2-EGFP-CD82由第四军医大学口腔颌面创伤实验室所保存。
1.2 主要试剂
胎牛血清购自美国Sigma公司,DMEM培养基购自英国Oxoid,倒置相差显微镜购自国产Motic(型号AE31),FBS、LipofectamineTM2000购自美国Invitrogen公司,质粒pIRES2-EGFP-CD82课题组构建,蛋白酶抑制剂RIPA裂解液购自加拿大Norgen Biotek公司,anti-CD82、二抗羊抗鼠IgG-HRP购自英国Abcam公司,GAPDH购自美国Santa公司。MTT细胞增殖及细胞毒性检测试剂盒购自南京KGA公司(型号:KGA312)。Transwell小室购自美国Corning公司,6孔,孔径8 μm。基底膜Matrige购自美国B.D公司。Annexin Ⅴ-FITC/PI试剂盒购自上海Mbchem,型号M3021。
1.3 细胞培养及质粒转染
实验过程中,用8 ml含10%胎牛血清的DMEM培养基培养OSCC-25细胞,并置于孵育箱中常规传代培养。倒置相差显微镜观察,当90%的OSCC-25细胞聚缩靠拢,细胞间隙增大时,可传代扩大培养。再将5×104的OSCC-25细胞接种在6孔板上,用含有FBS的基础培养基2 ml培养,当细胞长到80%时可以转染。将稀释的质粒pIRES2-EGFP-CD82和LipofectamineTM2000混合均匀后,在室温下孵育20 min,形成复合物后,按LipofectamineTM2000说明书要求,将其加入到培养基的孔中,再将培养板置于37 ℃,5% CO2孵育箱中培养。分别于0,24,48,72 h用荧光显微镜观察细胞转染数量。
1.4 蛋白质印迹法检测CD82蛋白的表达
收集OSCC-25细胞,加入蛋白酶抑制剂RIPA裂解液,按照试剂说明提取总蛋白后进行SDS-PAGE电泳以分离蛋白。将目的蛋白条带电转NC膜,用含5%脱脂奶粉封闭2 h,加入一抗anti-CD82和二抗羊抗鼠IgG-HRP(稀释浓度1 ∶2 000)各1 ml,室温反应1 h。按照电化学发光试剂盒说明显影,以CD82蛋白与内参GAPDH条带灰度值的比值表示目的蛋白的相对表达量。
1.5 MTT检测细胞增殖实验
在96孔培养板中加入约1×104细胞,并置于37 ℃,5% CO2孵育箱中培养72 h,不同时间点收集细胞检测。用Dilution Buffer将试剂盒中MTT稀释后加200 μl DMSO后摇匀。用酶联免疫监测仪以570 nm波长检测每个孔的光密度。实验分为3组:未转染组为空白对照组,转染空载体pIRES2-EGFP为阴性对照组,转染pIRES2-EGFP-CD82组为实验组。细胞增殖率(%)=(对照细胞OD值-受试孔OD值)/对照细胞OD值×100%。
1.6 Transwell检测细胞侵袭实验
转染72 h,收集各组细胞,接种细胞于96孔板中,每孔接种细胞数约为5×105个,在Transwell小室的上室放置细胞悬液200 μl,下室放置500 μl含10% FBS的培养基。将其放于37 ℃环境中培养24 h,将滤纸用苏木青染色10 min,再用95%乙醇溶液固定15 min,4 g/L结晶紫溶液进行染色5 s。400倍显微镜下观察照相,随机选取6个视野计数。实验独立重复3次。
1.7 Annexin Ⅴ-FITC/PI双染细胞凋亡检测
转染72 h,收集各组细胞,并用1×PBS洗涤。用100 μl含5% Annexin Ⅴ-FITC的标记液重悬细胞,并在暗处常温下孵育15 min,每份标本中再加入10 μl PI染色。统计早期凋亡率(右下象限)和晚期凋亡率(右上象限)及总凋亡率(早期凋亡率+晚期凋亡率)。
1.8 统计学分析
实验数据保存在Window Excel数据库,统计学分析结果采用SPSS19.0软件(美国SPSS公司)进行。实验数据采用均数±标准差表示。组间比较选择方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 口腔癌细胞OSCC-25中CD82的高表达
蛋白质印迹法Western blot实验检测,随着转染时间的变化CD82在OSCC-25细胞中的表达量增加,在转染后72 h CD82表达最强(见图1),且与其他时间点比较,差异有统计学意义(P<0.05),且此时在免疫荧光镜下可以观察到超过90%的OSCC-25细胞中有CD82的表达(见图2)。
2.2 过表达CD82基因后口腔癌OSCC-25细胞的增殖能力下降
MTT实验方法测试各分组对OSCC-25细胞增殖能力的影响,时间分别为CD82基因转染后0,24,48,72 h。每组实验重复三次。实验分析:阴性对照组与空白对照组相比,差异无统计学意义(P>0.05);培养72 h,转染实验组的口腔癌OSCC-25细胞增殖活力明显低于空白对照组及阴性对照组(均P<0.05)。实验结果提示,过表达CD82基因可使口腔癌OSCC-25细胞的增殖能力明显降低(见表1,图3)。
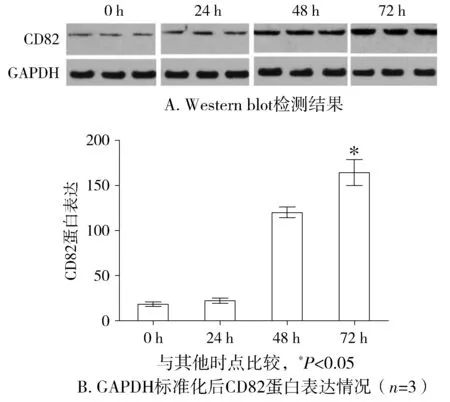
图1 CD82蛋白在OSCC-25细胞中的表达Figure 1 Protein expression of CD82 in transfected OSCC-25 cells
2.3 CD82基因过表达口腔鳞癌OSCC-25细胞的侵袭能力下降
Transwell侵袭实验分析:空白对照组、阴性对照组和CD82转染组的穿膜细胞数分别为43.7±4.5,42.8±3.4,25.1±3.2个;阴性对照组与空白对照组没有明显差异(P>0.05);过表达CD82基因后口腔鳞癌OSCC-25细胞穿过小室膜的细胞数明显减少(见图3),差异具有统计学意义(均P<0.05)。
2.4 CD82基因过表达促进口腔鳞癌OSCC-25细胞的凋亡
Annexin Ⅴ-FITC/PI双染细胞凋亡检测分析:右上象限是晚期凋亡和坏死的细胞百分比(晚期凋亡率),右下象限是早期凋亡的细胞的百分比(早期凋亡率)(见图4)。阴性对照组与空白对照组相比,统计学没有明显差异(P>0.05);在培养72 h,转染实验组的口腔癌OSCC-25早期及晚期凋亡明显高于空白对照组及阴性对照组,差异具有统计学意义(P<0.05,见表2)。

图2 转染72 h光学显微镜和荧光镜CD82在OSCC-25细胞中的表达Figure 2 The protein expression of CD82 in transfected OSCC-25 cells under light and fluorescence microscope
表1各组MTT细胞增殖结果
Table1TheproliferationofOSCC-25inthedifferentgroups

组别0h24h48h72h 空白对照组0.3067±0.00640.3562±0.00810.4353±0.00530.7311±0.026 阴性对照组0.3061±0.00610.3621±0.00640.4331±0.00600.7321±0.035 转染实验组0.3042±0.00530.3433±0.00720.4217±0.00730.4713±0.012*
与其他两组比较,*P<0.05

图3 CD82转染对OSCC-25细胞侵袭能力的影响(光镜,×200)Figure 3 Effect of CD82 transfection on invasion of OSCC-25 cells (light microscope,×200)

图4 CD82转染对OSCC-25细胞凋亡的影响Figure 4 Effect of CD82 transfection on apoptosis of OSCC-25 cells
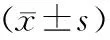
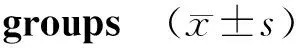

组别n右上象限右下象限空白对照组33.0±0.31.3±0.1阴性对照组33.0±0.11.1±0.1实验组 36.4±0.2*2.3±0.1*
与其他两组比较,*P<0.05
3 讨论
TM4SF蛋白与肿瘤细胞的增殖、移动、融合及免疫系统的调控有关[9,10]。CD82是TM4SF蛋白家族中的主要成员之一,最先是在Dunning兔子前列腺癌模型中发现的抑癌基因[11],随后很多学者发现其与其他组织肿瘤细胞的表达和转移有相关性。CD与其他跨膜蛋白、趋化因子相互作用可以调控肿瘤细胞的黏附、迁移和信号通路。
在本次实验中,首先将pIRES2-EGFP-CD82质粒转染到口腔鳞状细胞癌OSCC-25中,在普通光学显微镜及荧光显微镜中观察到转染72 h时,细胞转染效率最高,为研究CD82在口腔鳞状细胞癌OSCC-25生物学行为提供了实验基础。
Jee等[12]发现过表达CD82可以有效地抑制非小细胞肺癌细胞的转移和侵袭。Yang等[13]通过实验发现过表达CD82可以抑制体外乳腺癌细胞侵袭和体内肿瘤细胞的转移,但在国内尚无报道过表达CD82会对口腔鳞状细胞的生物学行为会有怎样的影响。以往学者只是通过免疫组织化学发现CD82基因表达的缺失与口腔恶性肿瘤的发生、淋巴转移有密切关系。Uzawa等[14]通过组织切片、免疫组织化学方法等发现,CD82的下调存在于原发性和转移性口腔鳞状细胞癌中,且与淋巴转移有相关性。Kawasaki等[15]通过免疫组织化学方法亦发现CD82的表达与口腔癌原发部位及转移部位均有相关性。
MTT法是检测细胞存活和生长的方法,在本实验中,OSCC-25在转染CD82后其细胞生长速度明显较空白对照组和阴性对照组降低。表明过表达CD82后可以显著抑制口腔鳞状细胞的生长。Annexin Ⅴ-FITC/PI双染细胞凋亡实验可以区分凋亡早晚期的细胞以及死细胞区。本实验中通过Annexin Ⅴ-FITC/PI双染细胞凋亡法发现,转染CD82组使细胞的总凋亡率明显上升且较其他组有明显区别。由实验可见过表达CD82后可以促进OSCC-25细胞的调亡。Transwell侵袭实验用于检测肿瘤细胞侵袭能力的实验。转染CD82使OSCC-25细胞的侵袭能力降低,且较其他组有明显区别,说明过表达CD82能明显抑制OSCC-25细胞的侵袭能力。
另外,过表达CD82也可以促进口腔鳞癌细胞的凋亡,可能也与一定的信号通路有关。Odintsova等[16]发现CD82与上皮细胞生长因子EGF诱导的信号通路有关,且与EGF受体和跨膜蛋白有关。Zhu等[17]发现CD82可能是通过抑制TGF-β1/Smad信号通路来抑制肾癌细胞的生长和侵袭。在本实验中通过Annexin Ⅴ-FITC/PI双染细胞凋亡检测发现过表达CD82加速了OSCC-25细胞的凋亡现象。而Schoenfeld等[18]发现CD82与细胞凋亡有关,是因为其可以产生活性氧中间产物并且调控促凋亡cdc42通路。这也为我们后续研究CD82作用于口腔鳞状细胞信号通路提供了线索和方向。
总之,本实验研究提示过表达CD82对口腔癌细胞OSCC-25细胞增殖、细胞侵袭有抑制作用,并且促进口腔鳞癌细胞凋亡。这一现象的发现可能为口腔癌的靶向治疗提供了一种新思想和新途径。
参考文献:
[1]Marcu LG, Yeoh E. A review of risk factors and genetic alterations in head and neck carcinogenesis and implications for current and future approaches to treatment[J]. J Cancer Res Clin Oncol, 2009, 135(10):1303-1314.
[2]Parkin DM, Bray F, Ferlay J,etal. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005, 55(2): 74-108.
[3]Torre LA, Bray F, Siegel RL,etal. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108.
[4]Huang W, Yang J, Ren J,etal. Expression of PTEN and KAI1 tumor suppressor genes in pancreatic carcinoma and its association with different pathological factors[J]. Oncol Lett, 2016, 11(1):559-562.
[5]Ma ZB, Li K, Wang J,etal. Role of KAI1/CD82 polymorphisms in colon cancer risk in Han Chinese population[J]. Med Oncol, 2013, 30(3):668.
[6]Tang Y, Bhandaru M, Cheng Y,etal. The role of the metastasis suppressor gene KAI1 in melanoma angiogenesis[J]. Pigment Cell Melanoma Res, 2015, 28(6):696-706.
[7]Guo J, Fan KX, Xie LI,etal. Effect and prognostic significance of the KAI1 gene in human gastric carcinoma[J]. Oncol Lett, 2015, 10(4):2035-2042.
[8]Chai J, Ju J, Zhang SW,etal. p12CDK2-AP1 interacts with CD82 to regulate the proliferation and survival of human oral squamous cell carcinoma cells[J]. Oncol Rep, 2016, 36(2):737-744.
[9]Toyo-oka K, Yashiro-Ohtani Y, Park CS,etal. Association of a tetraspanin CD9 with CD5 on the T cell surface: role of particular transmembrane domains in the association[J]. Int Immunol, 1999, 11(12):2043-2052.
[10]Lagaudrière-Gesbert C, Le NF, Lebel-Binay S,etal. Functional analysis of four tetraspans, CD9, CD53, CD81, and CD82, suggests a common role in costimulation, cell adhesion, and migration: only CD9 upregulates HB-EGF activity[J]. Cell Immunol, 1997, 182(2):105-112.
[11]Dong JT, Lamb PW, Rinker-Schaeffer CW,etal. KAI1, a metastasis suppressor gene for prostate cancer on human chromosome 11p11.2[J]. Science, 1995, 268(5212): 884-886.
[12]Jee BK, Park KM, Surendran S,etal. KAI1/CD82 suppresses tumor invasion by MMP9 inactivation via TIMP1 up-regulation in the H1299 human lung carcinoma cell line[J]. Biochem Biophys Res Commun, 2006, 342(2):655-661.
[13]Yang X, Wei LL, Tang C,etal. Overexpression of KAI1 suppresses in vitro invasiveness and in vivo metastasis in breast cancer cells[J]. Cancer Res, 2001, 61(13): 5284-5288.
[14]Uzawa K, Ono K, Suzuki H,etal. High prevalence of decreased expression of KAI1 metastasis suppressor in human oral carcinogenesis[J]. Clin Cancer Res, 2002, 8(3): 828-835.
[15]Kawasaki G, Yoshitomi I, Yanamoto S,etal. Expression of thymidylate synthase and dihydropyrimidine dehydrogenase in primary oral squamous cell carcinoma and corresponding metastases in cervical lymph nodes: association with the metastasis suppressor CD82[J]. Anticancer Res, 2011, 31(10):3521-3526.
[16]Odintsova E, Sugiura T, Berditchevski F. Attenuation of EGF receptor signaling by a metastasis suppressor, the tetraspanin CD82/KAI-1[J]. Curr Biol, 2000, 10(16):1009-1012.
[17]Zhu J, Liang C, Hua Y,etal. The metastasis suppressor CD82/KAI1 regulates cell migration and invasion via inhibiting TGF-β 1/Smad signaling in renal cell carcinoma[J]. Oncotarget, 2017, 8(31): 51559-51568.
[18]Schoenfeld N, Bauer MK, Grimm S. The metastasis suppressor gene C33/CD82/KAI1 induces apoptosis through reactive oxygen intermediates[J]. FASEB J, 2004, 18(1):158-160.

