辛伐他汀对非小细胞肺癌A549细胞增殖凋亡的影响及其机制
方倩茹,梁 冰,王效静,郦忆文*
(1蚌埠医学院第一附属医院老年病科,蚌埠 233004;2呼吸系病临床基础安徽省重点实验室;*通讯作者,E-mail:yuhangfeng@629sina.com)
肺癌是世界上最常见、死亡率最高的恶性肿瘤之一[1],其中非小细胞肺癌占到80%-85%。统计表明,非小细胞肺癌患者5年生存率极低,约为15%[2],原因是患者早期症状不明显,发现时多为中晚期,缺乏及时有效的治疗。
辛伐他汀为羟甲基戊二酸单酰辅酶A(HMG-CoA)还原酶抑制剂,能够抑制甲羟戊酸途径,减少体内胆固醇的合成,临床上主要用于降脂治疗,预防心脑血管疾病发生。有研究表明,甲羟戊酸途径在很多方面参与了肿瘤的发生发展,包括肿瘤细胞的增殖,肿瘤的侵袭,肿瘤细胞的转移等[3]。实验证实,辛伐他汀可以抑制多种肿瘤细胞的增殖,如乳腺癌、前列腺癌、肝癌等,具有较好的抗肿瘤作用[4,5]。辛伐他汀对肺癌细胞亦有显著的细胞毒活性[6],并且能够诱导和加强非小细胞肺癌细胞的凋亡[7],然而,对于辛伐他汀诱导的非小细胞肺癌细胞的凋亡具体途径以及分子水平变化的影响仍不清楚。本研究通过体外用辛伐他汀处理非小细胞肺癌A549细胞,观察细胞的生长状态以及测定相关蛋白表达水平的改变,探讨辛伐他汀诱导A549细胞增殖抑制和发生凋亡的可能分子机制。
1 材料与方法
1.1 细胞株与主要试剂
A549细胞株由蚌埠医学院第一附属医院呼吸与危重学科实验室提供,辛伐他汀原料药购自上海TCI化成工业发展有限公司,胎牛血清购自杭州四季青生物工程材料有限公司、C003细胞凋亡-Hoechst染色试剂盒、增强型BCA蛋白浓度测定试剂盒、CCK-8试剂盒购自碧云天生物技术有限公司,Annexin Ⅴ-FITC/PI流式细胞检测试剂盒购自贝博生物科技有限公司,GAPDH购自广州贤至生物科技有限公司,兔抗人XIAP、兔抗人GRP78和兔抗人caspase-3单克隆抗体购自美国Affinity Biosciences公司。
1.2 细胞培养
将非小细胞肺癌A549细胞株常规复苏后,用含10%胎牛血清的DMEM培养基,置于37 ℃,体积分数为5% CO2,95%相对湿度的培养箱中培养,传代,每2 d更换培养基,取对数生长期的细胞进行试验。
1.3 细胞毒性实验
用对数生长期的A549细胞,以每孔3 000个细胞接种于96孔板,加入100 μl含10,20,30,40 μmol/L辛伐他汀,每个浓度设5个复孔,并设置空白对照组,放入37 ℃,5% CO2,95%相对湿度的培养箱中培养,分别于24,48,72 h后,向每孔中加入10 μl的CCK-8,在酶标仪上450 nm波长处测定吸光度值。细胞生长抑制率=(1-各处理组的吸光度值/对照组的吸光度值)×100%。
1.4 Hoechst-33528荧光染色
将对数生长期的细胞接种至6孔板(5×104/ml,2 ml/孔),细胞贴壁后,用10,20,30,40 μmol/L浓度的辛伐他汀作用于细胞48 h后,弃去培养液,加入固定液固定10 min,用PBS清洗,加入荧光染色剂1 ml/孔,染色10 min。再PBS洗3次,吸去多余液体,于荧光显微镜下观察细胞形态。实验设置空白对照组,每个浓度3个复孔,重复3次。凋亡率为单视野中100个细胞出现凋亡的细胞数目,即凋亡细胞数/细胞总数×100%。
1.5 流式细胞仪检测细胞凋亡
将对数生长期的细胞,接种至6孔板(调整细胞浓度为3×104/ml,2 ml/孔),再用不同浓度辛伐他汀0,20,40 μmol/L作用于细胞48 h,同时设置空白对照组,每组3个复孔。消化收集细胞,取5×104细胞于195 μl的结合液中,加入5 μl FITI、5 μl PI后再加入145 μl结合液,同时对照组加入含有细胞的195 μl的结合液,以及155 μl结合液,混匀,室温避光染色15 min,上流式细胞仪检测。实验重复3次。
1.6 蛋白免疫印迹法检测XIAP、caspase-3和XIAP78蛋白的表达
取对数期细胞,用辛伐他汀浓度为0,20,40 μmol/L的培养液处理48 h,提取各组细胞总蛋白,并测定蛋白浓度。取出30 μg蛋白上样进行SDS-PAGE胶电泳,使用插电转膜将蛋白转印至PVDF膜,5%脱脂牛奶封闭2 h,将GAPDH(1 ∶500)作为内参,加入待检测的XIAP(1 ∶1 000),Caspase-3(1 ∶1 000)和GRP78(1 ∶1 000)一抗,4 ℃孵育过夜,TBST洗膜,加入相应二抗(1 ∶10 000),室温孵育2 h,TBST洗3次,倒入显影剂,孵育3 min,进行化学发光反应,并拍照获取图片,实验重复3次。
1.7 统计学分析
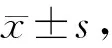
2 结果
2.1 细胞毒性实验结果
在药物辛伐他汀的作用后,A549细胞的增殖活性明显抑制,并且随着时间推移,药物浓度的增高,抑制作用更加明显。辛伐他汀处理24 h,30 μmol/L,40 μmol/L组活性明显低于对照组(P<0.01);处理48 h,辛伐他汀组细胞活性均低于对照组(P<0.05);处理72 h,辛伐他汀组细胞活性明显低于对照组(P<0.01,见图1)。
相同时间与对照组相比,*P<0.05,**P<0.01图1 不同浓度辛伐他汀处理后细胞的OD值Figure 1 OD values of cells treated with different concentrations of simvastatin
2.2 Hoechst33528荧光染色显示辛伐他汀作用后细胞形态学改变
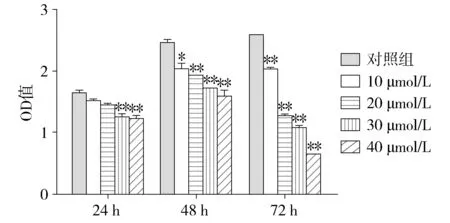
加入不同浓度辛伐他汀(10,20,30,40 μmol/L)作用48 h,显微镜下观察出现细胞凋亡,随着浓度增加凋亡更加明显;光学显微镜下,Hoechst33528荧光染色后,与对照组相比可见细胞形态出现典型的凋亡改变,细胞缩小,细胞核染色质浓缩出现致密浓染,颜色发白,正常细胞核则为正常淡蓝色(见图2)。细胞凋亡率结果显示,经过48 h处理后,20,30,40 μmol/L组细胞凋亡率均高于对照组,差异有统计学意义(P<0.01,见图3)。
A.空白对照组 B.10 μmol/L辛伐他汀C.20 μmol/L辛伐他汀D.30 μmol/L辛伐他汀 E.40 μmol/L辛伐他汀图2 Hoechst33528染色法荧光显微镜下细胞凋亡Figure 2 Hoechst33528 staining of cell apoptosis under fluorescence microscopy

与对照组相比,**P<0.01图3 不同浓度辛伐他汀对A549细胞凋亡率影响Figure 3 Effect of different concentrations of simvastatin on apoptosis rate of A549 cells
2.3 流式细胞技术AnnexinⅤ-FITC/PI双染法检测结果
流式细胞技术AnnexinⅤ-FITC/PI双染法进行染色,正常细胞不会被染色,发生凋亡的细胞会被AnnexinⅤ-FITC/PI染色,结果表明,20 μmol/L、40 μmol/L辛伐他汀组与对照组细胞相比,凋亡率明显升高(见图4)。实验结果得出,辛伐他汀处理48 h,对照组细胞凋亡率为(17.68±0.59)%,辛伐他汀浓度20 μmol/L组细胞凋亡率为(27.31±1.37)%,40 μmol/L组细胞凋亡率为(34.53±0.57)%,两组凋亡率均明显高于对照组(P<0.01)。
2.4 辛伐他汀对细胞内XIAP、Caspase-3和GRP78蛋白表达的影响
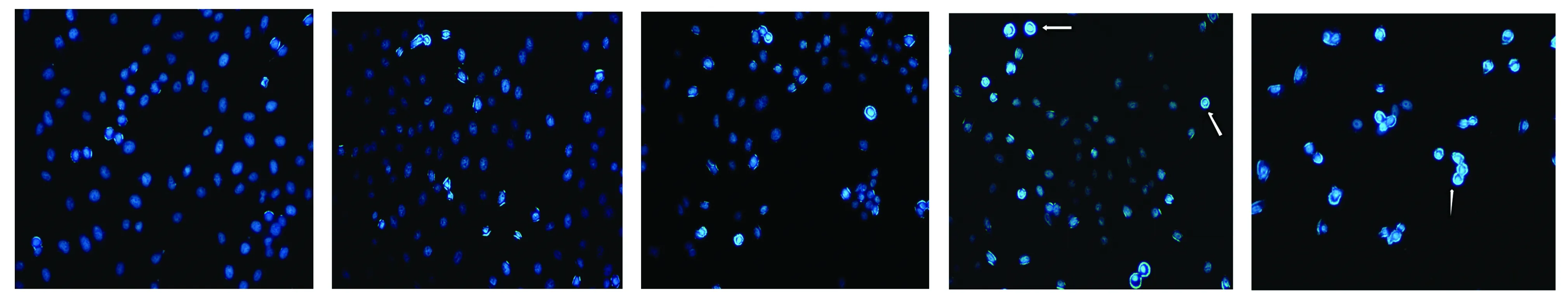
蛋白印迹法检测,辛伐他汀作用48 h,20 μmol/L,40 μmol/L组Caspase-3和GRP78蛋白表达量均高于0 μmol/L组(P<0.01),XIAP蛋白表达量低于对照组,差异具有统计学意义(P<0.01,见图5)。
3 讨论
肺癌是对人类健康以及生命威胁最大的恶性肿瘤之一[1],并且大多数肺癌患者经确诊后已经属于晚期,且治疗效果差,死亡率高。X连锁凋亡抑制蛋白XIAP是IAP家族中结合并抑制caspases蛋白酶最有效,也是唯一能够干扰启动性和效应性半胱天冬氨酸蛋白酶的蛋白质,成为了治疗恶性肿瘤最有吸引力的靶标。
Caspase又称含半胱氨酸的天冬氨酸蛋白水解酶,是程序性细胞死亡过程中的关键介质,其引起的蛋白级联反应,能够选择性地切割蛋白质,损伤细胞DNA,造成细胞的凋亡。Caspase蛋白酶家族有很多成员,主要包括启动性caspase(caspase-8,9,10)和效应性caspase(caspase-3,6,7)等,其中caspase-3是整个凋亡级联过程中最重要的蛋白酶,参与细胞凋亡的两个主要途径[8],其引起的级联反应直接影响细胞凋亡的形态变化[9]。IAP蛋白家族主要是通过BIR1、BIR2、BIR3结构域与Caspase家族介导的凋亡级联反应中位于下游区的caspase-3与caspase-7,9,选择性地结合抑制下游区caspase活性而发挥凋亡抑制作用[10]。研究显示,XIAP能够通过抑制caspase-3蛋白酶活性从而促进恶性肿瘤细胞的生长[11]。本实验结果表明,辛伐他汀可诱导非小细胞肺癌A549细胞的凋亡。随着辛伐他汀药物浓度的增加,A549细胞中XIAP蛋白表达量逐渐降低,caspase-3蛋白表达呈现上升趋势,表明了辛伐他汀对A549细胞是通过降低XIAP对半胱天冬氨酸蛋白酶的抑制作用,使caspase-3得到活化,造成细胞的凋亡。

图4 AnnexinⅤ-FITC/PI双染法检测各组细胞凋亡情况Figure 4 Annexin Ⅴ-FITC/PI double staining of the apoptosis
与对照组相比,**P<0.01图5 Western-blot检测的XIAP,GRP78与Caspase-3蛋白水平的表达Figure 5 The expression levels of XIAP,GRP78,and Caspase-3 protein by Western-blot
细胞凋亡的途径包括线粒体途径和死亡受体途径,而内质网应激(ERS)是这两种凋亡途径之外被研究者们新发现的另一种重要的与内质网有关的凋亡途径。内质网是细胞中极为重要的细胞器,也是细胞表面蛋白与分泌蛋白的折叠、修饰和转运的重要场所。GRP78为内质网上重要的分子伴侣,也是内质网应激凋亡途径中重要的调节因子[12]。在肿瘤组织中,由于肿瘤细胞生长速度过快以及细胞中蛋白质的折叠、组装、转运速度加快,加之细胞内营养物质缺乏,血液供应不足,缺氧,导致了过多的未折叠和错误折叠的蛋白质会聚集在内质网上,引起未折叠蛋白反应(UPR)。这种未折叠蛋白反应会抑制蛋白质的合成,对细胞自身进行保护。当内质网的压力过强或者刺激过强时间过长,超过了细胞的处理能力,应激通路便会切换成细胞凋亡通路,GRP78自身被激活磷酸化,进而激活相关酶和凋亡分子[13],引起一系列凋亡级联反应,最终导致细胞的凋亡。本试验中辛伐他汀持续作用于A549细胞48 h,GRP78蛋白表达呈现增高的趋势,而细胞凋亡却逐渐加重,提示辛伐他汀导致A549细胞凋亡与细胞内的内质网凋亡应激通路的激活有关。
综上所述,本研究通过对加入不同浓度辛伐他汀干扰后A549细胞的生长情况进行观察,得出辛伐他汀对A549细胞增殖有明显的抑制作用,并且呈现时间、浓度依赖性。研究证实了辛伐他汀诱导A549细胞发生凋亡的机制,涉及了两个方面,一是辛伐他汀可以降低XIAP蛋白对caspase-3蛋白酶的抑制作用,使caspase-3得以活化,引起半胱天冬氨酸级联反应,导致细胞凋亡;二是辛伐他汀激活了GRP78相关的内质网凋亡途径,促使细胞发生凋亡,有关其作用的具体内质网凋亡通路机制,还需更进一步的研究探讨。
参考文献:
[1]Socinski MA,Obasaju C,Gandara D,etal. Clinicopathologic features of advanced squamous NSCLC[J]. J Thorac Oncol, 2016, 11(9):1411-1422.
[2]Lin JJ,Cardarella S, Lydon CA,etal. Five-year survival in EGFR-mutant metastatic lung adenocarcinoma treated with EGFR-TKIs[J]. J Thorac Oncol, 2016, 11(4):556-565.
[3]Kato S, Smalley S, Sadarangani A,etal. Lipophilic but not hydrophilic statins selectively induce cell death in gynaecological cancers expressing high levels of HMG-CoA reductase[J]. J Cell Mol Med, 2010, 14(5):1180-1193.
[4]Boudreau DM, Yu O, Johnson J. Statin use and cancer risk: a comprehensive review[J]. Expert Opin Drug Saf, 2010, 9(4):603-621.
[5]Osmak M. Statins and cancer: current and future prospects[J]. Cancer Lett, 2012, 324(1):1-12.
[6]Liu B, Yang J. Effects of simvastatin on cell proliferation and immune escape of non-small cell lung cancer[J]. Chin J New Clin Med, 2013, 6(8):729-732.
[7]Park IH, Kim JY, Choi JY,etal. Simvastatin enhances irinotecan-induced apoptosis in human non-small cell lung cancer cells by inhibition of proteasome activity[J]. Invest New Drugs, 2011, 29(5):883-890.
[8]Yu JQ, Bao W, Lei JC. Emodin regulates apoptotic pathway in human liver cancer cells[J].Phytother Res,2013,27(2):251-257.
[9]Glen NC, Hirakawa BP, Fisher CD,etal. Characterizationof the caspase inhibitor IDN-1965 in a model of apoptosis associated liver injury[J]. J Pharmacol Exp Ther, 2001, 297(2):811-812.
[10]Jin Z, Yan W, Jin H,etal. Psoralidin inhibits proliferation and enhances apoptosis of human esophageal carcinoma cells via NF-kB and P13K/Akt signaling pathways[J]. Oncol Lett, 2016, 12(2):971.
[11]Liu C, WU X, Luo C,etal. Antisense oligonucleotide targeting xiap induces apoptosis of human bladder cancer cell via a mechanism involving caspase-3[J]. J Exp Clin Cancer Res, 2010, 29(3):63-80.
[12]Pelaia G, Gallelli L, Renda T,etal. Effects of statins and far-nesyl transferase inhibitors on ERK phosphorylation, apoptosis and cell viability in non-small lung cancer cells[J]. Cell Prolif, 2012, 45(6): 557-565.
[13]Liang YW, Chang CC, Hung CM,etal. Preclinical activity of sim-vastatin induces cell cycle arrest in G1 via blockade of Cyclin D-Cdk4 expression in non-small cell lung cancer (NSCLC)[J]. Int J Mol Sci, 2013, 14(3): 5806-5816.
——疾病防治的新靶标

