文冠果种子发育过程中神经酸合成积累相关基因的表达分析
王莉 刘晓辉 马静怡 罗媛 李志民

摘要:利用半定量RT-PCR技術分析比较文冠果(Xanthoceras sorbifolium Bunge)种子发育过程中神经酸合成相关基因(KCS、KCR、HCD和ECR基因)在文冠果高神经酸(HNA)、低神经酸(LNA)品系的表达模式,旨在为解析文冠果神经酸合成与积累的分子机制提供重要参考。结果表明,4个基因在两个品系花后40 d的种胚中表达量最高,在随后的种胚发育过程中表达量呈下降趋势或表达量极低。在花后40 d时KCS基因在HNA品系中的表达量高于LNA,但花后54、68和81 d时在HNA品系中的表达量低于LNA。与KCS基因不同的是,HCD基因在HNA品系花后40 d种胚中的表达量低于LNA,而在花后54、68和81 d时HNA品系中的表达量高于LNA。KCR基因在HNA品系种胚中的表达量均低于LNA。ECR基因在HNA品系花后40和82 d种胚中的表达量高于LNA,表明花后40 d是种胚发育过程中神经酸积累的关键时期。KCS和ECR基因主要在种胚发育的早期(花后40 d)调控神经酸的合成,HCD基因在种胚发育的中期和后期调节神经酸的合成过程。
关键词:文冠果(Xanthoceras sorbifolium Bunge);种胚;神经酸;KCS基因;半定量RT-PCR;表达分析
中图分类号:S794.9;Q786 文献标识码:A 文章编号:0439-8114(2018)04-0117-04
DOI:10.14088/j.cnki.issn0439-8114.2018.04.030
Expression of Genes Involved in Biosynthesis and Accumulation of Nervonic Acid during Seed Development in Xanthoceras Sorbifolium Bunge
WANG Li,LIU Xiao-hui,MA Jing-yi,LUO Yuan,LI Zhi-min
(College of Environment and Resources,Dalian Minzu University,Dalian 116600,Liaoning,China)
Abstract: Expression patterns of the genes(KCS,KCR,HCD and ECR gene) involved in biosynthesis and accumulation of nervonic acid were studied and compared in high and low nervonic acid-yielding Xanthoceras sorbifolium Bunge during embryonic development using semi-quantitative RT-PCR technology. This will play an important role for understanding molecular mechaisms of biosynthesis and accumulation of nervonic acid in X. sorbifolium. The results showed that the expression levels of four genes were highest in embryos of two lines at the 40 days after anthesis compared to that of other developmental stages,and then the expression levels decreased or was very low during the subsequent embryo development. The expression level of KCS gene was higher in HNA line than LNA line at 40 d,but its expression level was lower in HNA line compared to LNA line at 54,68 and 81 d. In contrast to the KCS gene,the expression level of HCD gene was lower in HNA line than LNA line at 40 daa,whereas its expression level was higher in HNA line compared to LNA line at 54,68 and 81 d. The expression level of KCR gene was relatively low in HNA compared with LNA. The expression level of ECR gene in HNA was higher compared with LNA at 40 and 81 d. These results indicated that the 40 d was a critical stage for the accumulation of nervonic acid in embryonic development. KCS and ECR genes mainly regulate the biosynthesis of nervonic acid in the early stage of embryonic development (at 40 d). The HCD gene regulates the biosynthesis of nervonic acid in the medium and late stages of embryonic development.
Key words: Xanthoceras sorbifolium Bunge;embryo;nervonic acid;KCS gene;semi-quantitative RT-PCR;expression analysis
文冠果(Xanthoceras sorbifolium Bunge)是中國北方特有的木本油料能源树种,具有较强的抗逆特性,能够适应低温、干旱和贫瘠的土地生境。文冠果种胚(种仁)的含油量高达60%,富含油酸、亚油酸、神经酸等优质不饱和脂肪酸[1],因而成为惟一适宜在中国北方荒漠和干旱半干旱地区种植的木本油料树种。其种子油中神经酸含量约占1.5%~3.0%[2],也是重要的神经酸资源植物,但仍有待提高。
神经酸化学名为顺-15-二十四碳烯酸(C24∶1),是一种超长链单不饱和脂肪酸(VLCMFA),神经酸是大脑神经细胞和神经纤维的核心天然成分,也是惟一能促进受损神经组织修复和再生的双效物质[3]。因此,近年来神经酸受到制药、营养等行业的广泛关注。在植物体中,神经酸是在脂肪酸延长酶复合体(FAE)的催化下经过缩合、还原、脱水和再还原四个反应合成的。脂肪酸碳链延长酶是一个跨膜多酶复合体,由4个功能不同的酶组成,包括β-酮脂酰-CoA合酶(KCS)、β-酮脂酰-CoA还原酶(KCR)、β-羟脂酰-CoA脱氢酶(HCD)和反式烯脂酰-CoA还原酶(ECR)[4]。其中KCS是催化脂肪酸碳链延长的第一步缩合反应的酶,是神经酸合成反应的限速酶[5]。目前,许多研究表明KCS酶能够显著促进植物中神经酸的积累,例如Taylor等[6]从神经酸植物Cardamine graeca中克隆了KCS基因,在转基因酵母中获得神经酸(在野生酵母中不产生),该基因在“种子特异启动子”的调控下,在产油植物埃塞俄比亚芥中异源表达,最终神经酸产量达44%。此外,Huai等[7]将银扇草(Lunaria annua)的KCS基因(LaKCS)导入亚麻荠(Camelina sativa)中,经过异源表达,亚麻荠种子中神经酸含量提高到6%~12%,然而LaKCS、AtKCR和AtHCD基因共表达的转基因亚麻荠株系中神经酸含量没有显著改变。乌兰巴特尔[8]克隆获得了文冠果KCS基因全长cDNA序列,并发现KCS基因在花后40 d的种子中表达量最高。但文冠果种子发育过程中神经酸合成相关基因对神经酸累积的协同调控作用仍然十分有限。
因此,本研究以文冠果de novo转录组数据为基础,设计引物,利用半定量PCR技术深入探讨神经酸合成相关基因在文冠果高、低神经酸品系种子发育过程中的表达模式,为解析文冠果种子发育过程中神经酸合成与积累的分子机制提供重要参考,将有助于文冠果油的品质改良和文冠果分子育种工作。
1 材料与方法
1.1 材料
文冠果高神经酸品系(HNA)和低神经酸品系(LNA)种植于内蒙古自治区通辽市奈曼旗八仙筒林场,其神经酸相对含量分别为4.66%和2.48%。2016年6~8月于文冠果果实发育期采集花后40、54、68、82 d的蒴果,去除种皮,取出种胚在液氮中速冻后放入-80 ℃冰箱保存,用于总RNA提取。
1.2 主要试剂、仪器
柱式植物总RNA抽提纯化试剂盒购自生工生物工程上海(股份)有限公司;PrimeScriptTM RT-PCR试剂盒购自宝生物工程(大连)有限公司;RNase-Free DNase I购自天根生化科技(北京)有限公司。
NanoDrop 2000型超微量分光光度计(美国THERMO);C1000 Touch型梯度PCR(美国BIO-RAD);DYY-7C型电泳仪(北京六一生物科技有限公司);GelDoc-It 310型凝胶成像系统(美国UVP);Mettler Toledo AB135-S型电子分析天平(瑞士Mettler Toledo);XW-80A型微型旋涡混合仪(上海沪西分析仪器厂);Avanti J-E型低温高速离心机(美国BECKMAN)。
1.3 方法
1.3.1 总RNA的提取、定量及完整性检测 采用柱式植物总RNA抽提纯化试剂盒提取两个品系各发育时期种胚的总RNA,并利用RNase-Free DNase I进行基因组DNA的消化。取4 μL RNA样品进行琼脂糖凝胶电泳,通过紫外凝胶成像系统观察提取的总RNA的完整性。利用超微量分光光度计检测总RNA的纯度(A260 nm/A280 nm、A260 nm/A230 nm)并进行定量。
1.3.2 cDNA第一链合成 根据上述检测取调整后达到等量的不同时期种胚总RNA,利用cDNA合成试剂盒(PrimeScriptTM RT-PCR Kit)进行反转录,合成cDNA第一链,于-20 ℃保存备用。
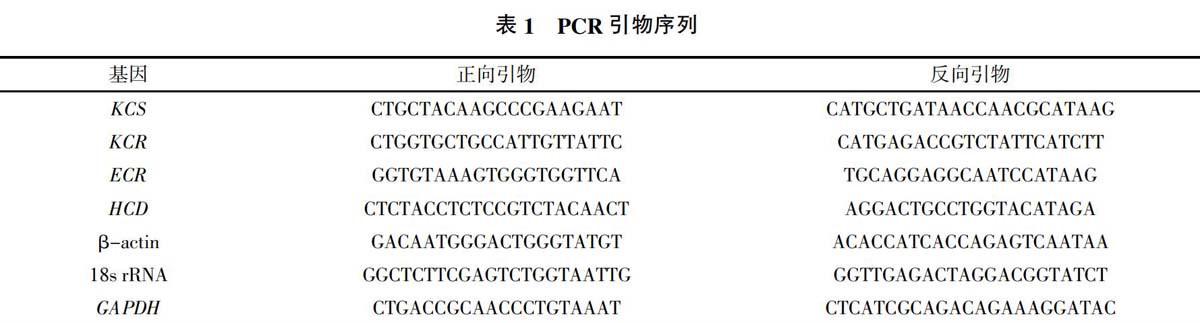
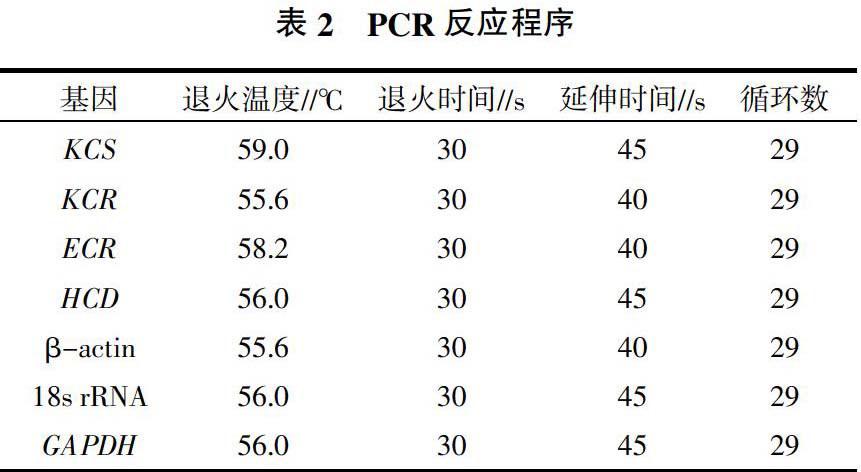
1.3.3 神经酸合成相关基因(KCS、KCR、HCD和 ECR)及植物常用内参基因β-actin、18s rRNA和GAPDH的半定量PCR扩增 依据文冠果de novo转录组数据,筛查KCS、KCR、HCD、ECR、β-actin、18S rRNA和GAPDH基因的序列。根据各基因序列和半定量PCR引物的设计原则,利用Primer Quest Tool在线软件分别设计上述基因的半定量PCR引物(表1),引物由生工生物工程上海(股份)有限公司合成。利用PrimeScriptTM RT-PCR试剂盒对反转录合成的cDNA进行PCR扩增,采用20 μL反应体系,分别加入1 μL两个文冠果品系不同发育时期种胚的cDNA,2 μL 10×PCR Buffer,0.8 μL 10 mmol/L dNTPs,0.2 μL 5 U/μL Taq DNA聚合酶,0.5 μL正、反向引物(10 μmol/L),补ddH2O至20 μL。各引物的PCR反应程序见表2。取5 μL半定量PCR扩增产物并加上样缓冲液,经1%琼脂糖凝胶电泳,EB染色,紫外线观察拍照。所有材料均取样3次,进行3次半定量RT-PCR分析。
2 结果与分析
2.1 文冠果种胚总RNA的提取与cDNA第一链合成
对提取的文冠果种胚的总RNA进行琼脂糖凝胶电泳检测(图1),可观察到各样品总RNA的28S和18S条带整齐、无拖尾,28S RNA条带基本为18S RNA条带亮度的2倍,说明提取的RNA完整性好,未降解,可以用于后续研究。用超微量分光光度计测量提取的RNA样品的A230 nm、A260 nm、A280 nm值,所有样品A260 nm/A230 nm均在1.8~2.0,A260 nm/A280 nm均在1.9~2.2,表明提取的总RNA质量符合要求,可以满足后续试验要求。
反转录体系中RNA总量均为1 μg,通过调整初始RNA的量,以等量的总RNA反转录合成不同的cDNA样品之间可以达到良好的平行性,以此保证半定量RT-PCR试验的一致性,提高半定量结果的可比性。
2.2 两个品系不同发育时期种胚半定量内参基因的筛选
根据文冠果β-actin(ACT)、18S rRNA(18S)和GAPDH各自特异引物的设计参数,确定其最适退火温度,采用半定量RT-PCR技术对这些基因在文冠果种胚发育不同时期的表达进行检测。由琼脂糖凝胶电泳和Quantity One分析结果可知,18S rRNA基因的表达水平波动较小,β-actin和GAPDH基因在种胚发育过程中表达水平都有明显的波动(图2A、图2B)。因此,选取18S rRNA基因为半定量RT-PCR分析的内参基因。
2.3 KCS、KCR、ECR和HCD基因在文冠果不同发育时期种胚的表达
KCS、KCR、ECR和HCD基因在文冠果高、低神经酸品系的4个发育时期种胚分别进行半定量PCR扩增(图3)。由图3可知,KCS、KCR、ECR和HCD基因在两个品系花后40 d的种胚中表达量均高,在随后的种胚发育过程中表达量呈下降趋势或表达量极低。在花后40 d时KCS基因在HNA品系中的表达量高于LNA,然而在花后54、68和81 d时KCS基因在HNA品系中的表达量低于LNA,表明KCS基因主要在花后40 d的种胚中调节神经酸的合成与积累。KCR基因在HNA品系不同发育时期种胚中的表达量均低于LNA,表明KCR对种胚中神经酸合成的贡献较小。与KCS基因不同的是,HCD基因在HNA品系花后40 d种胚中的表达量低于LNA,在花后54、68和81 d时HNA品系中的表达量高于LNA。ECR基因在HNA品系花后40和82 d种胚中的表达量高于LNA,表明ECR基因可能在早期和晚期种胚发育过程中对神经酸累积发挥重要作用。以上结果揭示KCS和ECR基因共同在种胚发育的早期(花后40 d)调控神经酸的合成与积累的关键时期,决定了文冠果种胚中神经酸含量。
3 讨论
管家基因一般是编码细胞基本生命活动所需的蛋白,因此在植物的半定量RT-PCR试验中通常会选用管家基因作为内参基因。管家基因最初被认为在不同组织和器官中它们的表达水平恒定不变[9],但大量的研究表明,管家基因并不是在任何情况下表达水平都能保持稳定不变,即可能在不同发育时期或不同处理条件下发生表达变化,而且某个物种中稳定表达的管家基因也许在另一物种在其他试验条件下表达会发生显著变化[10],所以需要通过具体的试验才能筛选出合适的内参基因。
本研究选择了3个常见的持家基因β-actin、18s rRNA和GAPDH作为候选的内参基因进行试验,在保证反应背景相同的条件下对这3个基因在文冠果种胚发育不同时期的表达情况进行分析。由电泳结果和Quantity One数据分析可知,18s rRNA基因的表达变化相对较小,其余两个基因的表达水平在不同发育时期和不同品系之间均存在明显变化,最终确定了18s rRNA基因为KCS、KCR、ECR和HCD基因在文冠果种胚不同发育时期RT-PCR半定量检测的内参基因。
对文冠果果实生长发育规律的研究表明,KCS和FAD2基因是控制油料作物脂肪酸组成的关键基因,且KCS基因在开花后40 d的种子中表达量最高[8]。根据本试验结果可以得知,在文冠果发育早期的种胚中,KCS、KCR、ECR、HCD基因均有较高的表达水平,但是在种胚发育中期和后期,这些基因表达水平呈下降趋势,表明了文冠果神经酸合成的关键时期是花后40 d左右,这与乌兰巴特尔[8]的报道基本一致。同时本研究中也发现KCR对文冠果种胚中神经酸累积的贡献较小,KCS和ECR基因共同在种胚发育的早期(花后40 d)调控神经酸的合成,而HCD基因在种胚发育的中期和后期调节神经酸的合成过程。本研究结果为解析文冠果种子神经酸合成与积累的分子机制奠定了重要的依据,将有助于文冠果种子油品质的改良和基因工程育种研究。
参考文献:
[1] 赵 娜,张 媛,李秋琦,等.文冠果FAD2的序列与功能分析[J].北京林业大学学报,2015,37(2):87-93.
[2] RUAN C J,YAN R,WANG B X,et al. The importance of yellow horn (Xanthoceras sorbifolia) for restoration of arid habitats and production of bioactive seed oils[J].Ecological Engineering,2017,99:504-512.
[3] 王性炎.我国应重视神经酸植物的发展与利用[J].中国油脂,2011,36(11):52-54.
[4] WHITFIELD H V,MURPHY D J,HILLS M J. Sub-cellular localization of fatty acid elongase in developing seeds of Lunaria annua and Brassica napus[J].Phytochemistry,1993,32(2):255-258.
[5] GUO Y,MIETKIEWSKA E,FRANCIS T. Increase in nervonic acid content in transformed yeast and transgenic plants by introduction of a Lunaria annua L.3-ketoacyl-CoA synthase(KCS)gene[J].Plant Molecular Biology,2009,69(5):565-575.
[6] TAYLOR D C,FRANCIS T,GUO Y,et al. Molecular cloning and characterization of a KCS gene from Cardamine graeca and its heterologous expression in Brassica oilseeds to engineer high nervonic acid oils for potential medical and industrial use[J].Plant Biotechnology Journal,2009,7(9):925-938.
[7] HUAI D,ZHANG Y,ZHANG C,et al. Combinatorial effects of fatty acid elongase enzymes on nervonic acid production in Camelina sativa[J].PLos One,2015,10(6):e0131755.
[8] 烏兰巴特尔.文冠果脂肪酸合成两个关键酶基因FAE1、FAD2的克隆与表达分析[D].呼和浩特:内蒙古大学,2015.
[9] 牙库甫江·阿西木,关 波,张富春.植物基因表达转录分析中内参基因的选择与应用[J].生物技术通报,2011(7):7-11.
[10] 蒋婷婷,高燕会,童再康.石蒜属植物实时荧光定量PCR内参基因的选择[J].园艺学报,2015,42(6):1129-1138.

