氨基酰化酶-1在肝癌组织中的表达及其临床意义*
黄驿胜,王竞枫,林 枫,叶启文,李林立,张代场
肝细胞癌(hepatocellular carcinoma,HCC)是我国常见的恶性肿瘤之一。目前,我国HCC患者约占全球的 55%,已成为发病率最高的国家[1,2]。 肝癌的发生与遗传、环境等多种因素相关,如肝炎病毒感染、黄曲霉素的摄入、寄生虫感染、氯仿等。其中,大多数肝癌的发生都是由肝炎病毒(HBV、HCV)的感染造成的[3]。HCC发病机制隐匿,早期诊断困难,进展期快,恶性度高,术后高复发,预后性差给社会和医疗体系造成了巨大的负担。不少患者在就诊时肿瘤已经发展到了中晚期,失去了最佳治疗机会,即使是接受了手术,预后依然很差,5年总体生存期仍不理想[4]。因此,如何更加有效地防治HCC成为进一步提高患者生存率的主要问题。
氨基酰化酶-1(ACY-1)是一种含锌金属酶,广泛分布于各种组织,基因定位于3p21[5]。ACY-1主要参与生物体内氨基酸代谢,专一水解N-酰基-L-氨基酸的酰胺键形成L-氨基酸,而L-氨基酸参与机体代谢过程,具有生理活性[6-8]。遗传性ACY-1表达缺失会造成代谢异常,致使神经系统出现症状,表现为尿液中N-乙酸氨基酸的检出增加。ACY-1在不同肿瘤组织中的表达趋势也有所不同。在肾癌、肺癌、神经母细胞瘤组织中ACY-1表达下调,结直肠癌组织中ACY-1表达上调,而ACY-1在结直肠癌组织中的高表达预示结直肠癌患者预后不良。此外,Mitta和Tsunasawa等通过对大肠癌细胞、小鼠黑色素瘤细胞中ACY-1的表达进行研究发现,ACY-1在抑癌方面有着重要的作用[9]。由此推测ACY-1可能在肝癌的发生发展中起着重要作用,或许是潜在的肝癌预后评估的分子标志物。
为探讨ACY-1在肝癌中的表达及其作用,笔者收集手术切除的新鲜肝癌组织及配对癌旁组织,利用qRT-PCR技术和免疫印迹的方法分别对HCC患者的癌组织和相应癌旁组织中的ACY-1 mRNA和蛋白的表达水平进行检测。另外,同时结合免疫组化的方法,分析了手术切除、病理科存档的HCC患者石蜡标本中ACY-1蛋白的表达水平及其与临床病理参数之间的相关性,以期为肝癌的诊断、治疗提供依据。
1 资料与方法
1.1一般资料 HCC患者86例,为宁德市闽东医院肝胆外科2009年—2014年手术切除、病理科存档石蜡标本,所有患者在手术前均未接受化疗和放疗。其中男56例,女30例;年龄35~74岁,中位年龄50岁。根据Edmondso四级分级法,将HCC分为Ⅰ~Ⅳ级,Ⅰ、Ⅱ级为高分化,Ⅲ、Ⅳ级为低分化。其中,高分化56例,低分化30例;肿瘤直径<5 cm 48例,直径≥5 cm 38 例;AFP (ng/ml)≥20 ng/ml 58例,AFP(ng/ml)<20 ng/ml 28例;配对的癌旁组织86例,取距肿瘤病灶边缘至少2 cm以外肝组织。
另收集宁德市闽东医院肝胆外科2014年—2015年手术切除的新鲜肝癌组织标本30例。HCC患者术前未接受其他治疗措施,HCC组织标本均经术后病理学确诊为原发性HCC,配对的癌旁组织取至距肿瘤边缘至少2 cm以外肝组织。组织标本离体后立刻存储于液氮,并记录患者临床信息,如年龄、性别、组织学分级、AFP水平等。样品采集遵循法律和伦理委员会准则,并取得患者知情同意。
1.2主要仪器与试剂 高速冷冻离心机(Eppendorf,德国);PCR 仪(Eppendorf,德国);Bio-Rad 电泳系统 (Bio-Rad,美国);凝胶成像系统(Bio-Rad,美国);荧光定量 PCR 仪(Roche 480);Trizol(Invitrogen,美国);RNase-free 水(Takara,中国大连);2×Taq PCR MasterMix(全式金,北京);PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(Takara,中国大连);SYBR○RPremix Ex TaqTMII (Tli RNase HPlus),Bulk(Takara,中国大连);BCA 定量试剂盒(凯基生物,南京);ACY-1 抗体(abcam,美国);抗β-actin 单克隆抗体(Sigma,美国)。
1.3方 法
1.3.1引物的设计与合成 根据文献设计引物序列并由上海生工生物工程公司合成。具体引物序列如下:β-actin上游引物 5'-TTGTTACAGGAAGTC CCTTGCC-3',β-actin 下游引物 5'-ATGCTATCAC CTCCCCTGTGTG-3';ACY-1上游引物 5'-GGCTG CATGAGGCTGTGTT-3',ACY-1下游引物 5'-CTT GGCACTGGTTGGGATG-3'。
1.3.2RNA的提取与反转录 取标本50 mg,加入液氮研磨成粉末,Trizol裂解后继续不断研磨至液体。经氯仿分层、异丙醇沉淀及75%乙醇溶液洗涤干燥后,用适量DEPC水溶解RNA沉淀。取1 μl溶液用NanoDrop 1000超微量分光光度计测RNA浓度及纯度,然后进行cDNA的合成和RNA的电泳。按照TaKaRa试剂盒的操作步骤去基因组DNA后进行反转录。配制反转录反应体系,模板RNA 1 μl加入反应体系后,37 ℃孵育 15 min,85℃孵育5 min。反转录产物置于-20℃。
1.3.3实时荧光定量PCR 实时荧光定量PCR利用SYBR○RGreen qPCR进行检测,β-actin为内参。反应体系为:20 μl:Ex Taq(2×)10 μl,PCR Forward Primer (10 μM)0.8 μl,PCR Reverse Primer(10 μM)0.8 μl,DNA 模板 2 μl,ddH2O 6.4 μl。反应设三复孔。反应条件:预变性95℃ 30 sec;PCR 95℃ 5 sec,60℃ 30 sec,45 个循环;融解 95℃5 sec,60 ℃ 1 sec;降温 50 ℃ 30 sec。 利用 2-△△Ct法计算分析ACY-1mRNA相对表达量。
1.3.4蛋白提取 取大约300 mg样本,研磨后,按1∶5(V/W)的比例加入含有1×蛋白水解酶抑制药的TBS (Tris HCl 50 mmol/L pH7.4;EDTA 2 mmol/L;NaCl 150 mmol/L),将匀浆液超声破碎处理3 min。然后,加入等体积含1×蛋白酶抑制药的0.2%十二烷基硫酸钠溶液(SDS),4℃12 000 rpm离心1 h,收集上清并分装后于-80℃保存。
1.3.5蛋白浓度测定 利用BCA Protein Assay Kit进行蛋白浓度测定,配置工作液,稀释标准品至不同浓度梯度,同时稀释ACY-1蛋白样本10倍待用。将样品及标准品加入96孔板后加入工作液,65℃孵育30 min后,酶标仪测定A562 nm,根据标准曲线计算蛋白浓度。
1.3.6Western blot分析 灌制分离胶和浓缩胶,加电泳缓冲液后上样,电泳后将蛋白转印于NC膜。3%脱脂奶粉封闭后加入一抗:ACY-1抗体(1∶5000)和 β-actin 抗体(1∶5000);4 ℃过夜后洗膜,加入二抗37℃孵育1 h。洗膜后加入ECL显影,用凝胶图像分析仪扫描照片。最后用image-plus软件测量灰度值做统计分析。
1.3.7免疫组化分析 肝组织标本经10%福尔马林固定、石蜡包埋后制片;免疫组织化学以SP法进行。DAB显色,苏木素复染后封片。在高倍镜下随机选取5个视野,当胞质棕黄色染色强度高于背景非特异染色时判断为阳性染色细胞。
1.3.8统计学分析 采用SPSS统计软件分析处理数据,各组数据以(x±s)表示。采用方差分析比较各组之间的差异显著性,并进行等级相关分析,p<0.05为差异有统计学意义。
2 结果
2.1ACY-1 mRNA和ACY-1蛋白在HCC组织中的表达 利用qRT-PCR检测30对肝癌组织及配对癌旁组织中ACY-1 mRNA的表达水平,结果显示:肝癌组织中ACY-1 mRNA的表达水平明显低于配对癌旁组织 (图1)。同时,又利用Western blot方法检测了8对肝癌组织及配对癌旁组织中ACY-1的表达水平,并采用Image J图像分析软件扫描测定光密度值,而后与内参β-actin光密度值相比,得出相对值(图2)。结果表明:肝癌组织中ACY-1蛋白表达水平也明显低于配对癌旁组织。
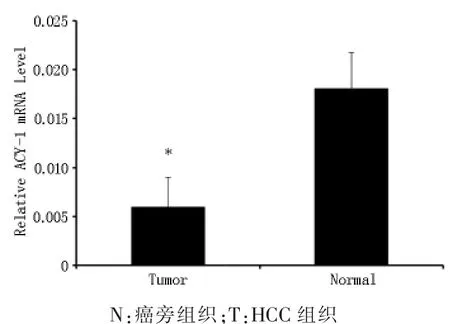
图1 HCC组织及配对癌旁组织中ACY-l mRNA的表达
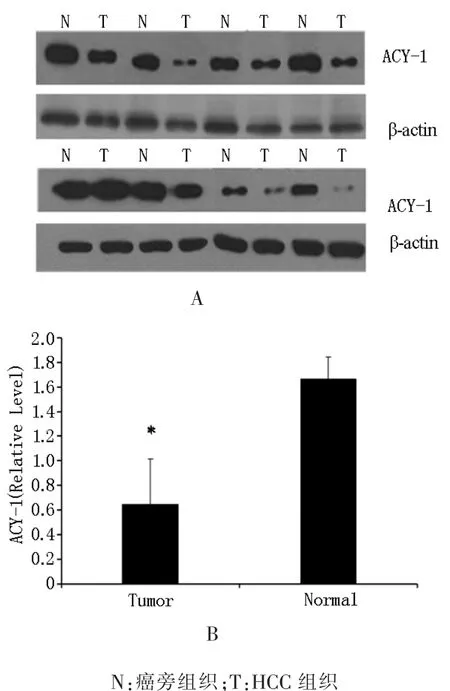
图2 Western Blot检测ACY-l蛋白在HCC组织及配对癌旁组织中的表达
2.2免疫组化分析HCC组织中ACY-1的表达利用免疫组化方法检测86对HCC组织及其配对癌旁组织中ACY-1蛋白的表达。ACY-1蛋白阳性表达为黄色或棕黄色颗粒,根据阳性细胞比例和染色强度计分,将肝癌组织分为ACY-1高表达组(评分“强”)和低表达组(评分“弱”或“中”)。结果发现:HCC组织中ACY-1表达阳性率低于癌旁组织且具有显著差异,这与Western Blot结果一致(图3)。另外,分析ACY-1蛋白表达水平与HCC患者的临床病理参数之间的相关性发现,ACY-1蛋白表达水平与AFP水平密切相关,但与患者年龄、性别、肿瘤大小、组织分化程度、HBV感染因素无关(表1)。
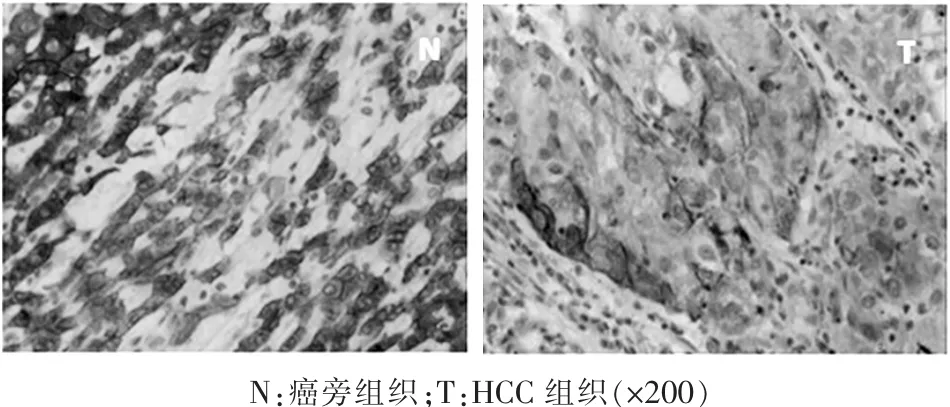
图3 免疫组化检测ACY-1蛋白在HCC组织和癌旁组织中表达
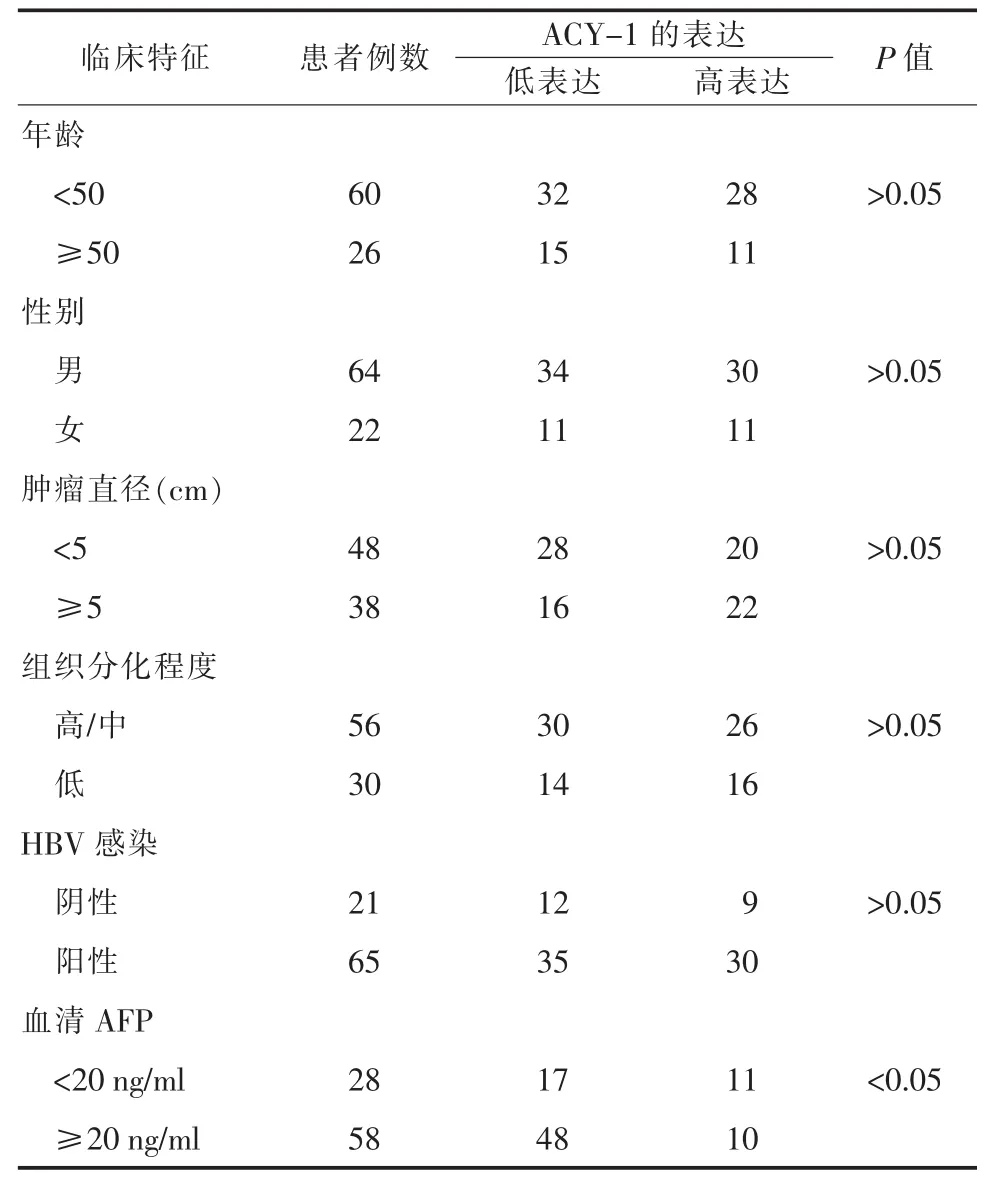
表1 ACY-1蛋白表达与HCC临床病理特征关系
3 讨论
肝细胞癌(HCC)是一种常见的恶性肿瘤,死亡率位居世界恶性肿瘤的前三位,其发病率高,恶性程度高,浸润和转移性强,预后差。我国是肝癌的高发国家,HCC死亡人数约占世界的1/2以上,究其原因之一是患者未能尽早发现并及时治疗,不同分期的HCC疗效和预后有很大的差异。成人肝细胞受损时,肝干细胞可分化为肝细胞和胆管细胞,而干细胞的子代有合成AFP的能力,也有发展为肿瘤细胞的可能性,故AFP广泛应用于HCC的普查和诊断,是一种特异的筛查和诊断HCC的肿瘤标志物,它与影像学检查相结合可以早期发现 HCC。正常人血清AFP参考值为0~7 ng/ml,临床上一般以20 ng/ml作为评价标准。
一部分肝炎或肝硬化患者AFP轻度升高,但一般不会超过200 ng/ml[10]。肝硬化是肝癌发生的主要病因。如以AFP>20 ng/ml为标准,急性肝炎、慢性肝炎和肝硬化的AFP阳性率分别为31%~52%、5%~58%和11%~47%。血清AFP为400 ng/ml是HCC的临界值。当AFP介于20~400 ng/ml时,若连续监测有持续升高的趋势,对HCC的诊断也有价值[11]。虽然AFP在肿瘤的早期筛查和治疗中有重要的作用,但仍有30%~40%的HCC患者的AFP阴性,并且近年来AFP阴性或低滴度AFP的HCC患者逐渐增多;另外病毒性肝炎活动期或肝硬化等因素也会导致 AFP 假阳性[12,13]。因此,寻找特异性的 HCC生物学标志物或特定的治疗靶点对HCC的治疗及预后有着重要意义。
ACY-1是一种广泛分布于各种组织的胞质酶,主要参与生物体内氨基酸代谢,专一水解N-酰基-L-氨基酸的酰胺键形成L-氨基酸,而L-氨基酸参与机体代谢过程,具有生理活性。遗传性ACY-1表达缺失会造成代谢异常,从而导致神经系统症状。ACY-1在许多肿瘤疾病,如小细胞肺癌,肾细胞癌,直肠癌及神经母细胞瘤中的表达都被广泛报道[14],在肺癌和肾癌中ACY-1被报道为一种抑癌基因,但其在肝癌中鲜有报道。肿瘤组织中ACY-1表达水平与肿瘤TNM分期、淋巴结转移和血管侵犯密切相关。肾癌中,利用小干扰RNA技术沉默ACY-1表达后,HCT116细胞增殖能力减弱,凋亡细胞比例增加。ACY-1可以被分泌到外周血中,但大部分的肾移植受者在移植前及后的血清中ACY-1很难被检测到。而高达65%的发生移植肾功能延迟恢复的移植受者,血清中的ACY-1会显著升高,因此ACY-1可以作为肾移植长期预后评判的重要血清标志物。这提示,ACY-1也可能同样有作为HCC血清分子标志物的潜在应用价值。
该研究结果显示,相对于配对癌旁组织,HCC组织中的ACY-1 mRNA表达下调。同mRNA表达趋势一致,Western Blot结果也表明,ACY-1蛋白在肝癌中的表达低于癌旁组织。这与之前在小细胞肺癌和肾癌中的报道一致[15],但与ACY-1在结直肠癌中的报道不同。结直肠癌组织中ACY-1的表达则上调,而ACY-1在结直肠癌组织中的高表达预示着结直肠癌患者的预后不良。ACY-1的缺失可能参与了肝癌发生发展并起到促进作用。有研究报道,ACY-1可以联合CD34和泛素样结合蛋白p62(sequestosome 1)作为区分小肝细胞癌和增生性结节的潜在免疫组化标志物[10]。 另外,ACY-1联合sequestosome-1和glypican-3也可以区分高分化肝癌和增生性结节[10]。因此试验中结合免疫组化的方法,对手术切除、病理科存档的HCC患者石蜡标本中ACY-1蛋白的表达水平及其与临床病理参数之间的相关性进行分析,发现癌旁组织中ACY-1蛋白水平明显高于肝癌组织。与此同时,ACY-1蛋白的表达水平与血清中AFP的水平密切相关,但与患者年龄、性别、肿瘤大小、组织分化程度及HBV感染因素无关。提示不同年龄、不同性别的HCC组织中的ACY-1的表达没有特异性;同时ACY-1的表达与患者肿瘤大小、组织分化程度无关,提示其与肝癌进展情况及恶性程度无关。另外,由于AFP的阳性率只有60%左右,而在部分AFP正常(<20 ng/ml)的HCC患者中也存在ACY-1基因的低表达,或许ACY-1作为肝癌肿瘤标志物的诊断价值需要以正常人群作为对照进行研究。
[1] TORRE LA,BRAY F,SIEQEL RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] CHEN JG,ZHANG SW.Liver cancer epidemic in China:past,present and future[J].Semin Cancer Biol,2011,21(1):59-69.
[3] KEW MC.Epidemiology of hepatocellular carcinoma[J].Toxicology,2002,27(181/182):35-38.
[4] BOBER J,SAMEK P.Surgery of the tumours of the liver[J].Bratisl Lek Listy,2002,103(11):403-407.
[5] MILLER YE,DRABKIN H,JONES C,et al.Human aminoacylase-1: cloning,regional assignment to distal chromosome 3p21.1,and identification of a cross-hybridizing sequence on chromosome 18[J].Genomics,1990,8(1):149-154.
[6] MILLER YE,MINNA JD,GAZDAR AF.Lack of expression of aminoacylase-1 in small cell lung cancer.Evidence for inactivation of genes encoded by chromosome 3p[J].J Clin Invest,1989,83(6):2120-2124.
[7] CALZADILLA P,GOMEZ-SERRANO M,GARCIA-SANTOS E,et al.N-Acetylcysteine affects obesity-related protein expression in 3T3-L1 adipocytes[J].Redox Rep,2013,18(6):210-218.
[8] SASS JO,OLBRICH H,MOHR V,et al.Neurological findings in aminoacylase 1 deficiency[J].Neurology,2007,68(24):2151-2153.
[9] MITTA M,MIYAQI M,KATO I,et al.Identification of the catalytic triad residues of porcine liver acylamino acid-releasing enzyme[J].J Biochem,1998,123(5):924-931.
[10] THOMAS RL,Blakemore KJ.Evaluation of elevations in maternal serum alpha-fetoprotein:a review[J].Obstet Gynecol Surv,1990,45(5):269-283.
[11] WANG ZS,GUO WD,WU LQ,et al.Use of Cytokeratin-19 concentration to assess early recurrence and prognosis of hepatitis B virus-related hepatocellular carcinoma following radical resection in patients with a low serum alpha-fetoprotein concentration[J].PLoS One,2015,10(11):e0142727.
[12] MALUCCIO M,COVEY A.Recent progress in understanding,diagnosing,and treating hepatocellular carcinoma[J].CA Cancer J Clin,2012,62(6):394-399.
[13] HSU CY,HSU CY,LIU PH,et al.Using serum alpha-fetoprotein for prognostic prediction in patients with hepatocellular carcinoma: what is the most optimal cutoff?[J].PLoS One,2015,10(3):e0118825.
[14] WEI X,XIE H,LINQ Q,et al.Proteomics-based identification of the tumor suppressor role of aminoacylase 1 in hepatocellular carcinoma[J].Cancer Lett,2014,351(1):117-125.
[15]魏绪勇.ACY1在肝细胞肝癌中的表达及作用机制研究[D].杭州:浙江大学,2015.

