猪乳外胞体总miRNAUnit对猪繁殖与呼吸综合征病毒复制抑制的研究
蔡锦顺, 关立增, 娄鞍钢, 胡 楠
(延边大学农学院,吉林延吉 133002)
猪繁殖与呼吸综合征(PRRS),又称猪蓝耳病,是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种高传染性的疾病,给养猪业造成了巨大的经济损失[1-2]。研究发现,许多miRNA与抑制PRRSV复制也有密切的关系[3]。miRNA是一类小分子非编码单链RNA,大小为18~25 bp,广泛存在于动物和植物中,并作为重要转录后调节因子调控基因的表达[4]。
最近,研究证明miRNA可以通过外胞体(Exosome)进入循环系统而发挥生物学作用[5]。Exosome是一类由细胞通过内吞作用形成直径为30~100 nm的小囊泡,它通过融合细胞内的多泡体而释放到细胞外环境,在细胞间行使信号交流,是一种新型的细胞间信息交流方式[6]。同时,研究发现miRNA可包裹于母乳Exosome中,母畜可以通过乳Exosome将miRNA传递给仔畜,并发挥生物学作用[7]。
目前,关于猪乳Exosome中与抑制PRRSV复制有关的miRNA的研究还未见报道,因此本研究将以延边地区的长白猪为材料,分离猪乳Exosome并提取总miRNA,在细胞水平上验证其对猪繁殖与呼吸综合征病毒(PRRSV)的抑制作用。本研究将为PRRS的预防和治疗提供新的理论依据和途径。
1 材料与方法
1.1 材料
1.1.1细胞和病毒Marc-145细胞和PRRSV,由延边大学动物传染病实验室保存。
1.1.2主要试剂无水乙醇、CHCl3和异丙醇,购于北京佳兰生物科技公司;Trizol试剂,购于Omega公司;Ribonuclease Inhibitor,购于大连TAKARA公司;DMEM液体培养基、胰蛋白酶和青霉素、链霉素,购于GIBCO公司;胎牛血清,购于浙江杭州四季青生物工程材料有限公司;细胞培养耗材,购于北京佳兰生物科技公司;miRNA提取试剂盒,购于北京佳兰生物科技公司。
1.1.3主要仪器高速大容量冷冻离心机、核酸蛋白测定仪、紫外/可见光分光光度计(Eppendorf公司);细胞培养CO2培养箱(Thermo公司),-80 ℃超低温冰箱(REVCO公司);普通冰箱(SANYO公司);倒置生物显微镜(Olympus公司);分析天平(梅特勒-托利多仪器上海有限公司);超高速离心机(美国贝克曼公司);超净工作台(江苏苏州净化公司);超纯水系统(广东广州誉维生物科技仪器有限公司)。
1.2 方法
1.2.1猪乳Exosome的分离收集200~300 mL延边地方长白母猪(6头)分娩后初乳和常乳的混合样,立即放入 -80 ℃ 冰箱储存备。后将-80 ℃冰箱的乳样解冻,3 000 r/min 4 ℃离心40 min,取上清,去掉乳腺细胞碎片和乳脂蛋白等杂质;之后12 000 r/min 4 ℃离心40 min,取上清,进一步去掉乳脂蛋白、酪蛋白和一些细胞碎片;最后 150 000 r/min 4 ℃超高速离心3 h,获得猪乳Exosome。
1.2.2猪乳Exosome中总miRNA的分离根据miRNA提取试剂盒步骤(北京佳兰生物科技公司)进行miRNA提取,最后用核酸蛋白测定仪测定总RNA浓度,放入-30 ℃备用。
1.2.3细胞水平验证猪乳Exosome对PRRSV复制的影响
1.2.3.1Marc-145细胞的培养从液氮罐中取出保存的Marc-145细胞,迅速放入预热好的37 ℃水浴锅中,反复摇动,使管中液体快速融化。后在离心机中1 500 r/min离心,5 min 后在超净台中吸去上清液,加入1 mL含有10% FBS的DMEM培养基,用玻璃吸管轻轻吹打形成细胞悬液。最后将细胞悬液转移至25 mL细胞培养瓶中,补加含有10% FBS的DMEM培养基至7 mL,放入37 ℃、5% CO2的培养箱内培养。待细胞铺满细胞瓶底后进行传代,在超净台中吸弃旧的培养基,加入2 mL PBS缓冲液洗涤细胞,弃去,然后向细胞瓶中加入1 mL细胞消化液,轻轻摇匀使消化液润到所有细胞,在 37 ℃ 培养箱作用3 min后显微镜下观察,在细胞变圆并有少量细胞脱落漂浮时,立即吸取消化液,加入3 mL含有10% FBS的DMEM培养基,用玻璃吸管反复吹打,使细胞完全脱离瓶底,最后根据细胞的量将细胞转移到新的细胞培养瓶中,补充培养基至5 mL,盖好瓶盖,放入37 ℃、5% CO2的培养箱内培养。
1.2.3.2Exosome对MARC-145的转染按“1.2.3.1”节传代方法将MARC-145细胞传代到6孔细胞培养板上,将铺好细胞小心置于5% CO2细胞培养箱中,当细胞生长至密度约70%时,开始进行转染;取2 mL EP管,加入50 μL DMEM和10 μL Exosome(20 ng/100 μL),轻微混匀;之后将混合液体加入到MARC-145细胞中,置于5% CO2细胞培养箱中继续培养,另设阴性对照组,阴性对照组所用试剂为PBS,转染过程与前述相同。
1.2.3.3PRRSV的接毒试验和滴度测定按“1.2.3.2”节方法进行Exosome转染24 h后,加入MOI为0.5的PRRSV病毒液,放入37 ℃、5% CO2培养箱中24、48 h,收集上清,进行病毒滴度测定。取出细胞瓶,-20 ℃反复冻融3~4次,转移细胞培养物至大离心管中,3 000 r/min离心5 min收集上清液,将收集得到病毒悬液,以10倍稀释(10-1~10-8)后,将各稀释度的病毒液接种于96孔板中的MARC-145细胞,按Reed-Muench的方法进行病毒TCID50滴度测定。同时,在96 h后利用倒置显微镜进行细胞病变效应观察。
1.2.4细胞水平验证猪乳Exosome中总miRNA对PRRSV病毒复制的影响
1.2.4.1Marc-145细胞的培养细胞的培养方法见“1.2.3.1”节。
1.2.4.2总miRNA对MARC-145的转染取2.0 mL EP管,加入不含血清的DMEM和500 ng的总miRNA,配制成miRNA终浓度为50 nmol/L的混合液,之后按“1.2.3.2”节方法进行转染。之后将混合液体加入到MARC-145细胞中,置于5% CO2细胞培养箱中继续培养,另设阴性对照组,试剂采用PBS。
1.2.4.3PRRSV接毒试验和滴度测定PRRSV接毒试验和滴度测定方法同“1.2.3.3”节。
2 结果与分析
2.1 猪乳Exosome对PRRSV病毒复制抑制结果
本试验在6孔板上对MARC-145细胞进行培养,之后用Exosome和PBS进行转染,24 h后感染PRRSV,并在PRRSV感染后24、48 h时收集上清,测定其TCID50。结果表明,转染猪乳Exosome细胞中的PRRSV滴度显著低于转染PBS(阴性对照)细胞中的PRRSV滴度。结果初步说明猪乳Exosome对PRRSV的复制起到了抑制作用(图1)。
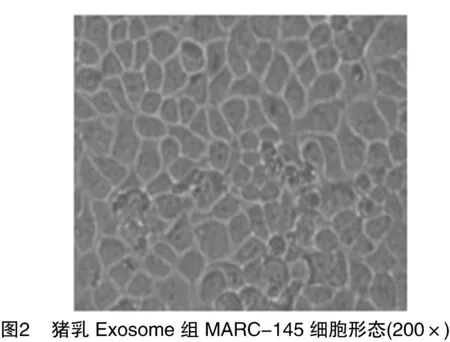
同时,本试验在MARC-145细胞上接种PRRSV 96 h后,在显微镜下对MARC-145细胞的形态进行观察。由图2、图3可知,猪乳Exosome组中MARC-145细胞的形态仍呈不规则的多边形,排列较紧密,边缘较清晰整齐。而阴性对照组(PBS组)中MARC-145细胞形态消失,皱缩、塌陷,边缘不清晰,贴壁细胞出现灶状聚集,大量细胞脱落悬浮。进一步说明,猪乳Exosome抑制了PRRSV在Marc-145细胞上产生的病变反应。证明猪乳Exosome与抑制PRRSV复制有密切的关系。


2.2 猪乳Exosome中总miRNA对PRRSV病毒复制抑制结果
本试验对猪乳Exosome总miRNA进行进一步提取,同样按上述方法在6孔板对MARC-145细胞进行培养,后用提取的总miRNA和PBS对细胞进行转染,24 h后感染PRRSV,分别在24、48 h时收集上清,测定其TCID50。由图4可知,miRNA处理组中的PRRSV滴度显著低于阴性对照组(PBS处理组)的PRRSV滴度,说明猪乳Exosome中的miRNA对PRRSV的复制起抑制作用。

同样本试验在MARC-145细胞上接种PRRSV病毒96 h后,在显微镜下对MARC-145细胞的形态进行观察。由图5、图6可知,miRNA处理组中MARC-145细胞的形态仍呈不规则的多边形,排列较紧密,边缘较清晰整齐;而阴性对照组(PBS处理组)中MARC-145细胞形态开始变形或消失,细胞边缘不清晰,贴壁细胞出现灶状聚集,大量细胞脱落悬浮。此结果也进一步说明,猪乳Exosome中的某些miRNA抑制了PRRSV在Marc-145细胞上产生的病变反应。证明猪乳Exosome中存在与抑制PRRSV复制有密切的关系miRNA。


3 结论与讨论
miRNA对病毒调节作用是人们广泛关注的热点之一,其实miRNA几乎参与调控了各个领域的所有细胞生命活动的发生[4]。成熟的miRNA一般是长度约为22 bp单链RNA,成熟的miRNA与RNA诱导的沉默复合体(RNA-induced silencing complex,RISC)结合,然后与靶基因的3′端非编码区(3′-UTR)互补,调节基因表达,发挥相应的调节功能[8]。miRNA从发现开始就受到病毒学研究者的高度重视,被认为是抗病毒感染的最有效方法之一。而研究表明,miRNA可包裹于母乳的Exosome中,母猪可以通过乳Exosome将miRNA传递给仔猪并发挥生物学作用[7]。如Zhou等在猪乳外胞体中发现了大量免疫相关的miRNA,这些miRNA约有59种,其中miR-148a、30b、182和200b的丰度排在前10位,并且初乳中的数量要高于常乳,而且可抵抗恶劣的环境[9]。因此,关于乳Exosome中miRNA功能的研究正成为国内外研究的一个新的热点。但关于猪乳Exosome中与抑制PRRSV复制有关的miRNA的研究还未见报道,因此本试验首次对猪乳外胞体总miRNA对猪繁殖与呼吸综合征病毒复制抑制作用进行了研究。
本试验首先对猪乳Exosome进行提取并在MARC-145细胞上初步验证Exosome是否对PRRSV的复制有抑制作用。通过病毒滴度测定和细胞病变观察,证实Exosome能显著抑制PRRSV的复制。为了验证Exosome对PRRSV复制的抑制是否通过其含有miRNA起作用,本试验对Exosome的miRNA进行了进一步提取,并通过病毒滴度测定和细胞病变观察证实,提取miRNA能显著抑制PRRSV的复制。综合上述,通过猪乳Exosome中miRNA可以抑制PRRSV复制。本试验结果将为下一步采用生物信息学及分子生物学等方法对猪乳Exosome中的具体miRNA的挖掘并进行功能验证、在细胞水平和活体水平上分析具体抑制PRRSV复制的miRNA功能及确定猪乳Exosome中miRNA抑制PRRSV病毒复制的机理提供实验基础,将为PRRS的防治和药物开发提供一个新的思路。
参考文献:
[1]Meng X J. Heterogeneity of porcine reproductive and respiratory syndrome virus:implications for current vaccine efficacy and future vaccine development[J]. Veterinary Microbiology,2000,74(4):309-329.
[2]张银田. 我国高致病性猪蓝耳病疫情及防控情况[J]. 畜牧市场,2007(7):49.
[3]Lecellier C H,Dunoyer P,Arar K,et al. A cellular MicroRNA mediates antiviral defense in human cells[J]. Science,2005,308(5721):557-560.
[4]Bartel D P. MicroRNAs:target recognition and regulatory functions[J]. Cell,2009,136(2):215-233.
[5]van Niel G,Porto-Carreiro I,Simoes S,et al. Exosomes:a common pathway for a specialized function[J]. Journal of Biochemistry,2006,140(1):13-21.
[6]Théry C,Amigorena S,Raposo G,et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J]. Current Protocols in Cell Biology/Editorial Board,2006(3):unit3.22.
[7]Sun Q,Chen X,Yu J X,et al. Immune modulatory function of abundant immune-related microRNAs in microvesicles from bovine colostrum[J]. Protein & Cell,2013,4(3):197-210.
[8]Kim S,Hwang D W,Lee D S. A study of microRNAs in silico andinvivo:bioimaging of microRNA biogenesis and regulation[J]. FEBS Journal,2009,276(8):2165-2174.
[9]Zhou Q,Li M,Wang X,et al. Immune-related microRNAs are abundant in breast milk exosomes[J]. International Journal of Biological Sciences,2012,8(1):118-123.

