陆地棉GhWOX4转录因子的克隆与生物信息学分析
杨卫军, 吕有军,,3, 赵兰杰, 张永山
(1.安阳工学院,河南安阳 455000; 2.中国农业科学院棉花研究所,河南安阳 455000;3.棉花生物学国家重点实验室,河南安阳 455000)
WOX(WUSCHEL-related homeobox)基因编码的转录因子家族蛋白在植物的生长发育过程中起着至关重要的作用[1-3]。该家族蛋白含有1段能够与DNA序列特异结合的由60~66个氨基酸组成的同源异型结构域(home domain,简称HD),具有调控植物干细胞分裂分化、胚发育、侧生器官发育、顶端分生组织分化和花器官形成等多种重要功能[4-8]。
不同植物中WOX基因的生物学功能不同,在植物生长发育过程中各自扮演着重要的角色。目前已有报道发现拟南芥基因组中存在15个WOX,各个WOX成员在拟南芥中的功能不同[9]。AtWUS基因与茎尖顶端分生组织发育相关,同时也参与花药和子房发育过程[10-12];AtWOX3基因调控拟南芥花瓣的发育[13],AtWOX13和AtWOX14基因除了参与拟南芥花器官发育外,还影响拟南芥根发育[14];AtWOX11和AtWOX12基因共同参与外植体根器官发育[15]。水稻基因组中OsWOX1是参与调控不定根生长发育的主要基因,对激活冠状根的生长发育具有重要作用[16]。此外,在玉米、茄子、番茄、杨树和高粱等植物中也有关于WOX基因的报道[9,17-18]。棉花是世界上一种重要的经济作物,其生长发育经历多个阶段。迄今为止,棉花WOX基因在棉花生长发育过程中的功能未知。本研究以中69-11165为试验材料,采用反转录PCR(简称RT-PCR)技术克隆GhWOX4基因的cDNA全长序列,并进行生物信息学分析,从基因及蛋白结构、序列比对、系统进化树等方面分析该基因的结构和功能,为进一步揭示WOX转录因子在棉花生长发育过程中的功能奠定了基础。
1 材料与方法
1.1 材料
1.1.1植物材料陆地棉(GossypiumhirsutumL.)中69-11165由中国农业科学院棉花研究所中熟课题组提供,种植在中国农业科学院棉花研究所东场试验站。从田间植株摘取叶片,用液氮速冻后保存于-80 ℃冰箱,用于RNA提取。
1.1.2试剂材料RNA提取使用EASYspin Plus植物RNA快速提取试剂盒;焦碳酸二乙酯(DEPC)水、氨苄青霉素(AMP)、异丙基硫代半乳糖苷(IPTG)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)大肠杆菌(Escherichiacoli)Trans1-T1 Phage Resistant Chemically Competent Cell、KOD-Plus-Neo、pEASY-Blunt Cloning Kit载体、Maker Ⅲ购自宝生物工程(大连)有限公司;反转录酶TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix购自北京全式金生物技术有限公司;其他试剂为国产分析纯。引物和DNA测序由苏州金唯智生物科技有限公司合成及完成。
1.2 方法
RNA提取采用EASYspin Plus植物RNA快速提取试剂盒,采用ND1000紫外-可见分光光度计测定D260 nm和D280 nm,计算RNA浓度与纯度。用1.2%琼脂糖凝胶电泳检测RNA的完整性,保存于-80 ℃备用。按照转录酶TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix说明书合成cDNA的第1链。
1.2.1棉花GhWOX4基因克隆用拟南芥AtWOX4(AT1G46480)蛋白序列作为探针,在四倍体陆地棉基因组数据库(http://www.cottongen.org)中通过Blast比对发现了4个相似性较高的基因Gh_D05G1962、Gh_A05G1768、Gh_D01G1055 和Gh_A01G0998。由于这些基因在棉花中的功能未知,笔者选取其中1个基因Gh_D01G1055作为研究对象,用Primer3设计扩增开放阅读框的引物(表1)。以棉花叶片cDNA为模板进行PCR扩增,反应体系见表2。
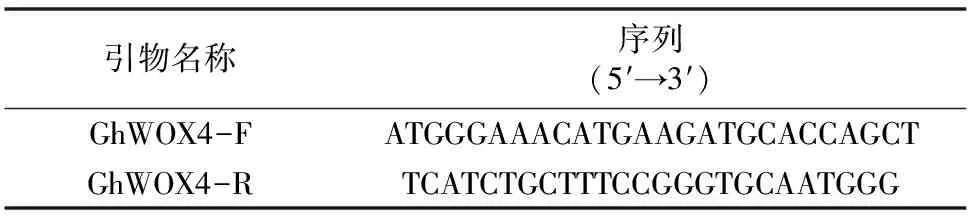
表1 引物序列

表2 PCR扩增反应体系
PCR反应程序:94 ℃预变性5 min;98 ℃变性10 s,55 ℃退火30 s,68 ℃延伸30 s,32个循环;72 ℃延伸10 min。PCR产物用1.2%琼脂糖电泳进行检测,回收并纯化后连接至Peasy-Blunt Cloning Kit载体,转化大肠杆菌Trans-T1 Phage Resistant Chemically Competent Cell感受态细胞,挑取单菌落,摇菌,将鉴定正确的质粒送至苏州金唯智生物科技有限公司测序。
1.2.2GhWOX4基因序列的生物信息学分析用ProtParam(http://web.expasy.org/protparam/)分析蛋白质的基本理化性质;用在线HNN软件(https://npsa-prabi.ibcp.fr/cgi-bin/)在线预测和分析蛋白质的二级结构组成形式;用EBL-EBI (http://www.ebi.ac.uk/interpro/search/sequence-search)和NCBI的BlastP分析氨基酸序列的蛋白质保守区;用IBS 1.0软件绘制蛋白结构域图;用SignaIP和WOLF PSORT(http://psort.hgc.jp/)进行信号肽及亚细胞定位分析;用DNAMAN和Clustal X进行多重序列比对及同源性比对;用MEGA 6.0软件构建进化树。
2 结果与分析
2.1 陆地棉GhWOX4基因克隆及序列分析
以拟南芥AtWOX4(AT1G46480)蛋白序列作为探针,在四倍体陆地棉基因组数据库(http://www.cottongen.org)中发现了4个相似性较高的基因Gh_D05G1962、Gh_A05G1768、Gh_D01G1055 和Gh_A01G0998。由于这些基因在棉花中的功能未知,笔者选取其中1个基因Gh_D01G1055作为研究对象,其基因组序列全长为1 962 bp,包含长度为654 bp的开放阅读框(ORF),以中69-11165棉纤维cDNA为模板,用特异引物GhWOX4F和GhWOX4R进行RT-PCR扩增,经1.2%琼脂糖凝胶电泳检测,获得1条600 bp左右的目的条带(图1)。回收目的片段,测序结果分析显示扩增获得的cDNA序列包含长度为657 bp的开放阅读框,编码218个氨基酸,与陆地棉Gh_D01G1055序列相似性为99.27%,氨基酸序列一致性为72.40%,表明陆地棉不同种间核酸序列存在一些差异。鉴于棉花中WOX基因尚未见到相关研究报道,将其命名为GhWOX4(NCBI登录号为KX900572)。

2.2 GhWOX4基因编码蛋白生物信息学分析
从GhWOX4基因cDNA序列推测GhWOX4蛋白包含218个氨基酸残基,用ProtParam预测GhWOX4蛋白的基本理化性质。结果表明,GhWOX4蛋白分子式为C1119H1 762N336O311S9,理论分子量为25.19 ku,理论等电点(pI)为10.04,酸性氨基酸(Asp+Glu)有19个,碱性氨基酸(Arg+Lys)有36个;含量最丰富的氨基酸有Leu(9.2%)、Lys(9.2%)和Gly(8.3%);脂肪系数为63.99,总平均亲水性为0.913,不稳定系数为58.61,为不稳定蛋白。采用HNN在线预测分析GhWOX4蛋白二级结构,结果表明,该蛋白主要由α-螺旋、延伸直链和无规则卷曲3种结构形式构成,其中α-螺旋包含71个氨基酸,约占32.57%,延伸直链包含28个氨基酸,约占12.84%,无规则卷曲包含119个氨基酸,约占39.86%。可见,无规则卷曲是该蛋白二级结构的主要组成部分。
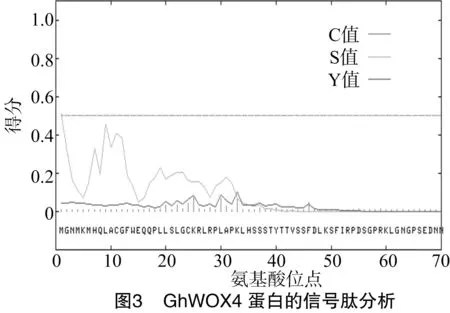
为了进一步确定GhWOX4基因是否属于WOX家族,用EBL-EBI在线分析,结合NCBI 中的BlastP比对,对该基因氨基酸序列进行蛋白质保守区分析,发现GhWOX4基因具有1个同源异型HD(第74位至第147位氨基酸)结构域,该基因属于典型的WOX家族成员,其位置如图2所示。采用SignaIP分析GhWOX4蛋白信号肽并预测信号肽位点表明,其平均分小于0.500,最大Y值预测表明GhWOX4蛋白不存在信号肽及切割位点,属于非分泌蛋白(图3)。由WOLF PSORT软件在线预测该蛋白的亚细胞定位情况表明,GhWOX4蛋白主要定位在细胞质和过氧化物酶体上,在线粒体基质中有少量分布。

2.3 GhWOX4蛋白多重序列比对和蛋白进化树分析
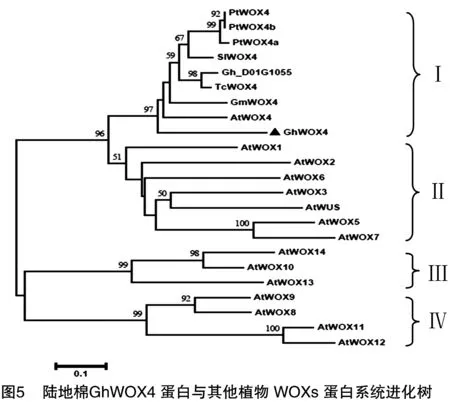
为了解棉花GhWOX4蛋白与其他植物WOX蛋白的亲缘关系,用DNAMAN软件将GhWOX4氨基酸序列与NCBI上公布的其他植物的WOX蛋白进行多重序列比较,结果表明棉花GhWOX4与GenBank中桑树、番茄等植物的蛋白序列相似性均较低,与拟南芥和可可树相似性较高,与陆地棉 Gh_D01G1055 氨基酸序列相似性最高,其同源区域主要集中在同源异型HD结构域,进一步确定该基因属于WOX家族成员,如图4所示。基于棉花GhWOX4及其他植物WOX基因蛋白序列构建系统进化树,分析结果表明,棉花GhWOX4基因同陆地棉Gh_D01G1055基因、拟南芥AtWOX4基因、可可树TcWOX4基因、番茄SlWOX4基因等在同一个进化分支上,属于WOX4亚家族,如图5所示。
3 结论与讨论
与其他植物相比,棉花中大多数的WOX基因仍未被克隆及研究,本试验通过RT-PCR技术克隆了陆地棉中1个WOX基因GhWOX4。氨基酸序列分析和蛋白结构域分析表明,GhWOX4基因含有典型的HD同源异型结构域,并且与拟南芥AtWOX4基因、可可树TcWOX4基因等具有很高的序列同源性,因此属于WOX基因家族。
系统树分析表明,GhWOX4基因属于WOX基因家族的Ⅰ类亚家族成员,与陆地棉中Gh_D01G1055蛋白、拟南芥AtWOX4、可可树TcWOX4、番茄SlWOX4等在同一个进化分支上。有研究表明,拟南芥AtWOX4基因在维管束形成层和原形成层表达,促进形成层和原形成层分化,影响植物的次生生长[19]。沉默OsWOX4后,水稻茎尖分生组织发育异常,植株矮小,株型异常,叶片失绿发黄[20]。OsWOX4除了参与维管束发育,在花的分生组织和花序中也有很高的表达水平[20]。番茄中过表达SlWOX4,其筛管和导管数量明显增多[21]。经高温胁迫处理后番茄通过相应的信号转导途径抑制了SlWOX4的表达水平,表明番茄可能通过调节SlWOX4在器官组织中的表达水平来调控其发育进程来响应高温干旱环境[18]。
通过其他植物WOX4基因功能研究发现,WOX4不仅参与维管束及花器官发育,同时对逆境胁迫具有一定的应答机制。本研究表明,GhWOX4基因属于WOX转录因子家族,具体功能有待利用分子生物学手段进行进一步分析验证,最终为阐明WOX转录因子在棉花生长发育中的功能和机制奠定基础。
参考文献:
[1]Laux T,Mayer K F,Berger J,et al. TheWUSCHELgene is required for shoot and floral meristem integrity inArabidopsis[J]. Development,1996,122(1):87-96.
[2]Haecker A,Grosshardt R,Geiges B,et al. Expression dynamics ofWOXgenes mark cell fate decisions during early embryonic patterning inArabidopsisthaliana[J]. Development,2004,131(3):657-668.
[3]van der Graaff E,Laux T,Rensing S A. The WUS homeobox-containing (WOX) protein family[J]. Genome Biology,2009,10(12):248.
[4]王占军,陈金慧,施季森. 植物干细胞中WUS/CLV反馈调控机制的研究进展[J]. 林业科学,2011,47(4):159-165.
[5]Yadav R K,Reddy G V. WUSCHEL protein movement and stem cell homeostasis[J]. Plant Signaling & Behavior,2012,7(5):592-594.
[6]高丽,孙祎敏,邵铁梅,等. 植物WUSCHEL-related homeobox(WOX)家族研究进展[J]. 生物技术通报,2015,34(5):7-12.
[7]王俞程,何瑞萍,彭献军,等. WOX转录因子家族研究进展[J]. 草业科学,2015,32(5):760-769.
[8]Ueda M,Zhang Z,Laux T,et al. Transcriptional activation ofArabidopsisaxis patterning genesWOX8/9 links zygote polarity to embryo development[J]. Developmental Cell,2011,20(2):264-270.
[9]Zhang X,Zong J,Liu J,et al. Genome-wide analysis ofWOXgene family in rice,sorghum,maize,Arabidopsisand poplar[J]. Journal of Integrative Plant Biology,2010,52(11):1016-1026.
[10]Gross-Hardt R,Lenhard M,Laux T. WUSCHEL signaling functions in interregional communication duringArabidopsisovule development[J]. Genes & Development,2002,16(9):1129-1138.
[11]Deyhle F,Sarkar A K,Tucker E J,et al.WUSCHELregulates cell differentiation during anther development[J]. Developmental Biology,2007,302(1):154-159.
[12]Gallois J L,Nora F R,Mizukami Y,et al.WUSCHELinduces shoot stem cell activity and developmental plasticity in the root meristem[J]. Genes & Development,2004,18(4):375-380.
[13]Vandenbussche M,Horstman A,Zethof J,et al. Differential recruitment ofWOXtranscription factors for lateral development and organ fusion in petunia andArabidopsis[J]. Plant Cell,2009,21(8):2269-2283.
[14]Deveaux Y,Toffano-Nioche C,Claisse G,et al. Genes of the most conserved WOX clade in plants affect root and flower development inArabidopsis[J]. BMC Evolutionary Biology,2008,8(1):291.
[15]Liu J C,Sheng L H,Xu Y Q,et al.WOX11 and 12 are involved in the first-step cell fate transition during de novo root organogenesis inArabidopsis[J]. The Plant Cell,2014,26(3):1081-1093.
[16]Zhao Y,Hu Y F,Dai M Q,et al. The WUSCHEL-related homeobox geneWOX11 is required to activate shoot-borne crown root development in rice[J]. The Plant Cell,2009,21(3):736-748.
[17]韩洪强,刘杨,周子路,等. 茄子SmWOX13基因的克隆、亚细胞定位及序列分析[J]. 上海交通大学学报(农业科学版),2015,33(2):1-8,17.
[18]李晓旭,刘成,李伟,等. 番茄WOX转录因子家族的鉴定及其进化、表达分析[J]. 期刊名称缺失,2016,38(5):444-460.
[19]Hirakawa Y,Kondo Y,Fukuda H. TDIF peptide signaling regulates vascular stem cell proliferation via theWOX4 homeobox gene inArabidopsis[J]. The Plant Cell,2010,22(8):2618-2629.
[20]Ohmori Y,Tanaka W,Kojima M,et al.WUSCHEL-RELATEDHOMEOBOX4 is involved in meristem maintenance and is negatively regulated by the CLE geneFCP1 in rice[J]. The Plant Cell,2013,25(1):229-241.

[21]Ji J B,Strable J,Shimizu R,et al.WOX4 promotes procambial development[J]. Plant Physiology,2010,152(3):1346-1356.

