低温条件下喷施乙烯利对温敏核不育水稻育性的影响
李林芝 魏家萍 贾彦凤 刘小林 张海清 王明 麻浩,*
低温条件下喷施乙烯利对温敏核不育水稻育性的影响
李林芝1魏家萍1贾彦凤1刘小林1张海清2,3王明2麻浩1,*
(1南京农业大学 作物遗传与种质创新国家重点实验室,南京 210095;2湖南农业大学 农学院,长沙 410128;3南方粮油作物协同创新中心,长沙 410128;)
【目的】为解决我国南方温敏核不育水稻制种过程中遇低温易发生育性转换问题,对处于育性转换敏感期的温敏核不育水稻进行低温诱导并喷施不同浓度乙烯利,探讨其对温敏核不育水稻育性的影响。【方法】利用温敏核不育水稻株1S和准S为材料,在育性敏感时期对其进行连续7 d冷灌池低温(22.5℃)诱导并分别喷施乙烯合成促进物质乙烯利和抑制物质二氧化氯溶液,统计花粉可染率及套袋自交结实率,对乙烯合成关键酶进行实时荧光定量PCR分析。分离并分析了乙烯合成途径关键酶和的启动子。【结果】在22.5℃低温诱导条件下,株1S和准S连续7 d 喷水处理后的可染花粉率分别是4.3%和8.9%,套袋结实率分别是1.6%和2.5%;与喷水对照相比,喷施1600 mg/L乙烯利,株1S和准S可染花粉率分别下降3.3和7.2个百分点,且都无结实;喷施1500 mg/L二氧化氯溶液的株1S和准S可染花粉率分别上升3.5和3.3个百分点,套袋结实率分别上升0.78和0.52个百分点。在低温诱导条件下(以喷水为对照),连续7 d 喷施1600 mg/L乙烯利时,株1S和准S幼穗中和基因表达量显著升高,分别是对照(喷水)的1.19、1.24(株1S)和1.24、1.1(准S)倍;连续7 d喷施1500 mg/L二氧化氯溶液时,株1S和准S幼穗中基因表达量变化不显著,而株1S和准S中基因表达量显著降低,分别是对照(喷水)的93%和89%。与正常大田温度相比,在22.5℃低温诱导7 d时,喷水、喷施1600 mg/L乙烯利及1500 mg/L二氧化氯溶液处理分别会导致株1S和准S幼穗中和基因下调表达。此外,发现和的启动子除含TATA盒和CAAT盒等基本结构以外,还含有多个组织特异表达及乙烯调控顺式作用元件。【结论】低温诱导条件下,在温敏核不育水稻育性敏感期,喷施1600 mg/L乙烯利可抑制育性转换。
温敏核不育水稻;低温诱导;乙烯利;育性分析
水稻是人类重要的粮食作物之一,全球60%以上的人口都是以稻米为主粮[1-2]。尽管两系杂交水稻在解决粮食安全问题上作出了巨大贡献,但在生产应用中的问题仍比较突出。我国南方盛夏三天以上的异常低温,极易导致制种过程中温敏核不育水稻发生育性转换(从不育变为可育,俗称“打摆子”)从而导致两系杂交稻大面积制种失败[3-4]。因此,探寻在低温条件下,抑制温敏核不育水稻育性转换的方法,分析温敏核不育水稻育性不稳定的机制,对今后温敏核不育水稻的选育、杂交制种等起到积极的推动作用。温敏核不育水稻育性敏感期遇到低温可引发育性转换[5],安农S-1是第一个被发现并育成的温敏核不育水稻[6],敏感期内日平均温度为27℃以上的高温可导致不育,低于24℃的低温可诱导结实[7]。本课题组发现低温诱导条件下温敏核不育水稻中编码乙烯合成途径关键酶的和明显下调表达,乙烯合成减少,其育性由不育向可育发生转换,因而推测在低温条件下,乙烯可能参与育性转换过程的调控[8-9]。为进一步证实低温诱导条件下外源乙烯利对温敏核不育水稻育性转换的影响及乙烯是否参与其育性转换的调控,本研究以温敏核不育水稻株1S、准S为材料,在冷灌池低温(22.5℃)诱导及大田日均温(30℃)条件下,喷施乙烯合成促进物质乙烯利和抑制物质二氧化氯溶液,调查温敏核不育水稻育性转换情况,分析和启动子中与乙烯调控相关的顺式作用元件并探讨喷施处理后和基因的响应模式,以期为低温条件下温敏核不育水稻育性保持稳定提供技术措施。
1 材料与方法
1.1 材料种植与处理
本研究所用材料为温敏核不育水稻株1S、准S。于2016年5月在湖南农业大学播种,6月插秧,7月对生长发育第Ⅳ期的温敏核不育水稻株1S和准S幼穗进行装盆移栽;每盆移栽4蔸,当每蔸有3个分蘖穗进入第Ⅴ期时标记,在温敏核不育水稻幼穗分化第Ⅳ~Ⅵ期即育性敏感期(Ⅳ~Ⅵ期:雌雄蕊形成期至花粉母细胞减数分裂期)借助人工控温冷水池处理的方法,连续低温(22.5℃)诱导处理1、4、7 d,不同低温诱导时间的材料均同时移进冷水池并在相应的天数后移出,以相应大田自然条件下(日均温30℃)作为对照;同时设置对不同药剂的施用浓度、施用药量的复因子试验,对不同低温诱导处理的材料连续7 d分别喷施乙烯利(1600 mg/L和8000 mg/L)和二氧化氯溶液(750 mg/L和1500 mg/L),每次喷施12蔸,喷施量为25 mL,以喷水作为对照,一盆为一个重复,所有处理和对照均设置3次重复;处理后在相应的时间点采样,用液氮冷冻,-80℃冰箱保存待用。待抽穗开花前,随机对每处理10个即将抽穗的温敏核不育水稻单穗进行套袋;当温敏核不育水稻株1S和准S幼穗抽穗达到1/3时,随机抽取当天将要开花的幼穗,用于花粉镜检。
1.2 温敏核不育水稻育性分析
1.2.1 花粉育性观察
当温敏核不育水稻株1S和准S幼穗抽穗达到1/3时,每处理中随机选取当天可以开花的3个稻穗,每处理每个稻穗中再选择花药已伸长达颖壳2/3的花朵3~6个,剥开内外稃片,从每朵花中取出花药;花粉育性观察参照Zhou等[10],略加修改。
1.2.2 套袋自交结实率
在温敏核不育水稻株1S和准S稻穗开花前,随机对每处理10个即将抽穗的单穗用羊皮纸袋套袋;套袋的不育系幼穗让其继续生长自交结实,待成熟后去掉纸袋,分别统计其自交结实情况(自交结实率% =结实粒数/每穗总粒数×100%)。
1.2.3 引物合成
以NCBI公布的温敏核不育水稻乙烯合成途径关键酶OsACO5(1-氨基环丙烷-1-羧基氧化酶,登录号为AK061064,1-aminocyclopropane-1-carboxylate oxidase)和OsACS5 (1-氨基环丙烷-1-羧基合成酶,登录号X97066,1-aminocyclopropane-1-carboxylate synthetase)基因的CDS序列及其上游2000 bp DNA序列为模板,用Primer Premier 5.0软件设计引物,引物由上海桑尼生物科技有限公司合成(表1)。
1.2.4 实时PCR分析、表达量
利用Trizol法提取不同温度、不同喷施处理条件下温敏核不育水稻株1S和准S幼穗的总RNA,反转录合成cDNA。对乙烯合成途径2个关键基因和设计引物,进行荧光定量PCR扩增,扩增程序为95℃下5 min;95℃下10 s;61℃下30 s;70℃下1 min;40个循环;61℃下30 s,10℃下保存。采用2法分析数据,确定基因的相对表达量[11]。
1.2.5分析和基因的启动子
分离温敏核不育水稻乙烯合成途径关键酶和基因的启动子序列,并与NCBI上公布的序列进行比对,利用BDGP(http://www. fruitfly.org/seqtools/promoter.htm)软件预测启动子的转录起始位点,PlantCARE(http://bioinformatics. psb.ugent.be/webtools/plantcare/html/)软件分析其中与乙烯相关的顺式作用元件。
2 结果与分析
2.1 处理条件下温敏核不育水稻的育性分析
花粉镜检可染花粉率和套袋自交结实率是水稻育性研究中的两项重要参考,同时也是判定水稻不育系的不育性和可繁性的主要依据。为研究低温诱导下温敏核不育水稻株1S和准S育性转换的特性,分别选取冷灌池低温(22.5℃)诱导条件下和正常大田温度(30℃)生长条件下并喷施乙烯利(1600和8000 mg/L)和二氧化氯溶液(750和1500 mg/L)的温敏核不育水稻,观察低温诱导1、4、7 d时及相应对照的可染花粉率和套袋自交结实率(表2和表3)。
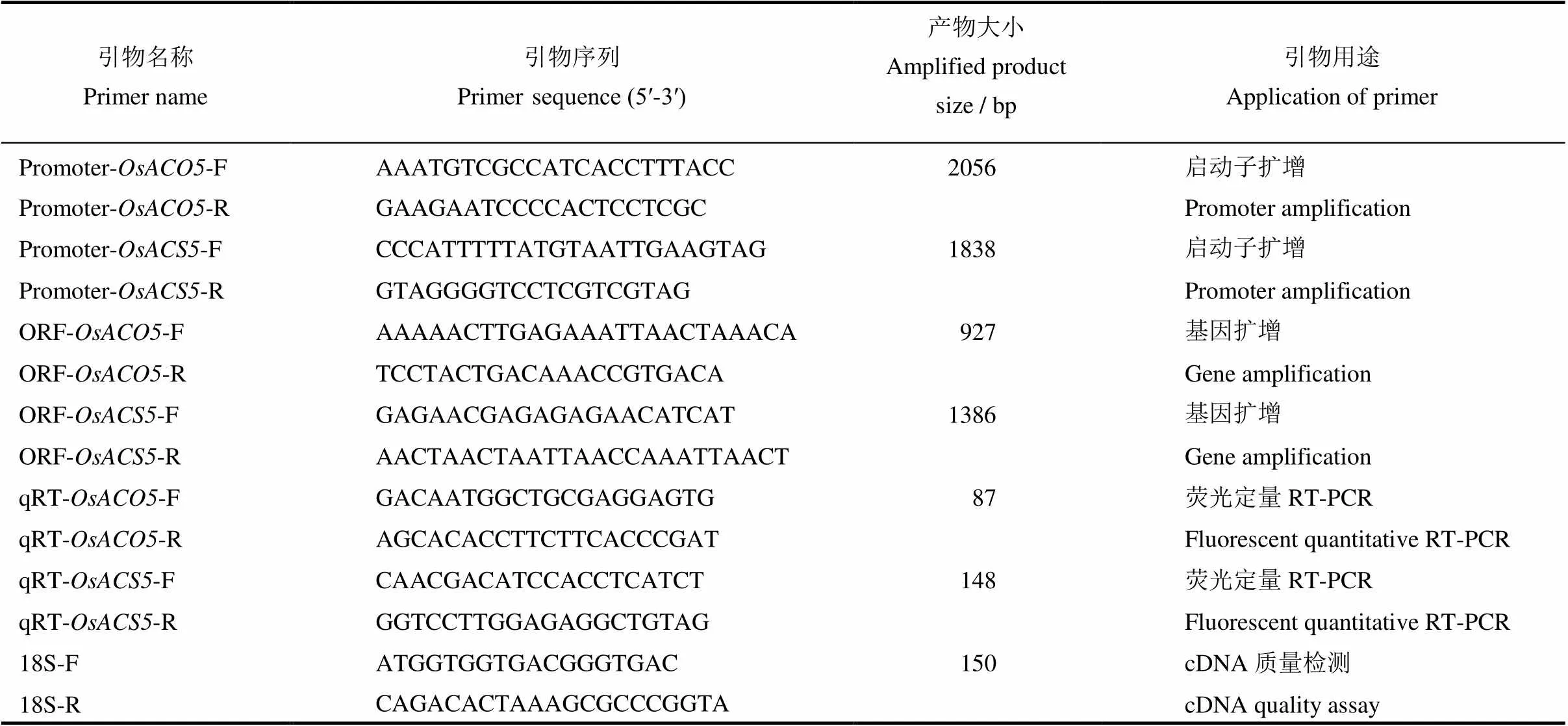
表1 引物序列及PCR扩增片段大小
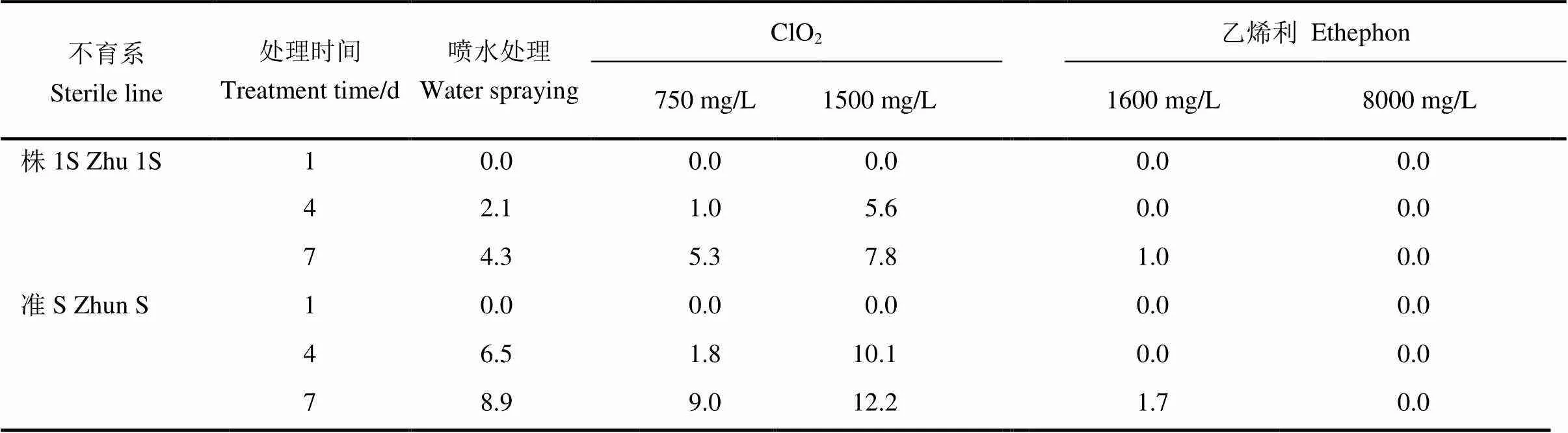
表2 温敏核不育水稻株1S和准S不同处理下可染花粉率
表中数据为冷灌池22.5℃低温诱导条件下的可染花粉率。大田自然温度(30℃)下两个不育系所有处理的可染花粉率均为0。
The data in Table 2 are the dyeing rates of pollen of Zhu 1S and Zhun S treated with artificial cooling water(22.5℃). The dyeing rates of the two sterile lines of all treatments are zero under natural field condition(30℃).
对可染花粉率进行统计发现(表2),在冷灌池低温(22.5℃)诱导条件下,随着低温诱导时间的延长,两株系中花粉可染率均逐渐增加。喷水处理下,低温诱导4 d,两株系均开始有可育花粉出现,株1S花粉可染率达2.1%,准S花粉可染率达6.5%;喷施乙烯利(1600和8000 mg/L)可染花粉率明显低于喷水处理,7 d低温诱导并喷施1600 mg/L乙烯利后株1S花粉可染率降为1%,下降1.1百分点,准S花粉可染率降为1.7%,下降4.8百分点。低温诱导7 d并喷施8000 mg/L乙烯利后花药少且成白丝状,可染花粉率均为0。此外,低温诱导4 d和7 d后,喷施1500 mg/L二氧化氯溶液比喷施750 mg/L二氧化氯溶液处理下两株系中可染花粉率高。且低温诱导4 d并喷施1500 mg/L二氧化氯处理后株1S花粉可染率达5.6%,准S花粉可染率达10.1%。经过7 d低温诱导,喷施1500 mg/L二氧化氯溶液处理后株1S花粉可染率达7.8%,准S花粉可染率达12.2%。在对照正常大田温度(30℃)生长条件下,各喷施处理的温敏核不育水稻株1S和准S可染花粉率都为0%,表现完全败育。说明低温诱导条件下,喷施低浓度的乙烯利后,可染花粉率降低,可育花粉数减少,有效抑制了育性转换。
由表3可见,在冷灌池低温(22.5℃)诱导下喷施1600 mg/L和8000 mg/L乙烯利处理条件下的两株系也没有出现套袋自交结实,结实率为零。而低温诱导下喷施750 mg/L和1500 mg/L二氧化氯溶液处理,两株系出现套袋自交结实,1500 mg/L二氧化氯溶液处理下株1S的套袋自交结实率是2.4%,准S可以达到3.0%。在对照正常大田温度(30℃)生长条件下各喷施处理的温敏核不育水稻株1S和准S均没有套袋自交结实的出现。这一结论与上面的可染花粉率结果相符,一方面说明低温诱导并喷施不同浓度乙烯利和二氧化氯溶液后,温敏核不育水稻株1S和准S的育性均受到影响并发生变化;另一方面说明在低温诱导条件下株1S的育性要相对稳定,而准S的育性稳定性要相对差一些,容易受环境变化的影响。
2.2 不同处理下OsACO5、OsACS5基因的响应模式分析
为了进一步探讨和基因在不同温度(22.5℃和30℃)下连续7 d喷施1600 mg/L乙烯利和1500 mg/L二氧化氯溶液过程中的表达模式,分别取喷施后1、4、7 d的幼穗,采用荧光定量PCR分别对株1S和准S幼穗中和的表达情况进行了分析(图1)。在不同温度、不同喷施处理条件下温敏核不育水稻株1S和准S幼穗中和基因相对表达量存在差异。

表3 温敏核不育水稻株1S和准S不同处理下套袋自交结实率
表中数据为冷灌池22.5℃低温诱导条件下的套袋自交结实率。自然温度(30℃)条件下两个不育系所有处理的套袋自交结实率均为0。
The data in Table 3 are the seed-setting rates of pollen of Zhu 1S and Zhun S treated with artificial cooling water(22.5℃). The seed-setting rates of the two sterile lines of all treatments are zero under natural field condition(30℃).
冷灌池低温(22.5℃)诱导条件下(以喷水为对照),温敏核不育水稻株1S幼穗中基因表达量在喷施1600 mg/L乙烯利后1、4和7 d时均显著升高,分别是对照的1.26、1.22、1.19倍(图1-A),温敏核不育水稻准S幼穗中基因的表达量在4和7 d时均显著升高,分别是对照的1.15和1.24倍(图1-E),表达量在喷施后7 d时显著升高,是对照的1.24(株1S)和1.1(准S)倍(图1-C、G);喷施1500 mg/L二氧化氯,温敏核不育水稻株1S和准S幼穗中基因表达量变化不显著(图1-B、F),在喷施后7 d时表达量显著降低,是对照的91%(株1S)和89%(准S)(图1-D、H)。

A-株1S喷施乙烯利后OsACO5基因相对表达量; B-株1S喷施二氧化氯溶液后OsACO5基因相对表达量; C-株1S喷施乙烯利后OsACS5基因相对表达量; D-株1S喷施二氧化氯溶液后OsACS5基因相对表达量; E-准S喷施乙烯利后OsACO5基因相对表达量; F-准S喷施二氧化氯溶液后OsACO5基因相对表达量; G-准S喷施乙烯利后OsACS5基因相对表达量; H-准S喷施二氧化氯溶液后OsACS5基因相对表达量。
Fig. 1. Relative expression ofandin rice young panicles.
正常大田温度(30℃)条件下(以喷水为对照),喷施1600 mg/L乙烯利,温敏核不育水稻株1S和准S幼穗中基因表达量在喷施后4 d和7 d时均显著升高,分别是对照的1.17、1.13(株1S)和1.2、1.24(准S)倍(图1-A、E),温敏核不育水稻准S幼穗中基因表达量在喷施后7 d时显著升高,是对照的1.1倍(图1-G);喷施1500 mg/L二氧化氯溶液,温敏和不育水稻株1S和准S幼穗中基因表达量在喷施后1 d、4 d和7 d时均显著降低,分别为对照的80%、79%、78%(株1S)和85%、89%、85%(准S)(图1-B、F),基因在株1S和准S幼穗中处理7 d时显著降低,是对照的84%(株1S)和88%(准S)(图1-D、H)。
与正常大田温度(对照)相比,低温(22.5℃)诱导1 d、4 d和7 d时,喷水导致温敏核不育水稻株1S和准S幼穗中和下调表达;喷施1600 mg/L乙烯利导致准S幼穗中和下调表达(图1-E、G),株1S幼穗中在低温诱导后7 d下调表达(图1-A),在低温诱导后7 d上调表达(图C);喷施1500 mg/L二氧化氯溶液后株1S幼穗中和基因表达量在低温诱导后7 d均变化不显著(图1-B、D),准S幼穗中和在低温诱导后7 d均下调表达(图1-F、H)。
在低温诱导条件下,在温敏核不育水稻株1S和准S在育性敏感期喷施1600 mg/L浓度的乙烯利7 d后,和基因,其表达量在幼穗中上调表达;喷施1500 mg/L二氧化氯溶液7 d后,和其表达量在幼穗中呈下调表达。同时,在低温诱导条件下,喷施乙烯合成促进物质乙烯利和抑制物质二氧化氯溶液后,编码乙烯合成途径关键酶的和5基因在响应模式上的差别,也进一步说明和5基因对低温、乙烯利、二氧化氯胁迫的响应可能依赖于乙烯信号途径。
2.3 OsACS5和OsACO5基因启动子的顺式作用元件分析
为了进一步了解的表达调控机制,我们分别分离得其启动子序列,其启动子序列与NCBI上公布的、编码区上游约2000 bp的启动子序列完全一致。利用PlantCARE进行在线分析,发现除含TATA盒和CAAT盒等启动子的基本结构以外,还含有多个与组织特异表达及乙烯调控相关的顺式作用元件等(表4和表5)。这些结果表明,和可能通过这些顺式作用元件参与水稻对低温、二氧化氯、乙烯利胁迫信号传导途径的应答。
3 讨论
两系法杂交水稻是利用同一水稻株系由于受到外界环境变化的影响(主要是光和温)可以一系两用[12-13]。1987年邓华凤等首先发现了温敏核不育水稻,一批实用型株系陆续被选育出来[14-15]。温敏核不育水稻的育性受温光条件控制,一旦温光条件变化,极易导致制种过程中出现“打摆子”现象,从而导致两系杂交稻大面积制种失败。而目前针对这一现象尚无好的方法。

表5 水稻OsACS5启动子序列的顺式作用元件
乙烯是一种挥发性气体,虽然它对作物生长发育有重要作用,但是在生产上难以直接利用[16-17]。现在生产上人们利用比较多的是能释放乙烯的乙烯利水剂(2-氯乙基磷酸),该水剂被植物吸收后,在植物体内产生调节作用,产生促进开花、果实成熟、植株矮化、打破植物休眠等生理效应,因此得到了广泛的应用[18-19]。
有研究表明,在正常大田温度条件下,乙烯利具有良好的化学杀雄作用[20]。刘娜[21]在小麦光温敏雄性不育系孤雌生殖和育性调节研究中发现乙烯利可降低BS366和BS400结实率并使两种材料都达到100%不育;杭州市农业科学研究所和浙江农业大学分别于1977年、1978年两年应用乙烯利进行小麦化学杀雄制种,大田制种初步获得成功[22]。同时在正常大田温度条件下,外源乙烯利能促进内源乙烯的合成。肖层林等[23]研究表明用外源乙烯利、杀雄剂2号(甲基胂酸钠)等处理水稻诱导雄性不育时能够刺激内源乙烯的合成。谢学民等[24]发现乙烯利处理小麦诱导雄性不育主要是通过乙烯利分解为乙烯而实现的。乙烯在水稻育性中起到一定的调控作用,乙烯利能显著提高水稻幼穗中内源乙烯的释放量,并具有抑制花粉发育的作用[25-26]。李德鸿等[27]发现在光敏核不育水稻中,内源乙烯的含量与水稻育性呈负相关,在花粉单核期不育幼穗中的乙烯释放量是可育幼穗的2.5~5.0倍。本课题组前期利用蛋白质组学方法对温敏核不育水稻的育性转换进行了研究,发现在实验温度从正常温度28℃~30℃变换为22.5℃低温时,其育性发生了转换,并发现低温诱导条件下和明显下调表达,乙烯合成减少。
本研究中,在低温诱导条件下,用1600 mg/L浓度的乙烯利处理育性转换期的温敏核不育水稻,导致其可育花粉数减少,结实率降低,有效抑制了育性转换,但高浓度的乙烯利会对水稻植株产生一定药害,特别是8000 mg/L高浓度会导致抽穗延迟,幼穗发白,花药减少且呈白丝状,株高变矮。同时,低温诱导条件下,用1600 mg/L浓度的乙烯利处理育性转换敏感期的温敏核不育水稻,其幼穗中编码乙烯合成途径关键酶的和基因呈上调表达。但笔者对内源乙烯含量进行检测,由于不同处理下材料中内源乙烯含量少,没有检测到内源乙烯合成变化,乙烯合成途径前体物质ACC含量变化也未检测到。受环境控制的温敏核不育水稻育性转换机理甚为复杂。在低温诱导条件下,乙烯利抑制育性转换的机制是由于喷施外源乙烯利后的化学杀雄作用,还是在喷施外源乙烯利后促进了内源乙烯的合成,或者是两者共同的作用,要从现有的实验结果得到确切结论,尚为时过早。这些都有待进一步的研究。
[1] 袁隆平. 发展杂交水稻保障粮食安全. 杂交水稻, 2010, 25(S1): 1-2.
Yuan L P. Development of hybrid rice to ensure food security., 2010, 25(S1): 1-2. (in Chinese with English abstract)
[2] 乔娟. 中国主要粮食国际竞争力研究. 北京: 中国农业科学院, 2004.
Qiao J. The study on international competitiveness of China's main grain. Beijing: Chinese Academy of Agricultural Sciences, 2004. (in Chinese with English abstract)
[3] 陈正洪, 袁业畅. 武汉盛夏低温及其对农业的影响初析. 湖北农业科学, 1990, 36, 4(8): 9-12.
Chen Z H,Yuan Y C. The preliminary analysis of low temperature in summer in Wuhan and its influence on Agriculture., 1990, 36, 4(8): 9-12. (in Chinese)
[4] 陈大洲, 王任初, 熊焕金, 陈春莲. 几个籼型光敏感核不育系生产应用简介. 江西农业科技, 1991(3): 12-13.
Chen D Z, Wang R C, Xiong H J, Chen C L. A brief introduction to the production and application for several indica photoperiod sensitive genic male sterile lines., 1991(3): 12-13. (in Chinese with English abstract)
[5] Salgotral R K, Gupta B B, Ahmed M I. Characterization of thermo-sensitive genic male sterility (TGMS) rice genotypes (L.) at different altitudes., 2012; 6(6): 957-962.
[6] 周广洽, 李训贞, 谭周鎡. 水稻籼型不育系安农不育基因表达条件和育性转换规律的研究. 湖南师范大学: 自然科学学报, 1990, 13(4): 365-372.
Zhou G Q, Li X Z, Tan Z Z. Study on the expression conditions of indica male sterile lines rice geneand fertility transformation.:, 1990, 13(4): 365-372. (in Chinese with English abstract)
[7] 陈良碧, 周广洽. 温光条件对水稻安农s-I/衡农S-l的育性及生理的影响. 植物学报, 1994, 36(S):119-1234
Chen L B, Zhou G Q. The effect on sterility and physiology of Annong s-I/Hengnong S-l under temperature and light characteristics., 1994, 36(S): 119-123. (in Chinese with English abstract)
[8] 刘忠奇. 光温敏核不育水稻育性转换生理及相关蛋白的研究. 长沙: 湖南农业大学, 2013 .
Liu Z Q. Studying on physiology and related proteins of the fertility transformation in thermo-sensitive genic male sterile rice. Changsha: Hunan Agricultural University, 2013. (in Chinese with English abstract)
[9] Song L R, Liu Z Q, Tong J H, Xiao L T, Ma H, Zhang H Q. Comparative proteomics analysis reveals the mechanism of fertility alternation of thermosensitive genic male sterile rice lines under low temperature inducement., 2015(15): 1884-1905.
[10] Zhou Y F, Zhang X Y, Xue Q Z. Fine mapping and candidate gene prediction of the photoperiod and thermo-sensitive genic male sterile gene(t) in rice.&, 2011, 12(6): 436-447.
[11] Lival K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2method., 2001, 25: 402-408.
[12] 袁隆平, 陈洪新. 杂交水稻育种栽培学. 长沙: 湖南科学技术出版社, 1988: 364
Yuan L P. Chen H X. Hybrid Rice Breeding and Cultivation. Changsha: Hunan Science and Technology Press, 1988: 364. (in Chinese)
[13] 斯华敏, 付亚萍, 刘文真, 孙宗修, 胡国成. 水稻光温敏雄性核不育系的系谱分析. 作物学报, 2012, 38(3): 394-407.
Si H M, Fu Y P, Liu W Z, Sun Z X, Hu G C. Pedigree analysis of photoperiod-thermo sensitive genic male sterile rice., 2012, 38(3): 394-407. (in Chinese with English abstract)
[14] 邓华凤, 舒福北, 袁定阳. 安农S-1的研究及其利用概况. 杂交水稻. 1999, 14(3): 1-3
Deng F H, Shu F B, Yuan D Y. Research and utilization of Annong S-1., 1999, 14(3): 1-3. (in Chinese with English abstract)
[15] 段敏, 谢留杰, 黄善军, 潘晓飚. 水稻籼型不育系选育研究进展. 中国稻米, 2016, 22(3): 25-29.
Duan M, Xie L J, Huang S J, Pan X B. Advances in breeding of indica CMS lines rice., 2016, 22(3): 25-29. (in Chinese with English abstract)
[16] Johnson P R, Ecker J R. The ethylene gas signal transduction pathway: A molecular perspective., 1998, 32, 227-254.
[17] Abeles F B, Morgan P W, Saltveit M E. Ethylene in Plant Biology. New York: Academic Press, 1992: 1-296.
[18] 王熹, 阐瑞芬, 蒋志荣, 徐马福. 乙烯利诱导水稻雄性不育的生理效应. 植物生理学报, 1981, 7(1): 11-18.
Wang X, Chan R F, Jiang Z R, Xu M F. Ethrel induced male sterile rice physiological effect., 1981, 7(1): 11-18. (in Chinese with English abstract)
[19] 李凝. 乙烯的生物合成及其在农业上的应用//中国科学技术协会. 生命科学与生物技术中国科协第三届青年学术年会论文集. 北京:中国科学技术出版社, 1998.
Li N. Ethylene biosynthesis and its application in agriculture//China Association for Science and Technology. Life Science and Biotechnology: The Third Annual Academic Proceedings of China Association for Science and Technology. Beijing: China Science and Technology Press, 1998. (in Chinese with English abstract)
[20] 陈知子. 植物化学杀雄研究进展. 资源开发与市场, 2010(2): 143-145.
Chen Z Z. Advances in the study of plant chemical killing., 2010(2): 143-145. (in Chinese)
[21] 刘娜. 小麦光温敏雄性不育系孤雌生殖和育性调节研究. 北京: 首都师范大学, 2007.
Liu N. The studies on parthenogenesis and fertility regulation of photoperiod-thermo-sensitive genic male sterile lines wheat. Beijing: Capital Normal University, 2007. (in Chinese with English abstract)
[22] 谢学民, 张全德, 朱汉如. 小麦化学杀雄制种技术. 农业科技通讯, 1979(5): 5-6
Xie X M, Zhang Q D, Zhu H R, Chemical male sterile seed production technique in Wheat., 1979(5): 5-6. (in Chinese)
[23] 肖层林, 张海清, 麻浩. 植物杂种优势原理与利用. 北京: 高等教育出版社, 2015: 52-53.
Xiao C L, Zhang H Q, Ma H. Principle and utilization of plant heterosis. Beijing: Higher Education Press, 2015: 52-53. (in Chinese)
[24] 谢学民, 张全德, 朱汉如, 刘愚.14C-乙烯利对小麦杀雄机理的研究:14C-乙烯和14C-乙烯利的吸收、分布和代谢. 浙江农业大学学报, 1980(2): 33-41.
Xie Q M, Zhang Q D, Zhu H R, Liu Y. Study on the mechanism of14C-ethephon on wheat chemical hybridizing: Absorption, distribution and metabolism of14C-ethylene and14C-ethephon., 1980(2): 33-41. (in Chinese with English abstract)
[25] 骆炳山, 李文斌. 湖北光敏核不育水稻育性转换机理初探. 华中农业大学学报, 1990, 9(1): 7-12
Luo B S, Li W B. Preliminary study on the mechanism of fertility conversion of photoperiod sensitive genic male sterile rice in Hubei., 1990, 9(1): 7-12. (in Chinese with English abstract)
[26] Lau O L, Yang S F. Inhibition of ethylene production by cobaltousin., 1976, 58(1): 114-117.
[27] 李德红, 骆炳山, 屈映兰. 光敏核不育水稻幼穗的乙稀生成与育性转换. 植物生理学报, 1996, 22 (3):320-326.
Li D H, Luo B S, Qu Y L. Ethylene generation and fertility transformation in young panicle of photoperiod sensitive genic male sterile rice., 1996, 22(3): 320-326. (in Chinese with English abstract)
Effects of Exogenous Ethephon on Fertility of Thermo-sensitive Genic Male Sterile Rice Lines Under Low Temperature Inducement
LI Linzhi1, WEI Jiaping1,JIA Yanfeng1, LIU Xiaolin1, ZHANG Haiqing2,3, WANG Ming2,MA Hao1,*
(1State Key Laboratory of Crop Genetics and Germplasm Enhancement, Nanjing Agricultural University, Nanjing 210095, China;2College of Agriculture, Hunan Agricultural University, Changsha 410128, China;3Southern Regional Collaborative Innovation Center for Grain and Oil Crops in China, Hunan Agricultural University, Changsha 410128, China;)
【Objective】This research aims to elucidate the mechanism behind sterility conversion(infertile convert into fertile) in low temperature ofthermo-sensitive genic male sterile rice in seed production in South China by applying exogenous ethephon.【Method】The thermo-sensitive genic male sterile rice cultivars Zhu 1S and Zhun S weretreated with artificial cooling water tank (low temperature, 22.5℃) induction for 7 days and sprayed with ethephon (which promote synthesis of ethylene) and the chlorine dioxide solution (inhibitory substances)during fertility-sensitive period. Then the pollendyeing rate and the bagged seed-setting rate were calculated and the quantitative real-time PCR was conducted. In addition, the promoters ofand, which are key enzymes of ethylene synthesis pathway, were isolated and analyzed.【Result】Under 22.5℃ for 7 days, the pollen rate of Zhu 1S and Zhun Swas 4.3% and 8.9%, and bagged seed-setting rate was 1.6% and 2.5%, respectively. Compared with the water spray control, the pollen rate of lines Zhu 1S and Zhun S was reduced by 3.3and 7.2 percent, respectively when spraying with 1600 mg/L ethephon. When spraying with 1500 mg/L of chlorine dioxide solution, the pollen rate was increased by 3.5and 3.3 percent, and the bagged seed setting rate increased by 0.78and 0.52 percent, respectively. The expression ofandin young panicles was significantly increased at 1600 mg/L of ethephon under 22.5℃ induction for 7 days, which were 1.19, 1.24 (Zhu 1S) and 1.24, 1.1 (Zhun S) times of that of the control (water spray) respectively. When sprayed with 1500mg/L of chlorine dioxide solution for 7 days, the expression ofgene in the Zhu 1S and Zhun S was significantly reduced, which were 0.93 and 0.89 times of that of the control (water spray), respectively, but the expression ofwas not significantly changed. Compared with normal field temperature (control) for 7 days, water spraying, 1600 mg/L of ethephon and 1500 mg/L of chlorine dioxide solution at22.5℃down-regulated the expression ofandin young panicles of Zhu 1S and Zhun S.The promoters ofandcontained multiple tissue-specific expression elements and ethylene-regulated cis-acting elements in addition to the basic structures such as TATA-box and CAAT-box. 【Conclusion】Under low temperature condition, spraying 1600mg/L ethephon in the sensitive period of thermo-sensitive genic male sterile rice had inhibitory effect on fertility conversion from sterility to fertility.
thermo-sensitive genic male sterile rice; low-temperature inducement; ethephon; fertility
Corresponding author, E-mail: Lq-ncsi@njau.edu.cn
Q948.112+.2; S511.034
A
1001-7216(2018)02-0128-09
2017-04-19;
2017-06-13。
湖南省财政预算农业专项;国家公益性行业科研专项(201303005)。
通讯联系人,E-mail: Lq-ncsi@njau.edu.cn
10.16819/j.1001-7216.2018.7045

