七叶树幼苗对水分胁迫和复水的生理响应
(北京林业大学 省部共建森林培育与保护教育部重点实验室,北京 100083)
城市化发展影响下,园林绿化树种的需求逐渐增加[1]。随着全球气候变暖、城市热岛效应等问题日益突出,水分缺乏成为限制城市园林绿化树种生长的重要因素[2-3]。水分胁迫不仅会造成植物体内叶绿素含量降低,影响植物光合潜力[4],而且会产生大量活性氧和有害物质[5]。植物为了抵抗恶劣逆境,自身能够通过抗氧化保护酶系统和渗透调节系统平衡细胞内有害物质[6],表现出对胁迫逆境的适应对策[7]。因此,植物体内生理指标的动态变化可以评价植物抗旱能力。崔豫川等[8]通过设置不同水分胁迫梯度,研究干旱胁迫和复水对栓皮栎Quercus variabilis幼苗生长和生理特性的影响,阐明了栓皮栎幼苗对干旱胁迫的生长和生理响应机制,得出栓皮栎幼苗具有较强抗旱性。唐洪辉等[9]采用人工模拟土壤干旱的方法研究宫粉羊蹄甲Bauhinia variegata生理指标的变化,并通过模糊隶属函数法分析了20个家系的抗旱性。张彦妮等[10]以盆栽黄莲花Lysimachia davurica幼苗为材料探究干旱胁迫对其生长和生理特性的影响,指出随着干旱胁迫时间的增加,黄莲花的生长发育逐渐受到抑制。
七叶树Aesculus chinensis属于季相彩叶树种,是观叶、观花、观果不可多得的观赏性树木[11],因此七叶树具有极其广阔的园林绿化发展潜力。由于该树种尤其在北方地区严重缺乏,引发了众多科研工作者对七叶树栽培方面的研究。尽管相关学者对七叶树的研究多集中于引种栽培[12]、药用成分[13-14]、种子催芽[15]、抗寒性[16-18]等方面,而抗旱生理方面的研究还尚未见报道。干旱不仅影响七叶树育苗,也对七叶树绿期花期等观赏性造成影响。针对七叶树幼苗扩大栽培需求中存在的抗旱问题开展本研究,以1年生七叶树移栽播种苗为材料进行水分胁迫和复水试验,通过分析其在水分胁迫下生理特性指标的变化特征,评价七叶树幼苗的抗旱性强弱,为七叶树扩大适生区域、节水灌溉育苗提供理论和实践依据,同时也为七叶树在园林绿化中推广应用奠定基础。
1 材料与方法
1.1 试验材料及处理
2016年3月将引种自陕西汉中的1年生七叶树优良播种苗,盆栽于高40 cm、上口直径35 cm、下口直径28 cm的花盆中,花盆中盛装pH值为5.60,以草炭土和珍珠岩3∶1混合的栽培基质。每盆装土量为6.00±0.10 kg。
1.2 试验地概况
七叶树盆栽播种苗种植于北京市大东流苗圃(40°09′40.88″N,116°27′43.17″E)大棚温室内。大棚温室两侧通风,作用仅为挡雨。试验期间棚内日/夜均温为31 ℃/16 ℃,相对湿度42%~88%。
1.3 试验设计
试验采用完全随机区组设计,利用称重法辅以土壤水分速测仪(TDR-3,USA)控制土壤含水量下限,设置5个水分胁迫处理水平:田间持水量的90%(CK)、75%(T1)、60%(T2)、45%(T3)及 30%(T4),5盆为一个小区,重复4次。每个处理设置4个没有栽植苗木的花盆作为空白对照,用来计算土壤表面水分蒸发量。
2016年5月到6月分阶段对七叶树幼苗随机挑选15株测量其苗高H(cm)、地径D(mm)以及鲜质量G(g),建立1年生七叶树幼苗鲜质量与生长的关系:G=-439.140+24.672D+6.146H,R2=0.86,试验期间每周通过该方程所得鲜质量,校正因苗木自身质量增加对浇水量的影响[19-20]。处理开始前10 d停止浇水,并测定七叶树幼苗单株生理指标,选择各项指标之间无显著差异幼苗进行水分处理实验。于2016年7月1日进行严格控水并测定初始生物量,平均苗高(57.78±5.50)cm,平均地径(16.00±1.08)mm,所有花盆表面均覆盖2~3 cm石英砂以减少水分蒸发,每2 d浇1次水,浇水时间为16:00—18:00。持续水分处理后立即对相应试验材料进行复水,复水时浇透水直至盆底有水渗出。
1.4 测定指标与方法
于水分胁迫处理第0、15、30、45、60天和复水后第7天采集各处理叶片测定生理生化指标,每个指标重复3次。其中过氧化氢酶(CAT)活性采用分光光度计法,以每克鲜质量1 min内吸光度值减少0.1为1个酶活性单位;过氧化物酶(POD)活性采用愈创木酚法,以每克鲜质量1 min内吸光度值变化0.001为1个酶活性单位;超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法,以每分钟每克鲜质量样品对NBT光还原的抑制为50%时为一个酶活性单位;叶绿素总含量采用丙酮浸提法;相对电导率采用电导仪法[21];丙二醛(MDA)含量采用Adriano[22]的硫代巴比妥酸显色法测定;脯氨酸含量采用酸性茚三酮法测定;可溶性糖含量采用蒽酮比色法测定;可溶性蛋白含量采用考马斯亮蓝染色法测定[23]。
1.5 数据处理
采用Microsoft Excel 2016进行计算和图表绘制,R语言(R i386 3.4.0)软件拟合模型方程并进行统计分析,其中相对电导率通过反正弦转换进行方差分析,显著性采用方差分析进行检验(P<0.05),多重比较采用邓肯氏 (Duncan) 新复极差测验法。
2 结果与分析
2.1 水分胁迫对保护酶活性的影响
由表1可知,七叶树幼苗保护酶活性对水分胁迫的响应存在显著差异(P<0.05),其中CAT活性总体趋势为先上升后下降(图1 A)。胁迫初期(第15天),5种水分胁迫处理下CAT活性均上升,其中T4上升最快。胁迫处理第45天时,除T4外,其他处理均上升,此时达到CAT活性旺盛时期。胁迫处理第60天,5个处理酶活性迅速下降,T4与对照无显著差异,但T1、T2和T3仍显著高于对照。复水试验7 d后,CAT活性均有恢复,其中T3恢复能力最强,T4恢复能力最弱。
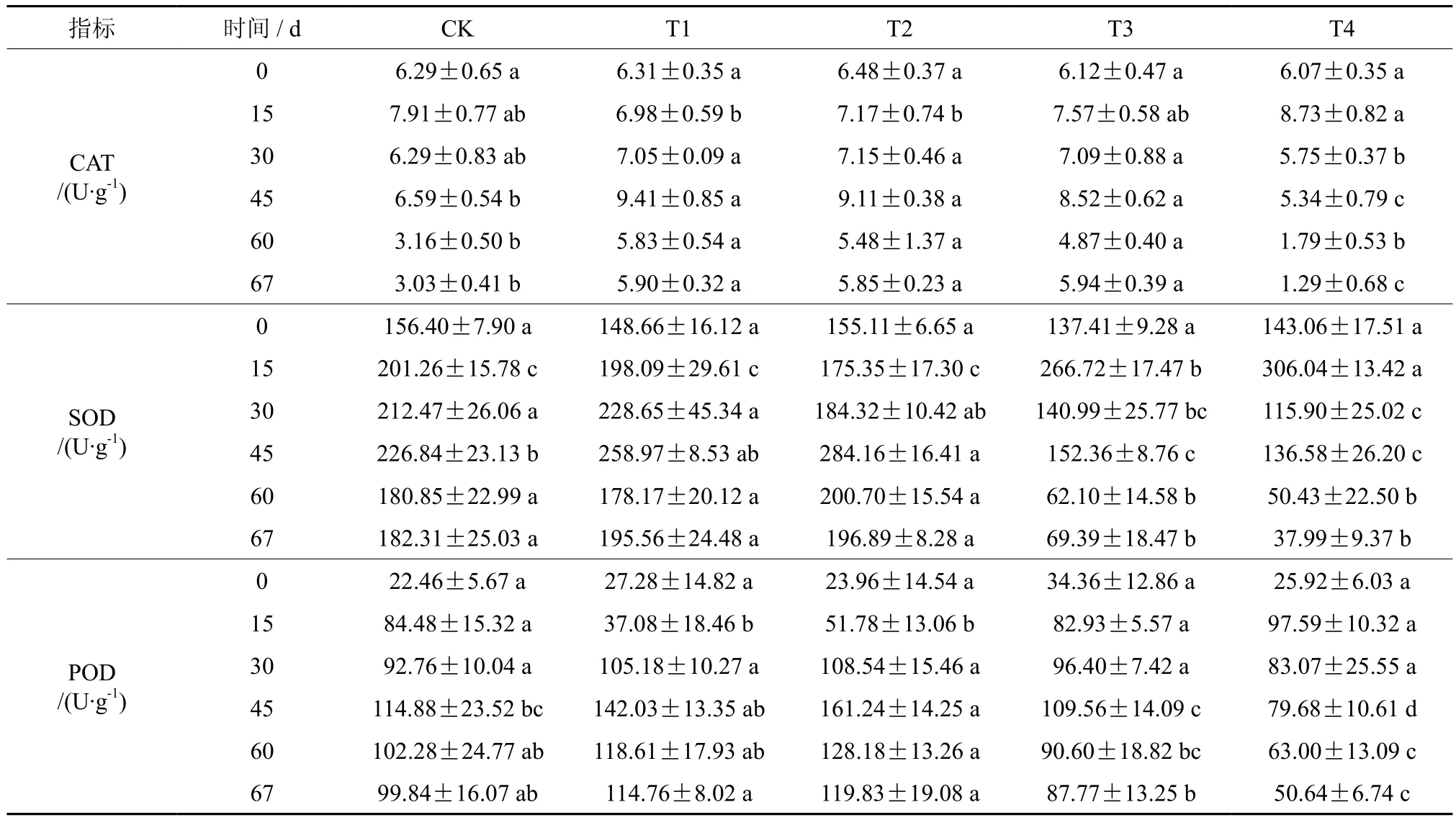
表1 七叶树幼苗在水分胁迫下的CAT、SOD、POD活性†Table 1 Effects of different treatments on catalase activity, peroxidase activity, superoxide dismutase activity of Aesculus chinensis seedlings
SOD活性变化趋势与CAT变化趋势相似(图1 B),与对照相比,七叶树幼苗在T3下CAT活性虽然升高,但SOD活性低于对照。复水7 d后,T1、T3叶片SOD活性有较强恢复能力,T4恢复能力较弱。
不同处理下POD活性同样表现为先上升后下降的趋势(图1 C),这与CAT和SOD活性变化趋势一致。处理初期(第15 d),POD活性随着水分胁迫程度的加深先下降后上升,T1和T2显著降低于对照,T3和T4与对照无显著差异。处理第60天,T1、T2和T3与对照无显著差异,T4显著低于对照。复水7 d时,T1、T2和T3与对照差异不显著,T4仍显著低于对照。
2.2 水分胁迫对叶绿素总含量、电导率和丙二醛含量的影响
如表2所示,不同水分胁迫下叶绿素总含量存在显著差异(P<0.05),叶绿素总含量随胁迫时间的延续先上升后下降(图2 A)。水分处理第15天和30天,T4与对照无显著差异,T1、T2和T3比对照有所增加。试验末期(60 d)因进入生长季末,叶绿素总含量开始下降。复水试验7 d后,T1、T2和T3叶绿素总含量均能有所恢复,较60 d有所回升,但T4和对照叶绿素总含量持续下降,恢复能力较弱。
电导率变化较总叶绿素含量变化更为复杂,整个试验期间呈现双峰曲线(图2 B)。胁迫初期(第15天),不同处理下电导率存在显著差异。胁迫处理第60天,T3和T4显著高于对照,T2显著低于对照,T1与对照差异不显著。复水7 d后,5种处理电导率均得到恢复,其中T1和T2均能恢复到对照水平,T3和T4恢复能力相对较弱。
在整个生长季中,MDA含量逐渐增加(图2 C)。胁迫处理30 d内,T4下MDA含量迅速增加。胁迫处理30 d后,MDA含量增加速度降低。复水后第7天,MDA含量均有所下降。
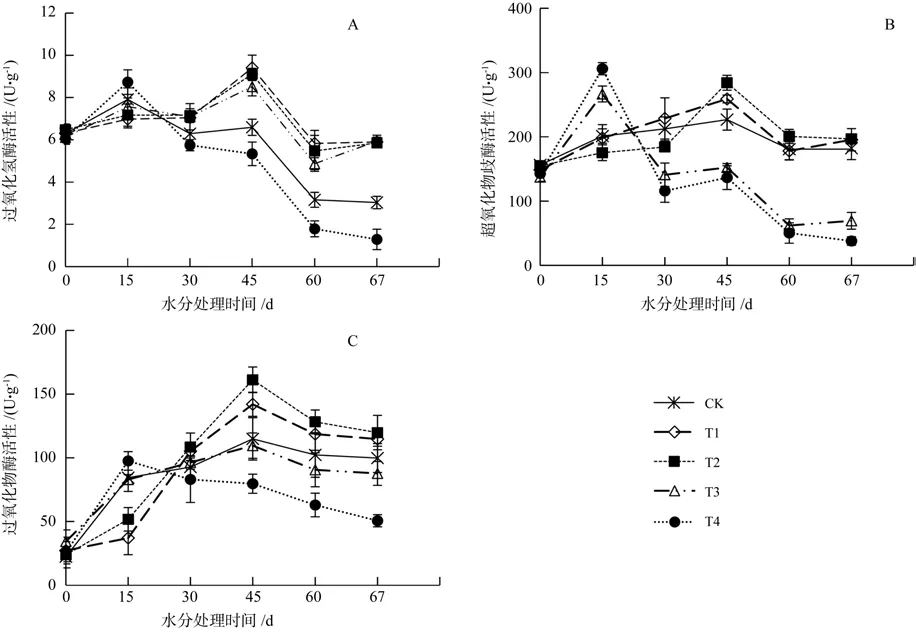
图1 水分胁迫下过氧化氢酶(A)、超氧化物歧化酶(B)、过氧化物酶(C)活性变化Fig.1 Changes in catalase activity(A), peroxidase activity (B), superoxide dismutase activity(C) of Aesculus chinensis seedlings under water stress
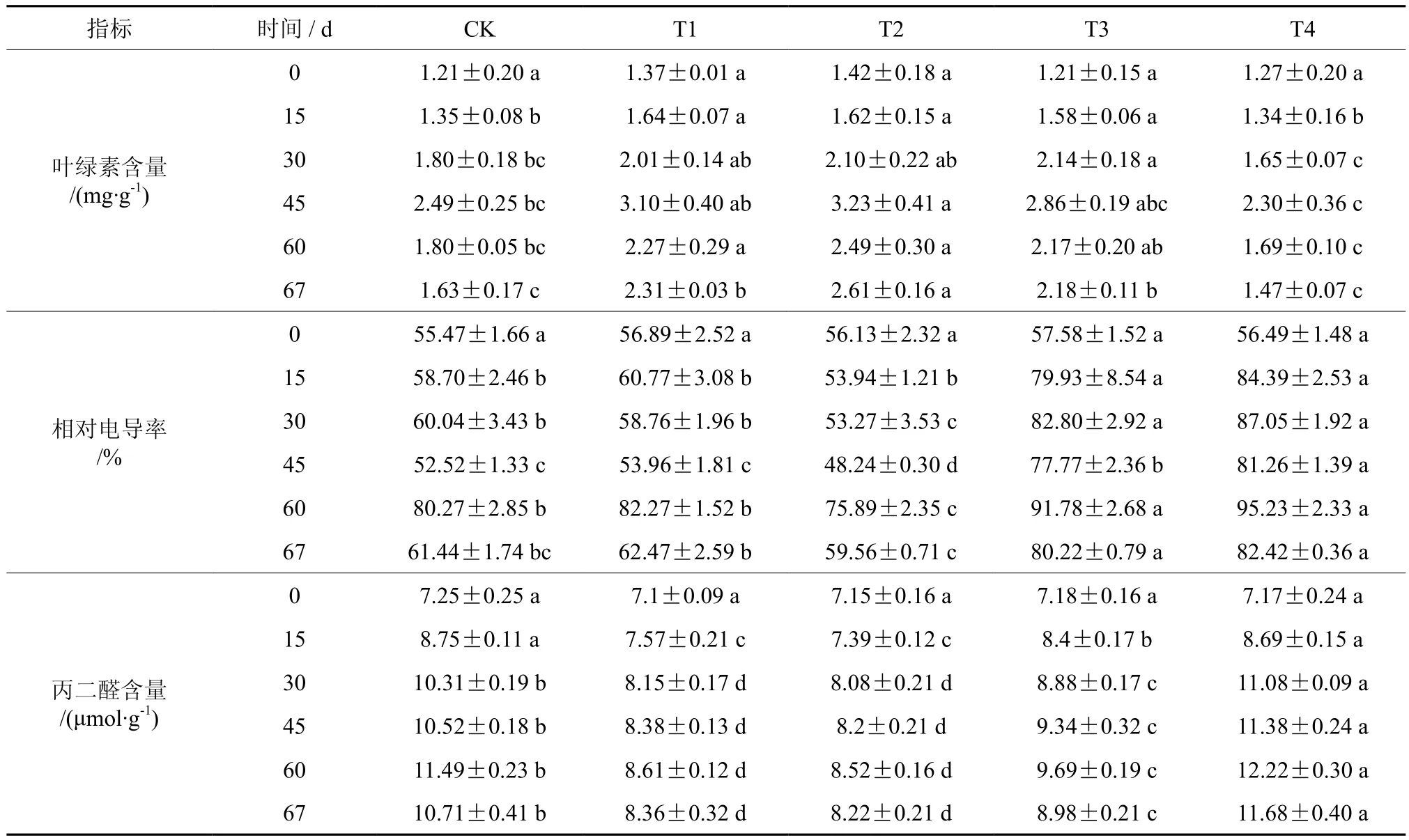
表2 七叶树幼苗在水分胁迫下的叶绿素总含量、相对电导率、丙二醛含量†Table 2 Effects of different treatments on chlorophyll content, relative conductivity, malondialdehyde content of Aesculus chinensis seedlings
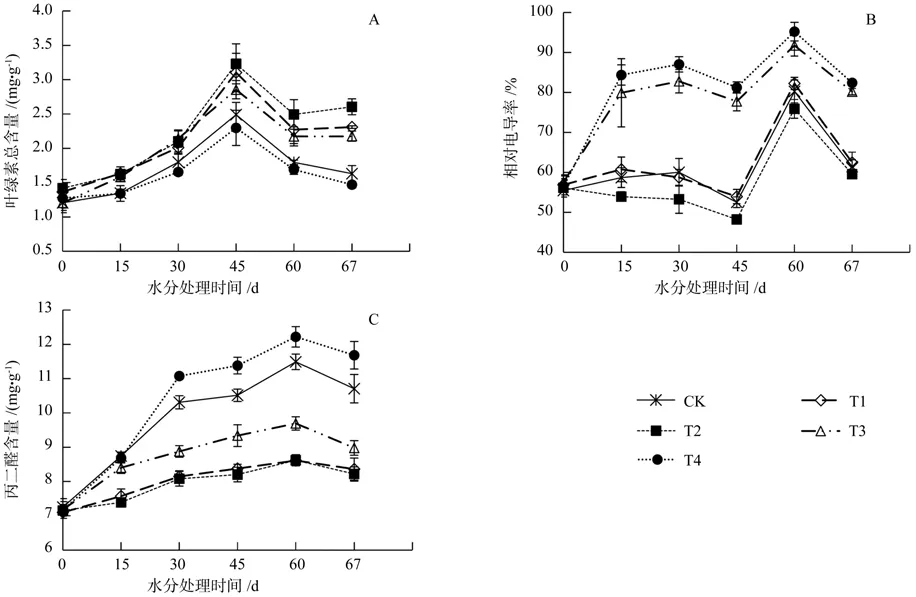
图2 水分胁迫下叶绿素总含量(A)、相对电导率(B)、丙二醛(C)含量变化Fig.2 Changes in chlorophyll content(A), relative conductivity(B), malondialdehyde content(C) of Aesculus chinensis seedlings under water stress
2.3 水分胁迫对渗透调节物质的影响
水分胁迫下七叶树幼苗脯氨酸含量先上升后下降(图3 A)。脯氨酸含量在水分胁迫第15天和30 d缓慢增加,T3和T4脯氨酸含量均显著高于对照(P<0.05),而T1和T2与对照无显著差异。水分胁迫处理第60天,脯氨酸含量有所下降,其中T1、T2与对照无显著差异,T3、T4显著高于对照。复水7 d后,不同处理下的脯氨酸含量呈现出与复水前相反的变化趋势,其中T1、T2与对照差异不显著,而处理T3和T4无法恢复到对照水平。
在整个生长季中,T1和T2下可溶性蛋白含量基本保持不变,T3、T4和对照可溶性糖含量逐渐增加(图3 B)。处理第15天,可溶性蛋白含量缓慢增加,T2显著高于对照,其他处理与对照均无显著差异,随着水分胁迫程度的加深可溶性蛋白含量先升高后降低。处理第30天,T4显著高于对照,其他处理与对照差异不显著,此时随着水分胁迫程度的加剧可溶性蛋白含量先降低后升高。处理第60天时,T1、T2下可溶性蛋白含量显著低于对照,T3、T4显著高于对照。复水7 d后,可溶性蛋白含量均有所下降,T3与对照无显著差异,T1、T2显著低于对照,T4显著高于对照。
可溶性糖含量与脯氨酸含量变化相一致,整个生长季中,可溶性糖含量均表现为上升(图3 C)。短期胁迫下,不同处理间可溶性糖含量差异不显著,当处理时间达到30 d时,不同处理下可溶性糖含量存在显著差异。在60 d时T3和T4处理可溶性糖含量积累速度减缓,对照增长幅度高于其他处理。复水7 d后,胁迫处理下可溶性糖含量均有所恢复,T1、T2与对照无显著差异,可以恢复到对照水平,而T3、T4与对照差异显著,在这两种处理下复水后可溶性糖含量恢复较弱。
3 结论与讨论
过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)是植物体内重要的抗氧化酶,它们之间相互协调维持植物防御体系的平衡,抗氧化酶活性能够衡量植物对有害物质的清除能力[24]。SOD主要清除植物受迫害时产生的超氧阴离子(O2-·),生成H2O2,CAT与 POD协同作用清除植物体内过多的H2O2,维持细胞膜结构稳定[25]。有学者研究了冰草[26]、桢楠[27]、玉米[28]等干旱胁迫下生理指标变化,均发现CAT、POD和SOD活性在长期干旱胁迫下显著降低。本实验中也表现出类似的规律:短期水分胁迫下,3种酶活性均随着胁迫程度的增加而升高;长期水分胁迫下,3种酶活性随胁迫程度的增加而下降。
3种保护酶活性总体趋势一致,但最高值出现在不同时期不同处理上,这表明七叶树幼苗受到不同水分胁迫伤害后细胞膜系统存在差异,是一种复杂的综合作用,同时也表明细胞清除有害物质的能力受多因素影响。水分胁迫前期,七叶树幼苗通过提高3种保护酶活性清除细胞内活性氧,随着胁迫时间的延长,超出了七叶树幼苗的耐受限度,保护酶活性迅速下降;复水后不同处理下保护酶活性均有所恢复,但田间持水量的30%处理恢复能力较弱。
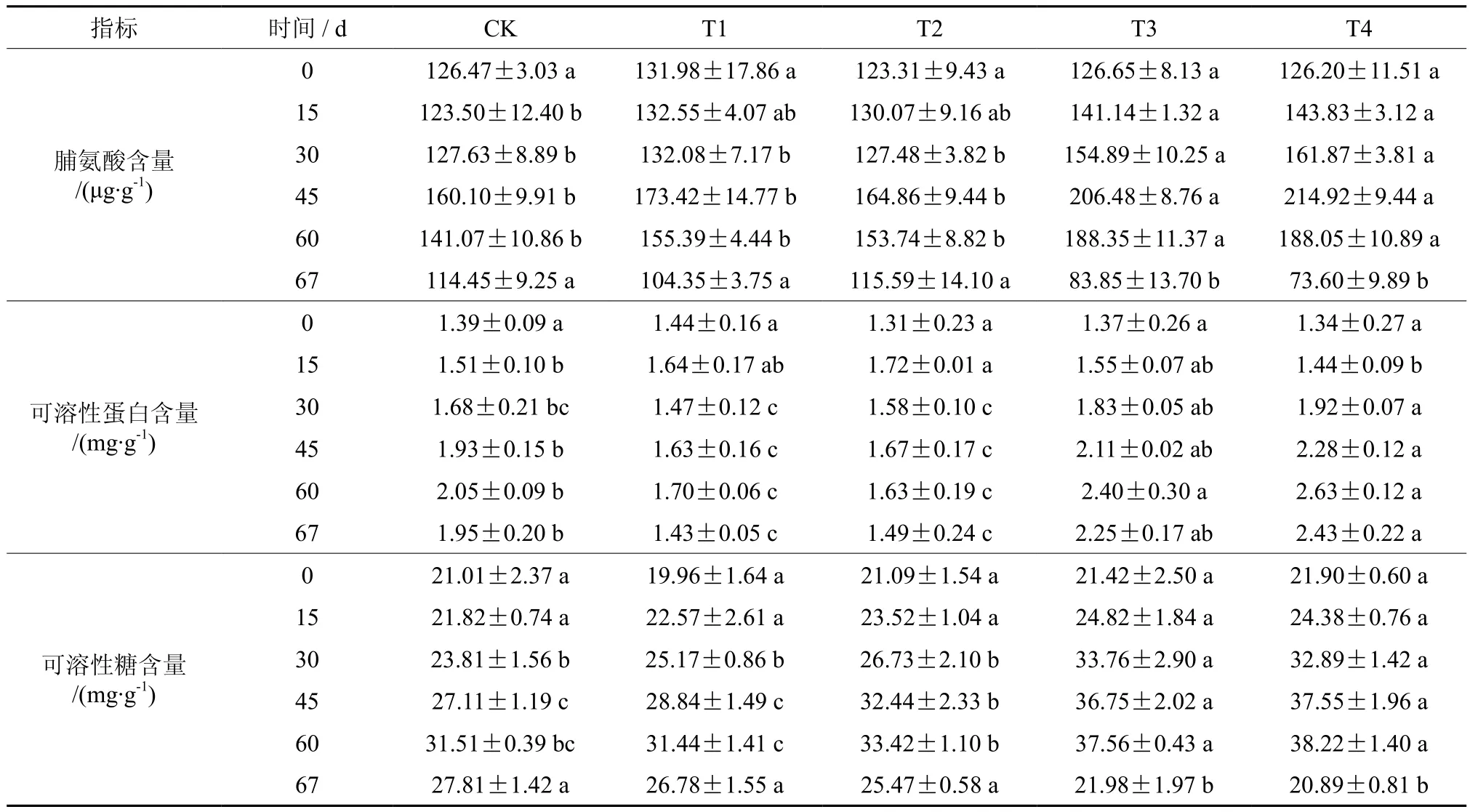
表3 七叶树幼苗在水分胁迫下的脯氨酸、可溶性蛋白、可溶性糖含量†Table 3 Effects of different treatments on proline content, soluble sugar content and soluble protein content of Aesculus chinensis seedlings
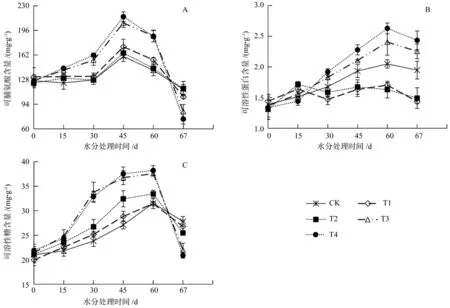
图3 水分胁迫下脯氨酸含量(A)、可溶性蛋白含量(B)和可溶性糖含量(C)的变化Fig.3 Changes in proline content (A), soluble sugar content (B) and soluble protein content (C) of Aesculus chinensis seedlings under water stress
叶绿素作为植物必要的光合色素,其含量的高低可以反应植物潜在光合能力大小[7]。植物受到持续水分胁迫时,叶绿素总含量降低,且叶绿素含量随着胁迫程度的加深而减少[29],本实验中除田间持水量的90%处理外,其他处理结果与该结论相一致,田间持水量的90%处理下有所不同可能是因为土壤含水量过高造成水涝胁迫,水涝胁迫下叶片中Mg2+离子的合成受阻,而该离子是叶绿素组成元素之一,因此导致叶绿素含量下降[30],过高或过低的土壤含水量均会导致叶绿素含量的降低。随着水分胁迫时间延长,叶绿素含量达到峰值,表现出较高的潜在光合能力,这是因为此时正值植物生长旺盛时期,七叶树幼苗可以通过提高叶绿素含量维持其较高的光合能力[31],表现出较强抗旱能力。
丙二醛(MDA)是膜脂过氧化作用的产物,可使细胞膜上蛋白质、酶等失活,其作为细胞有害物质同样是鉴定细胞膜系统受害的重要指标[4]。本研究中,短期水分胁迫下,较田间持水量的60%处理,MDA含量均有所增加,这是因为干旱和水涝胁迫下都影响了七叶树幼苗细胞膜透性。有学者发现,MDA含量与保护酶系统存在一定相关性[5,32],这在本实验研究中也有体现:水分胁迫15 d时MDA含量升高较慢,此时3种保护酶活性高,它们之间协同作用抑制了MDA产生。胁迫处理30 d时3种酶活性开始下降,MDA含量迅速增加,长期水分胁迫下,MDA含量较之前升高变缓,是七叶树幼苗适应逆境的表现。植物受到水分胁迫时,植物细胞膜系统最先有所表现,细胞受害时电解质含量增加,所以其外渗电导率增加,且细胞膜透性在植物受害严重时呈增加的趋势[33-34],电导率可以反应细胞膜受迫害的程度[24]。一般认为,逆境胁迫会造成植物相对电导率升高,表明植物受到迫害[35]。本实验中,除田间持水量的60%外,随着水分胁迫程度的增加,细胞膜透性越大,对比田间持水量的60%处理下,相对电导率均表现出受到伤害,这与刘承等[36]对玉米的水分胁迫研究结果相一致。
游离脯氨酸、可溶性糖、可溶性蛋白均属于植物体内重要的渗透调节物质,当受到水分胁迫时,植物通过积累渗透调节物质来防止水分过度缺乏,维持细胞膜的完整性,降低渗透势,从而提高细胞膜渗透调节能力,保持细胞膨压稳定[37-38]。本实验结果表明,七叶树幼苗在受到短期水分胁迫时,可以通过增加脯氨酸和可溶性蛋白含量提高抗旱能力,但可溶性蛋白糖含量无显著变化,说明可溶性糖对短期水分胁迫不敏感。长期水分胁迫下,脯氨酸和可溶性糖含量均随胁迫程度的加深而升高,可溶性蛋白含量随胁迫程度加剧先下降后上升。胁迫初期可溶性蛋白含量降低可能是因为酶活性较高,加速了蛋白酶水解,同时干旱胁迫抑制RNA的转录和翻译,从而使蛋白质合成减少[32]。田间持水量的30%和45%在复水后渗透调节物质含量均表现出与对照相比相对较弱的恢复能力,但试验期间成活率均达到100%,表明七叶树幼苗具有较强的抗旱性。
综上所述,短期水分胁迫下,七叶树幼苗可以通过通过积累可溶性蛋白、脯氨酸和可溶性糖等渗透调节物质以及维持较高的CAT、SOD、POD活性表现出抗旱性;长期水分胁迫下,七叶树幼苗各生理指标急剧变化,受迫害加重,但在长期胁迫后进行复水试验,各项指标均有恢复能力,其中田间持水量的60%和75%总体恢复能力较强;在实验设置的水分梯度内,七叶树幼苗表现出较强抗旱性,七叶树可以作为干旱地区园林绿化树种。
由于植物抗旱性是复合性状,体现在生长性状、生理特征、光合特性、解剖结构特征、分子基因表达等方面的变化[33],本试验重点关注七叶树幼苗生理指标对抗旱性的响应,可能存在一定局限性。水分胁迫和复水对七叶树幼苗其他方面的指标影响有待进一步研究,可通过综合不同方面的指标阐明七叶树抗旱性调控机理。
参考文献:
[1]黄威龙,李 洁,薛 立,等. 4种绿化幼苗对干旱胁迫的生理响应[J]. 中南林业科技大学学报, 2016, 36(7): 36-40.
[2]Cramer G R, Urano K, Delrot S,et al.Effects of Abiotic Stress on Plants: a Systems Biology Perspective[J]. Bmc Plant Biology,2011, 11(1): 163.
[3]武燕奇,郭素娟. 5个板栗品种(系)对持续干旱胁迫和复水的生理响应[J]. 中南林业科技大学学报, 2017, 37(10): 67-74.
[4]喻晓丽,邸雪颖,宋丽萍. 水分胁迫对火炬树幼苗生长和生理特性的影响[J]. 林业科学, 2007, 51(11): 57-61.
[5]王宇超,王得祥,彭少兵,等. 干旱胁迫对木本滨藜生理特性的影响[J]. 林业科学, 2010, 46(1): 61-67.
[6]Munne-bosch S. Drought-induced Changes in the Redox State of Alpha -tocopherol, Ascorbate, and the Diterpene Carnosic Acid in Chloroplasts of Labiatae Species Differing in Carnosic Acid Contents[J]. Plant Physiology, 2003, 131(4): 1816-1825.
[7]冯慧芳,薛 立,任向荣,等. 4种阔叶幼苗对PEG模拟干旱的生理响应[J]. 生态学报, 2011, 31(2): 371-382.
[8]崔豫川,张文辉,李志萍. 干旱和复水对栓皮栎幼苗生长和生理特性的影响[J]. 林业科学, 2014, 50(7): 66-73.
[9]唐洪辉,魏 丹,赵 庆,等. 干旱胁迫对宫粉羊蹄甲生理指标的影响[J]. 中南林业科技大学学报, 2017, 37(4): 7-13.
[10]张彦妮,雷 蕾,夏 斌. 干旱胁迫及复水对黄连花幼苗生长和生理特性的影响[J]. 草业科学, 2016, 33(9): 1681-1689.
[11]李鹏丽,时明芝,王绍文. 珍稀观赏树种七叶树的研究现状与展望[J]. 北方园艺, 2009, 9(9): 115-118.
[12]周志春,金国庆,张均民,等. 北美产七叶树引种栽培技术研究[J]. 林业科学研究, 2007, 20(1): 29-34.
[13]石召华. 七叶树属植物资源及品质研究[D]. 武汉: 湖北中医药大学, 2013.
[14]魏书香,王 桐,丁丽琴,等. 浙江七叶树种子的化学成分研究[J]. 中草药, 2017, 48(15): 3026-3031.
[15]居 萍,李良俊. 七叶树种子层积过程中生理生化的研究[J].种子, 2015, 34(12): 15-20.
[16]杜 艳. 七叶树种子耐脱水性和苗木抗寒性研究[D]. 南京:南京林业大学, 2004.
[17]缴丽莉,翟士勇. 七叶树与马褂木抗寒性比较分析[J]. 安徽农业科学, 2013, 41(25): 10323-10324.
[18]杜 艳,喻方圆,甘习华,等. 低温胁迫下两种七叶树苗木超微结构的比较[J]. 南京林业大学学报(自然科学版), 2007,31(3): 111-114.
[19]Yin C Y, Wang X, Duan B L,et al.Early Growth, Dry Matter Allocation and Water Use Ef ficiency of Two Sympatric Populus Species as Affected By Water Stress[J]. Environmental and Experimental Botany, 2005, 53(3): 315-322.
[20]Li C Y, Yin C Y, Liu S R. Different responses of two contrasting Populus davidiana populations to exogenous abscisic acid application[J]. Environmental and Experimental Botany, 2004,51(3): 237-246.
[21]高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社,2006.
[22]Sofo A, Dichio B, Xiloyannis C,et al.Effects of Different Irradiance Levels on Some Antioxidant Enzymes and on Malondialdehyde Content During Rewatering in Olive Tree[J].Plant Science, 2004, 166(2): 293-302.
[23]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 134-200.
[24]丁 龙,赵慧敏,曾文静,等. 五种西北旱区植物对干旱胁迫的生理响应[J]. 应用生态学报, 2017, 28(5): 1455-1463.
[25]Helena C. Drought Stress and Reactive Oxygen Species:Production, Scavenging and Signaling[J]. Plant Signaling &Behavior, 2008, 3(3): 65-156.
[26]高 悦,朱永铸,杨志民,等. 干旱胁迫和复水对冰草相关抗性生理指标的影响[J]. 草地学报, 2012, 20(2): 336-341.
[27]王 彬. 干旱胁迫及复水对桢楠幼树生长和生理特性的影响[D]. 雅安: 四川农业大学, 2015.
[28]曹 丹. 不同抗性玉米品种苗期干旱及复水过程中的生理响应[D]. 北京:中国科学院研究生院(教育部水土保持与生态环境研究中心), 2015.
[29]Huang B,Duncan R R,Carrow R N. Drought-Resistance Mechanisms of Seven Warm-Season Turfgrasses under Surface Soil Drying: I. Shoot Response[J]. Crop Science, 1997, 37(6):1858.
[30]Cornish K, Radin J W, Turcotte E L,et al. Enhanced Photosynthesis and Stomatal Conductance of Pima Cotton(gossypium Barbadense L.) Bred for Increased Yield[J]. Plant Physiology, 1991, 97(2): 484-489.
[31]翁亚伟,张 磊,张 姗,等. 盐旱复合胁迫对小麦幼苗生长和水分吸收的影响[J]. 生态学报, 2017, 37(7): 2244-2252.
[32]谢志玉,张文辉,刘新成. 干旱胁迫对文冠果幼苗生长和生理生化特征的影响[J]. 西北植物学报, 2010, 30(5): 948-954.
[33]张静静. 樟属植物种子萌发特性及苗期抗旱性研究[D]. 郑州:河南农业大学, 2012.
[34]Meng D, Fricke W. Changes in Root Hydraulic Conductivity Facilitate the Overall Hydraulic Response of Rice (Oryza SativaL.) Cultivars to Salt and Osmotic Stress[J]. Plant Physiology and Biochemistry, 2017(113): 64-77.
[35]崔豫川,张文辉,李志萍. 干旱和复水对栓皮栎幼苗生长和生理特性的影响[J]. 林业科学, 2014, 50(7): 66-73.
[36]刘 承,李佐同,杨克军,等. 水分胁迫及复水对不同耐旱性玉米生理特性的影响[J]. 植物生理学报, 2015,51(5):702-708.
[37]桑子阳,马履一,陈发菊. 干旱胁迫对红花玉兰幼苗生长和生理特性的影响[J]. 西北植物学报, 2011, 31(1): 109-115.
[38]刘景辉,赵海超,任永峰,等. 土壤水分胁迫对燕麦叶片渗透调节物质含量的影响[J]. 西北植物学报, 2009, 29(7): 1432-1436.

