筛选化学过敏原的直接肽反应试验的建立
胡培丽,刘师卜,张会亮,李 波,王钢力*
(中国食品药品检定研究院,北京 100050)
大多数化学过敏原(或其代谢物)属于亲电子剂,而蛋白质侧链氨基酸富含电子组,为亲核剂,因此能与亲电过敏原反应。赖氨酸和半胱氨酸是最常被利用的,其他含亲核杂原子的氨基酸,如组氨酸、蛋氨酸和酪氨酸等也可与亲电过敏原反应[1]。亲电过敏原通过与宿主亲核蛋白中的氨基酸形成非常稳定的共价键(抗原蛋白复合物),从而引发皮肤过敏反应。
由于蛋白质反应是诱导皮肤过敏的一个关键环节,所以有假设通过这种反应来筛选化学物的致敏能力[2-5]。 Gerberick等[5-6]建立了直接肽反应试验(the direct peptide reactivity assay,DPRA),通过研究肽反应动力学,监测肽的损耗来评价化学物的致敏性。该方法现已经欧洲替代试验验证中心(European Centre for the Validation of Alternative Methods,ECVAM)验证,作为皮肤致敏替代试验的推荐方法,OECD于2015年公布了DPRA试验指南(TG 442C)[7]。目前国内一些实验室也正在积极开展该方法研究[8-10],不久该方法有望纳入化妆品安全技术规范。本研究通过赖氨酸/半胱氨酸肽对20种不同致敏级别化学物的致敏能力进行评估,从而在本实验室建立了该方法,同时对目前市场上化妆品中较易残留或添加的2种风险化学物氯仿、苯进行皮肤致敏性评估。
1 材料与方法
1.1 受试物
邻氨基苯酚、丁子香酚、反式肉桂醛、水杨酸、α-己基肉桂醛、对苯二酚、3-甲基邻苯二酚、香叶醇、水杨酸己酯、2-巯基苯并噻唑、十二烷基硫酸钠、异丁香酚、乙二胺与水杨酸甲酯购自Sigma公司;丙二醇、异丙醇、正己烷、氯仿与苯购自国药集团化学试剂有限公司;2,4-二硝基氯苯购自中国医药总公司北京分公司。
1.2 试剂和仪器
赖氨酸肽(Ac-RFAAKAA-COOH)、半胱氨酸肽(Ac-RFAACAA-COOH)由吉尔生化(上海)有限公司合成,纯度≥98%。醋酸铵、氨水、磷酸二氢钠、磷酸氢二钠、三氟乙酸为分析纯,购自Sigma公司。乙腈为色谱纯,购自赛默飞世尔科技有限公司,高效液相色谱为Waters e2695 Alliance。
1.3 方法
1.3.1受试物与肽反应体系[5-7]受试物用乙腈配制成100 mmol/L,赖氨酸/半胱氨酸肽分别用100 mmol/L乙酸铵缓冲液(pH=10.2)/磷酸缓冲液(pH=7.5)配制成1.25 mmol/L肽储备液。每个受试物测试3份平行样,其中含0.5 mmol/L肽(400 μL)、5或25 mmol/L受试物(50或250 μL)及缓冲液(350 μL)。肽/受试物比例为1∶10(半胱氨酸)或1:50(赖氨酸),1∶10比例反应样本中需另加200 μL乙腈;同时设置空白对照(400 μL肽储备液、350 μL缓冲液和250 μL乙腈)和共洗脱对照(赖氨酸肽:750 μL乙酸铵缓冲液和250 μL受试物;半胱氨酸肽:750 μL磷酸缓冲液、50 μL受试物和200 μL乙腈)。每个样本管密封、混匀、室温反应24 h,经0.22 μm微孔滤膜过滤后进行高效液相色谱检测分析。
1.3.2标准曲线绘制[6]用25%乙腈乙酸铵/磷酸缓冲液分别配制赖氨酸/半胱氨酸肽系列标准溶液,浓度为0.015 6、0.031 3、0.062 5、0.125、0.25、0.50、1.0 mmol/L,过滤后进行高效液相色谱检测,用系统EmpowerTM3软件绘制标准曲线。
1.3.3检测系统及条件[6-7]高效液相色谱检测系统由Waters Alliance e2695和Waters 2489 紫外/可见光检测器组成。色谱柱:Agilent Zorbax SB-C18 4.6 mm×250 mm×5 μm;柱温30 ℃;流动相A:0.1%三氟乙酸水溶液;流动相B:0.085%三氟乙酸乙腈溶液;流速0.3 mL/min;进样量10 μL。梯度洗脱条件为:90%(A) 到60%(A),25 min,流速0.8 mL/min。二极管阵列探测器扫描波长210~400 nm,色谱图检测波长是220 nm。
1.3.4受试物与两种肽反应时间优化 为了解化学物与两种肽反应动力学过程,即不同时间点肽损耗,从而确定试验反应最佳时间,我们测定了5种不同致敏级别受试物与两种肽分别反应5、15、30 h 时的肽损耗。
1.4 数据处理
用EmpowerTM3软件分析反应前后的峰面积,计算肽的损耗率,≥10%则认为受试物与肽有反应[5]。损耗率=[1-(肽与受试物反应的峰面积均值/空白对照的肽峰面积均值)]×100。
1.5 预测模型[7]
若受试物与赖氨酸/半胱氨酸肽均不发生共洗脱,则用两种肽损耗率的均值判断,0%≤均值≤6.38%,微反应,为致敏阴性;6.38%<均值≤22.62%、22.62%<均值≤42.47%、42.47%<均值≤100%,均为致敏阳性,反应级别依次为低、中、高。当受试物与赖氨酸肽发生共洗脱,则用半胱氨酸肽损耗率判断,0%≤均值≤13.89%,微反应,为致敏阴性;13.89% <均值≤23.09%、 23.09%<均 值 ≤ 98.24%、 98.24%<均 值 ≤100%, 均为致敏阳性,反应级别依次为低、中、高。当受试物与赖氨酸/半胱氨酸肽均发生共洗脱,则该方法不适用判定受试物致敏性。
1.6 预测能力评价
根据赖氨酸/半胱氨酸肽与18种已知致敏性化学物反应损耗确定两种肽的灵敏度、特异性、阳性预测率、阴性预测率和准确度,从而综合评价两种肽的预测能力。
2 结果
2.1 受试物与两种肽反应时间的优化
5种受试物分别与赖氨酸/半胱氨酸肽反应5、15、30 h,结果表明:2,4-二硝基氯苯、丁子香酚、水杨酸和邻苯氨基苯酚均随着时间增加肽损耗率也相应增加;反式肉桂醛与半胱氨酸肽反应肽损耗率较为稳定,而与赖氨酸肽反应随时间增加肽损耗率递减,但反应15~30 h时间段肽损耗率递减缓慢,趋于稳定。鉴于Gerberick等[5-6]有关报道和OECD指南中推荐受试物与肽反应时间分别为24 h和(24±2) h,所以我们后续试验各受试物与肽反应时间均为24~28 h。
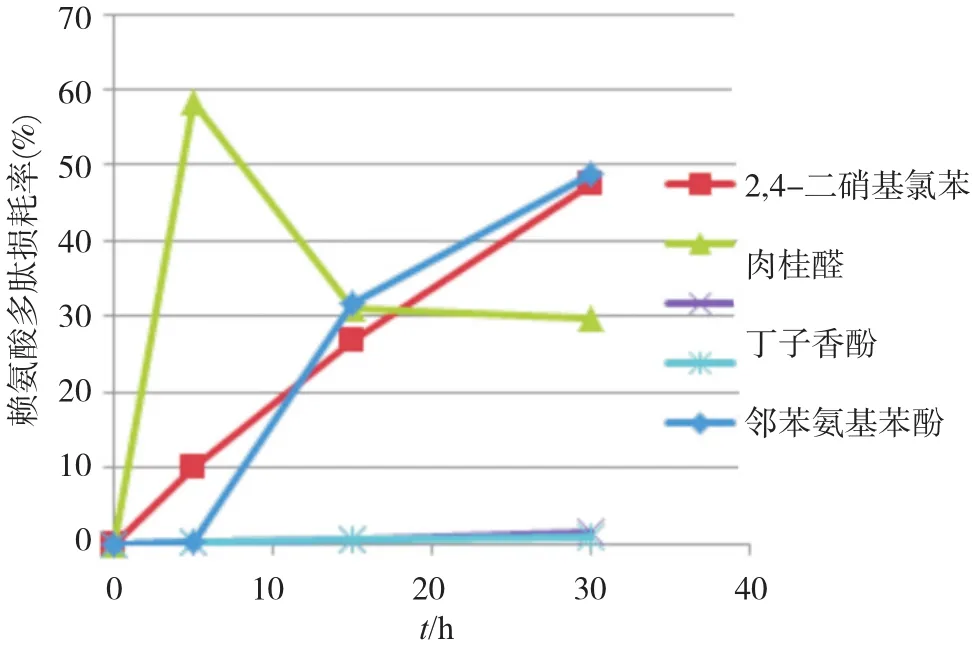
图1 赖氨酸肽与不同受试物反应动力学图
2.2 20种受试物与两种肽反应结果

图2 半胱氨酸肽与不同受试物反应动力学图
高效液相色谱检测结果显示20种受试物均未与半胱氨酸/赖氨酸肽发生共洗脱,选用两种肽损耗率均值判断受试物致敏性及其反应活性级别(表1),两种肽对受试物致敏性的预测结果见表2。

表1 20种受试物与半胱氨酸/赖氨酸肽反应活性(肽损耗率,%)

半胱氨酸肽 赖氨酸肽 半胱氨酸/赖氨酸肽灵敏度 100.00% 33.30% 100.00%特异性 100.00% 100.00% 100.00%阳性预测率 100.00% 100.00% 100.00%阴性预测率 100.00% 42.90% 100.00%准确度 100.00% 55.60% 100.00%
2.2.1半胱氨酸肽损耗率 5种强或极强致敏物肽损耗率均大于10%(4种大于99%),4种中等致敏物肽损耗率均大于10%(3种大于67%),3种弱致敏物肽损耗率均大于20%(21%~52%),6种非致敏物肽损耗率均小于3%,致敏性未知的氯仿与苯均未与肽反应(肽损耗率<2%)。预测化学物致敏性灵敏度、特异性、阳性预测率、阴性预测率和准确度均为100%。
2.2.2赖氨酸肽损耗率 5种强或极强致敏物中4种肽损耗率大于20%(24%~72%),水杨酸己酯未与肽反应(肽损耗率小于2%);4种中等致敏物、3种弱致敏物和6种非致敏物均未与肽反应(肽损耗率<10%);致敏性未知的氯仿和苯也未与肽反应(肽损耗率<2%)。预测化学物致敏性灵敏度、特异性、阳性预测率、阴性预测率和准确度分别为33.3%、100.0%、100.0%、42.9%、55.6%。
2.2.3半胱氨酸/赖氨酸肽损耗率均值 18种已知致敏性受试物中12种肽损耗率均值大于6.38%,为致敏阳性;6种肽损耗率均值小于6.38%,为致敏阴性,与LLNA致敏分类一致。致敏性未知的氯仿和苯肽损耗率均值均小于6.38%,为致敏阴性,与我们前期研究中LLNA法评估结果一致。5种强或极强致敏物中4种为高反应活性,1种为低反应活性;4种中等致敏物中3种为中反应活性,1种为低反应活性;3种弱致敏物中2种为低反应活性,1种为中反应活性;6种非致敏物均为微反应活性;致敏性未知的氯仿与苯均为微反应活性。预测化学物致敏性灵敏度、特异性、阳性预测率、阴性预测率和准确度均为100.0%。
3 讨论
目前化学物致敏性评价替代方法较多,如LLNA法[11-15]、 细胞法[16-19]、 化学法[5-6]、 计算机法[20]等,其中LLNA法较成熟,可较好地评价化学物的致敏性及其致敏强度。由于动物福利及欧盟化妆品条例要求逐步废除动物实验,因此发展高效、全面、安全的体外替代方法迫在眉睫。
本研究建立的化学法DPRA,简单快捷、易操作。但该方法要求测试化学物应溶于适当的溶剂制成终浓度100 mmol/L,同时需要测试化学物与肽间确定的物质的量比值,因此不能用于测试未知组成的复杂混合物、未知或可变组成的物质、复杂的反应产物或生物材料,所以开发基于重量法的新的预测模型很有必要[7]。此外该方法不适用于测试金属化合物,因为已知金属化合物与蛋白质反应形成非共价键[7]。
DPRA方法是化学反应,不涵盖代谢系统,对于需要酶促生物活化反应的非亲电性致敏原易出现假阴性[7,21]。 Gerberick等[22-23]对该方法进行了改良,即在致敏原与赖氨酸/半胱氨酸肽酶促反应中加入辣根过氧化物酶-过氧化氢(HRP /P),使抗原前体转变为抗原,从而使该方法也适用于抗原前体物(属非亲电物质)的检测。该改良法提高了检测的灵敏度,发展前景较好。
有关研究表明该方法实验内重现性为85%,实验室间重现性为80%[24]。 已发表文献[25]和 验证结果[26]表明:与LLNA结果比较,DPRA方法鉴别致敏剂与非致敏剂的准确性为80%,灵敏度为80%,特异性为77%;而本研究中DPRA方法对18种已知致敏性化学物进行鉴别,其准确性、灵敏度、特异性均为100%;表明该方法适宜高通量对化学物致敏性进行筛选,可将该方法在国内进一步推广应用。
[1] AHLFORS S R,STERNER O,HANSSON C. Reactivity of contact a llergenic h aptens t o a mino a cid r esidues i n a m odel c arrier peptide,and c haracterization o f f ormed p eptide-hapten a dducts[J].Skin P harmacol A ppl S kin P hysiol,2003,16:59-68.
[2] APTULA A O,PATLEWICZ G,ROBERTS D W,et al.Nonenzymatic glutathione reactivity and in vitro toxicity:A non-animal approach to skin sensitization[J]. Toxicol In Vitro,2006,20:239-247.
[3] DIVKOVIC M,PEASE C K,GERBERICK G F,et al.Hapten-protein binding:From theory to practical application in the in vitro prediction of skin sensitization[J]. Contact Derm,2005,53:189-200.
[4] KATO H,OKAMOTO M,YAMASHITA K,et al. Peptidebinding assessment using mass spectrometry as a new screening method for skin sensitization[J]. Toxicol Sci,2003,28,19-24.
[5] GERBERICK G F,VASSALLO J D,BAILEY R E,et al.Development of a peptide reactivity assay for screening contact allergens[J]. Toxicol Sci,2004,81:332-343.
[6] GERBERICK G F,VASSALLO J D,FOERTSCH L M,et al.Quantification of chemical peptide reactivity for screening contact allergens:a classification tree model approach[J].Toxicol Sci,2007,97(2):417-427.
[7] Organisation for Economic Co-operation and Development. Test No. 442C:In Chemico Skin Sensitization:Direct Peptide Reactivity Assay (DPRA)[S]. Paris:Organisation for Economic Co-operation and Development,2015.
[8] 柯逸晖,陈彧,程树军,等. 直接多肽结合试验组合人细胞系活化试验预测皮肤致敏物的探讨[J]. 中国实验动物学报,2016,24(6):611-617.
[9] 张劲松,桑晶,孙叶丹,等. 直接肽段结合方法在中药注射剂过敏反应预测中的应用[J]. 中国药品标准,2016,17(4):268-271.
[10] 王滢,吴越. 皮肤致敏测试动物替代方法DPRA的建立和应用[J]. 日用化学工业,2017,47(2):90-95.
[11] BOVERHOF D R,GOLLAPUDI B B,HOTCHKISS J A,et al.Evaluation of a toxicogenomic approach to the local lymph node assay (LLNA)[J]. Toxicol Sci,2009,107(2):427-439.
[12] BASKETTER D A,BALIKIE L,DEARMAN R J,et al. Use of the local lymph node assay for the estimation of relative contact allergenic potency[J]. Contact Dermatitis, 2000,42(6):344-348.
[13] GERBERICK G F,RYAN C A,DEARMAN R J,et al. Local lymph node assay (LLNA) for detection of sensitization capacity of chemicals[J]. Methods, 2007,41(1):54-60.
[14] HASEMAN J K,STRICKLAND J,ALLEN D,et al. Safety assessment of allergic contact dermatitis hazards:an analysis supporting reduced animal use for the murine local lymph node assay[J]. Regul Toxicol Pharmacol,2011,59(1):191-196.
[15] LOVELESS S E,API A M,CREVEL R W,et al. Potency values from the local lymph node assay:application to classification,labelling and risk assessment[J]. Regul Toxicol Pharmacol,2010,56 (1):54-66.
[16] NUKADA Y,ASHIKAGA T,MIYAZAWA M,et al. Prediction of skin sensitization potency of chemicals by human Cell Line Activation Test (h-CLAT) and an attempt at classifying skin sensitization p otency[J]. T oxicol i n V itro,26 ( 2012) 1 150-1160.
[17] JOHANSSON H,ALBREKT A S,BORREBAECK C A K. The GARD assay for assessment of chemical skin sensitizers[J].Toxicol in Vitro,2013,27:1163-1169.
[18] BAUCH C,KOLLE S N,RAMIREZ T,et al. Putting the parts together:Combining in vitro methods to test for skin sensitizing potentials[J]. Regul Toxicol Pharmacol,2012,63:489-504.
[19] RAMIREZ T,MEHLING A,KOLLE S N,et al. LuSens:A keratinocyte based ARE reporter gene assay for use in integrated testing strategies for skin sensitization hazard identification[J].Toxicol in Vitro,2014,28:1482-1497.
[20] NANDY A,KAR S,ROY K. Development and validation of regressionbased QSAR models for quantification of contributions of molecular fragments to skin sensitization potency of diverse organic chemicals[J]. SAR QSAR Environ Res, 2013,24(12):1009-1023.
[21] DIVKOVIC M,PEASE C K,GERBERICK G F,et al.Hapten-protein binding:fromtheory to practical application in the in vitro prediction of skin sensitization[J]. Contact Dermatitis,2005,53 (4):189-200.
[22] GERBERICK G F,TROUTMAN J A,FOERTSCH L M,et al.Investigation of peptide reactivity of pro-hapten skin sensitizers using a peroxidase-peroxide oxidation system[J]. Toxicol Sci,2009,112:164-174.
[23] TROUTMAN J A,FOERTSCH L M,KERN P S,et al. The incorporation of lysine into the peroxidase peptide reactivity assay for skin sensitizati on assessments[J]. Toxicol Sci,2011,122(2):422-436.
[24] EC EURL-ECVAM (2013). Recommendation on the Direct Peptide Reactivity Assay (DPRA) for skin sensitisation testing[EB/OL]. (2013-12-12)http://ihcp.jrc.ec.europa.eu/our_labs/eurlecvam/eurl-ecvam-recommendations/eurl-ecvamrecommendation-on-the-direct-peptide-reactivity-assay-dpra.
[25] NATSCH A,RYAN CA,FOERTSCH L,et al. A dataset on 145 chemicals tested in alternative assays for skin sensitization undergoing prevalidation[J]. J Appl Toxicol. 2013 Nov;33(11):1337-1352.
[26] EC EURL ECVAM (2012). Direct Peptide Reactivity Assay(DPRA) Validation Study Report[EB/OL]. (2013-12-12) http://ihcp.jrc.ec.europa.eu/our_labs/eurl-ecvam/eurl-ecvamrecommendations/eurl-ecvam-recommendation-on-the-directpeptide-reactivity-assay-dpra.

