邻苯二甲酸二辛酯亚慢性暴露对SD大鼠血细胞的影响
任雪丹 李 诺吕中明 * 王民生*
(1.东南大学公共卫生学院,江苏 南京 210009;2.江苏省疾病预防控制中心,江苏 南京 210009)
邻苯二甲酸二辛酯(di-2-ethylhexyl phthalate,DEHP)是邻苯二甲酸酯类(phthalates acid esters,PAEs)的重要成员,也是近代全球使用最为广泛的塑料增塑剂之一,被认为是广泛的环境持久性有机污染物(persistent organic pollutants,POPs)。DEHP主要用于生产柔性聚氯乙烯(polyvinyl chloride,PVC)塑料,赋予聚氯乙烯塑料柔韧性,可以占软PVC的40%。由于其实用性和成本效益,DEHP被广泛用于消费产品,包括玩具、个人护理产品、化妆品、农药、涂料、印染、室内装修材料、药品和食品包装材料[1-4]。由于DEHP与塑料基质之间是以不牢固的氢键和范德华力连接,所以伴随使用时间的推移,DEHP不断地从塑料中逸出,挥发至大气、土壤、水域中,造成环境介质、生物、食品等的污染。众多研究表明,DEHP是重要的环境内分泌干扰物,具有雄性、雌性生殖内分泌毒性、肝肾毒性、神经毒性和遗传毒性等多种生物毒性,并带来生物血液和生化方面的改变[5-11]。本研究拟通过对大鼠进行不同剂量的DEHP喂饲染毒,用ADVIA2120i型全自动五分类血细胞分析仪测定各组大鼠血液中白细胞、红细胞和血小板等生理指标的变化,以期研究DEHP亚慢性暴露对大鼠血细胞的影响。
1 材料与方法
1.1 主要试剂与仪器
DEHP(纯度≥99.5%,美国Sigma公司)、一次性塑料培养皿(美国Corning 公司)、1.5 mL EP管(美国Corning公司);ADVIA2120i型全自动五分类血细胞分析仪(德国Siemens公司)
1.2 动物饲养与分组
1.2.1动物的分组 健康清洁级SD大鼠100只,雌雄各半,体质量为70~90 g。购自北京维通利华实验动物技术有限公司,动物生产许可证号SCXK(京) 2012-0001,质量合格证号11400700158173。在适应性饲养3 d后,将受试大鼠按体质量随机分为5组,即对照组(饲喂基础饲料)、4个DEHP染毒组(染毒剂量分别为5、50、500和2 500 mg/kg),每组20只,雌雄各半,单笼饲养。
1.2.2动物的饲养 大鼠饲养于屏障环境动物实验室中,实验动物环境使用许可证号SYXK(苏)2012-0037。动物实验室温度控制在20~26 ℃,湿度为40%~70%。各剂量组按相应比例将DEHP均匀拌入饲料中,将饲料以平均每日动物体质量8%的摄食量按组别给予大鼠,连续饲喂染毒90 d。染毒期间,大鼠可自由饮水、摄食。
1.3 指标与方法
1.3.1体质量及食物利用率 观察并记录大鼠在饲养期间的一般情况(如日常行为表现、中毒和死亡情况等);于每周称量记录体质量、摄食量,并计算总的食物利用率(总食物利用率=总增质量/总摄食质量×100%)。
1.3.2血细胞参数测定方法 90 d喂养结束后,大鼠空腹16 h称量并记录最终空腹体质量,用滴加EDTA抗凝剂的1.5 mL EP管分别取雌雄大鼠全血1.0 mL,应用全自动血细胞分析仪立即进行血细胞分析。检测白细胞总数(WBC)、中性粒细胞(NEUT)、嗜酸性粒细胞(EOS)、嗜碱性粒细胞(BASO)、单核细胞(MONO)、淋巴细胞(LYM)、红细胞总数(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、平均红细胞体积(MCV)、平均血红蛋白含量(MCH)、平均血红蛋白浓度(MCHC)、直接测定的血红蛋白浓度(CHCM)、血红蛋白含量分布宽度(HDW)、血小板总数(PLT)、平均血小板体积(MPV)和未染色的大细胞数量(LUC)以及其相应的百分比等指标。
1.5 统计学方法
采用SPSS 19.0软件进行统计学分析,多组间均数比较经方差齐性检验后采用单因素方差分析,各实验组与对照组用Dunnett’s法比较;组间率的比较采用非参数检验。所有结果用 表示,以α=0.05为检验水准。
2 结果
2.1 DEHP对大鼠体质量的影响
在染毒期间,对照组经观察均未出现异常现象;与对照组比较,DEHP 5、50和500 mg/kg剂量组均未观察到明显的差异;而2 500 mg/kg DEHP染毒组动物则均表现出精神亢奋、被毛蓬松、局部脱毛(头颈部和四肢以及腹部)等中毒体征,摄食量减少,大鼠体质量在染毒后显著下降,差异有统计学意义(p<0.05),见表1。
表1 不同剂量DEHP染毒对大鼠体质量的影响(g,-,n=10)
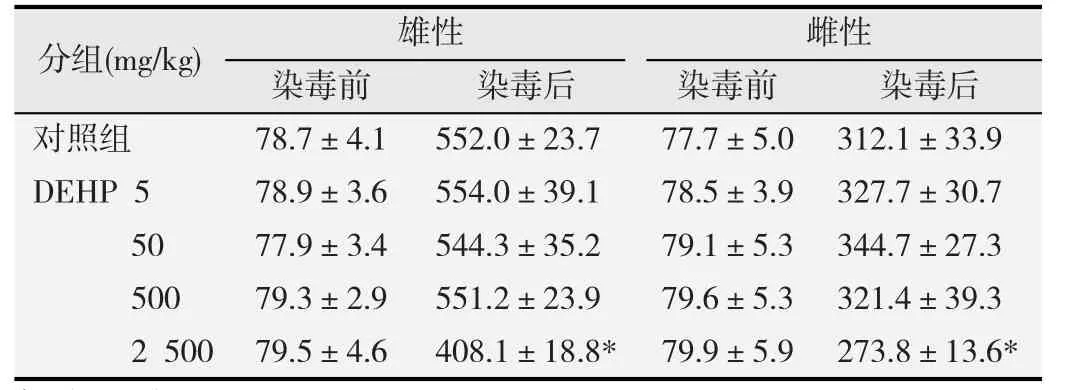
表1 不同剂量DEHP染毒对大鼠体质量的影响(g,-,n=10)
与对照组相比,*p<0.05.
分组(mg/kg) 雄性 雌性染毒前 染毒后 染毒前 染毒后对照组 78.7±4.1 552.0±23.7 77.7±5.0 312.1±33.9 DEHP 5 78.9±3.6 554.0±39.1 78.5±3.9 327.7±30.7 50 77.9±3.4 544.3±35.2 79.1±5.3 344.7±27.3 500 79.3±2.9 551.2±23.9 79.6±5.3 321.4±39.3 2 500 79.5±4.6 408.1±18.8* 79.9±5.9 273.8±13.6*
2.2 不同染毒剂量DEHP对大鼠食物利用率的影响
在DEHP染毒期间,5、50和500 mg/kg剂量组的体质量和摄食量与对照组相比差异均无统计学意义(P>0.05),而2 500 mg/kg剂量组的大鼠体质量和摄食量与对照组相比明显下降,且差异具有统计学意义(p<0.05)。见表2。

表2 不同剂量DEHP染毒对大鼠食物利用率的影响(-x±s,n=10)
2.3 DEHP对大鼠白细胞的影响
见表3。结果表明,2 500 mg/kg组雄性大鼠嗜酸性粒细胞(EOS)显著减少,雌性大鼠白细胞总数(WBC)显著降低,与对照组相比差异均具有统计学意义(p<0.05或p<0.01)。在500和2 500 mg/kg剂量下,雌性大鼠淋巴细胞(LYM)与对照组相比显著增加,差异有统计学意义(p<0.05)。
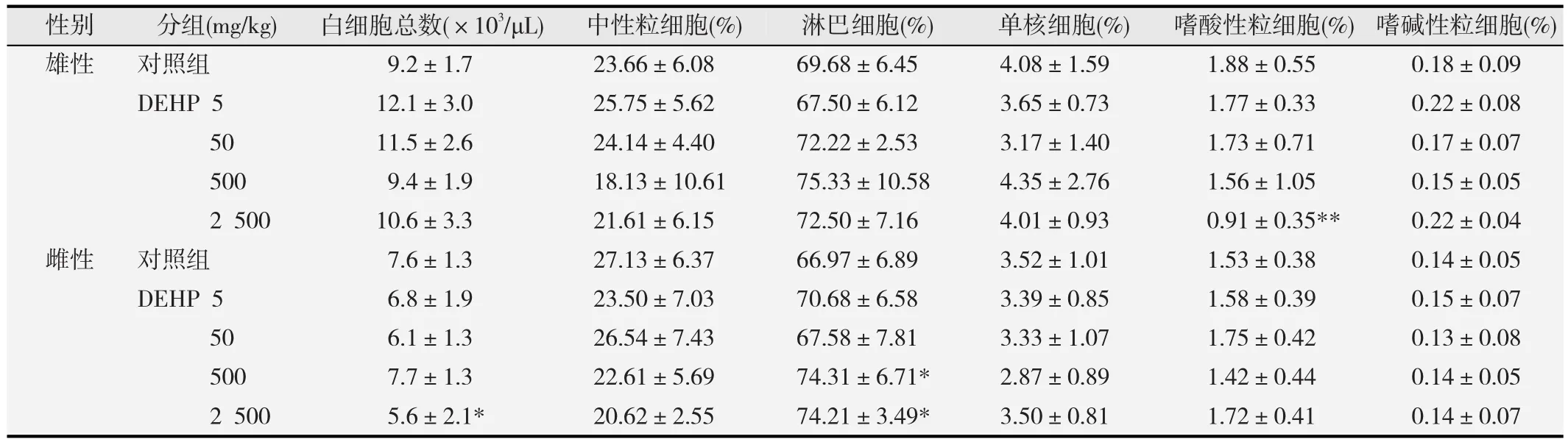
表3 不同剂量DEHP染毒对大鼠白细胞相关指标的影响(-x±s,n=10)
2.4 DEHP对大鼠红细胞的影响
如表4所示。由表4可见,在雄性大鼠中,2 500 mg/kg DEHP染毒组红细胞总数(RBC)、血红蛋白(HGB)和红细胞压积(HCT)与对照组相比显著下降,差异均具有统计学意义(p<0.01)。
在雌性大鼠中,DEHP 500 mg/kg和2 500 mg/kg组血红蛋白(HGB)显著下降,与对照组相比,差异有统计学意义(p<0.05)。平均血红蛋白含量(MCH)随着剂量的增加而降低,呈现出剂量-效应关系,在500 mg/kg和2 500 mg/kg剂量下与对照组相比显著下降,差异均有统计学意义(p<0.05或p<0.01)。在2 500 mg/kg剂量下,平均血红蛋白浓度(MCHC)和直接测定的血红蛋白浓度(CHCM)与对照组相比显著下降,差异均有统计学意义(p<0.05或p<0.01)。
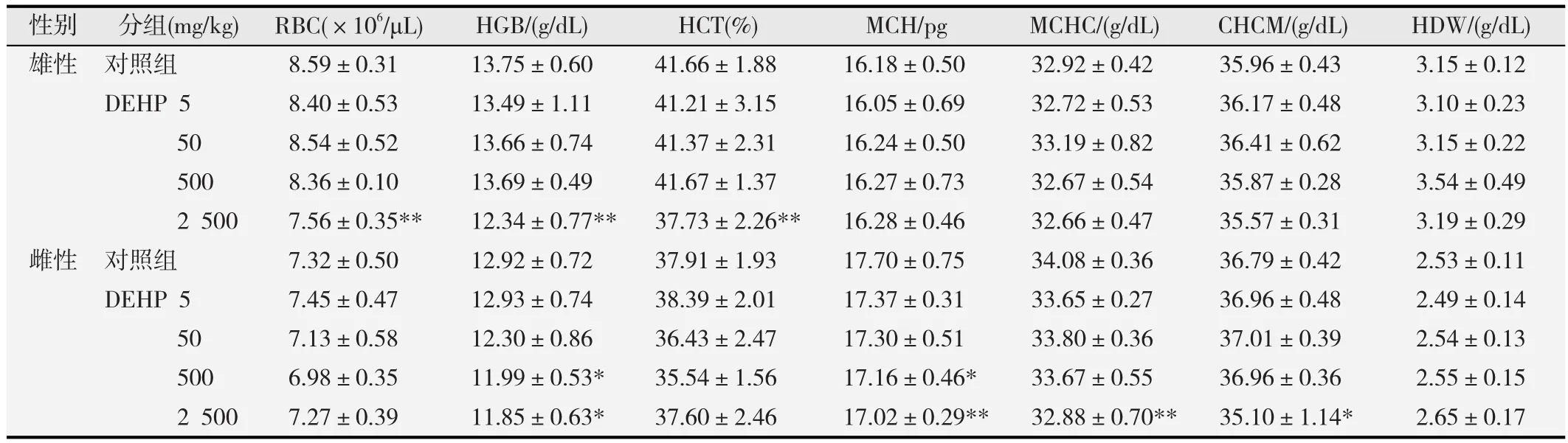
表4 不同剂量DEHP染毒对大鼠红细胞相关指标的影响(-x±s,n=10)
2.5 不同染毒剂量DEHP对大鼠血小板的影响
见表5。在DEHP染毒期间,未发现其对大鼠血小板各项指标产生影响。
表5 不同剂量DEHP染毒对大鼠血小板相关指标的影响(,n=10)
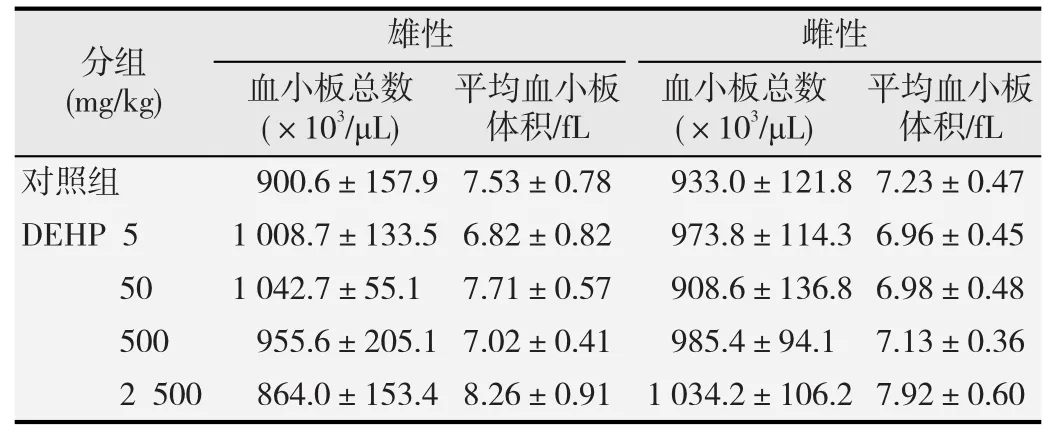
表5 不同剂量DEHP染毒对大鼠血小板相关指标的影响(,n=10)
平均血小板体积/fL分组(mg/kg)平均血小板体积/fL雄性 雌性血小板总数 血小板总数(×10/μL)3(×10/μL)3对照组 900.6±157.9 7.53±0.78 933.0±121.8 7.23±0.47 DEHP 5 1 008.7±133.5 6.82±0.82 973.8±114.3 6.96±0.45 50 1 042.7±55.1 7.71±0.57 908.6±136.8 6.98±0.48 500 955.6±205.1 7.02±0.41 985.4±94.1 7.13±0.36 2 500 864.0±153.4 8.26±0.91 1 034.2±106.2 7.92±0.60
3 讨论
从DEHP亚慢性染毒对大鼠体质量、增质量、总摄食量及食物利用率的影响结果来看,随着染毒剂量的增加,DEHP 2 500 mg/kg组大鼠的体质量、体质量的增量、总摄食量与对照组相比显著下降,提示,DEHP亚慢性暴露对大鼠的体质量和摄食量有一定的影响。
白细胞是血液细胞的一种,通常也被称为免疫细胞,在机体内更新的速度比较快。作为免疫系统的一部分,具有防御和免疫功能,参与对细菌、病毒等异物入侵时的免疫过程,白细胞各项指标的变化是机体免疫力变化的标志[12]。在DEHP 500 mg/kg剂量下,雌性大鼠淋巴细胞(LYM)与对照组相比显著增加(p<0.05),2 500 mg/kg剂量时,淋巴细胞(LYM)持续增加(p<0.05),白细胞总数(WBC)显著降低,与对照组相比差异具有统计学意义(p<0.05),说明高剂量的DEHP可能影响机体的免疫系统功能,对免疫细胞产生细胞毒性并破坏白细胞。这也和有关DEHP在高浓度下,可使自由基产生增加,影响机体的抗氧化酶系和引起氧化损伤,从而产生细胞毒性的报道结果相一致[13]。研究[14-16]表明,DEHP具有“佐剂”的作用,能增强免疫原性的活力、诱发哮喘、诱导巨噬细胞分化和分泌促炎性因子,加重炎症过敏反应。
红细胞负责供给全身组织和细胞所需的O2,带走其产生的部分CO2,对机体的正常运行具有重要作用。红细胞总数(RBC)、血红蛋白(HGB)和红细胞压积(HCT)主要用来判断有无贫血及贫血的程度,较为常见的是3者降低即为贫血,根据HGB降低程度划分贫血程度[17]。由本研究结果可见,在雄性大鼠中,2 500 mg/kg组红细胞总数(RBC)、血红蛋白(HGB)和红细胞压积(HCT) 与对照组相比显著下降,差异有统计学意义(p<0.01)。说明2 500 mg/kg剂量下,DEHP可对大鼠的红细胞产生一定的影响。平均血红蛋白含量(MCH)、平均血红蛋白浓度(MCHC)和直接测定的血红蛋白浓度(CHCM)均为红细胞的平均值,据此可进行贫血的形态学分类[18]。在雌性大鼠中,平均血红蛋白含量(MCH)随着剂量的增加而降低,在500 mg/kg和2 500 mg/kg剂量下与对照组相比显著下降(p<0.05或p<0.01)。同时,平均血红蛋白浓度(MCHC)和直接测定的血红蛋白浓度(CHCM) 在2 500 mg/kg剂量下与对照组相比显著降低(p<0.05或p<0.01),说明机体发生了严重贫血,血红蛋白含量显著下降,从而携带O2和CO2的能力也显著降低。
血小板的功能主要是促进止血和加速凝血,以及维护毛细血管壁完整性。在本实验中,不同剂量的DEHP对大鼠血小板的指标无显著影响。说明在本实验中,DEHP对大鼠的凝血止血功能无显著影响。
综上所述,一定剂量的DEHP会对实验性大鼠的体质量、摄食量和血液系统产生影响。
[1] PFE V D M,DEVINE D V. Alternatives in blood operations when choosing non-DEHP bags[J]. Vox Sanguinis, 2017,112(2):149.
[2] 林铌,靳洪涛,王爱平. 医疗器械中增塑剂的应用和安全性研究进展[J]. 中国药物警戒,2014,11(2):100-103.
[3] 徐毅,薛山,贺稚非,等. 食品包装中增塑剂DEHP毒性特点及迁移研究进展[J]. 食品工业科技,2013,34(21):385-389.
[4] 王继鹏,杨彦,李定龙. 水环境中DEHP污染现状及其去除的研究进展[J]. 化工进展. 2014,2:498-504.
[5] MADKOUR N K. Beneficial role of celery oil in lowering the di(2-ethylhexyl) phthalate-induced testicular damage[J]. Toxicol Ind Health,2014,30(9):861-872.
[6] TANG J Q,YUAN Y,WEI C X,et al. Neurobehavioral changes induced by di(2-ethylhexyl) phthalate and the protective effects of vitamin E in Kunming mice[J]. Toxicol Res,2015,4(4):1006-1015.
[7] HAO Y,LI Q Z,ZHENG G Y. Pathology changes of kidney in mouse following DBP&DEHP exposure[M]//CHEN S,LIU Z T,ZENG Q. Advanced Materials Research.2012: 554-556,1660-1663.
[8] CHEN H,ZHANG W,RUI B B,et al. Di(2-ethylhexyl)phthalate exacerbates non-alcoholic fatty liver in rats and its potential mechanisms[J]. Environ Toxicol Pharm,2016,42:38-44.
[9] 吴微. 邻苯二甲酸酯暴露及其对儿童生长发育影响的研究[D].武汉:华中科技大学,2015.
[10] POCAR P,FIANDANESE N,BERRINI A,et al. Maternal exposure to di(2-ethylhexyl)phthalate (DEHP) promotes the transgenerational inheritance of adult-onset reproductive dysfunctions through the female germline in mice[J]. Toxicol Applied Pharm,2017. 322:113-121.
[11] 董瑞娜,戴红. DEHP对雄性生殖系统毒性的研究进展[J]. 世界最新医学信息文摘,2016,90:57-59.
[12] 章子贵,许晓路,申秀英. 不同硒水平对大鼠免疫力和血细胞的影响[J]. 微量元素与健康研究,2005,2:1-2.
[13] 唐啸. DEHP通过氧化应激和Fasl途径诱导GC-2spd细胞凋亡[D]. 武汉:武汉科技大学,2016.
[14] BORNEHAG C G,SUNDELL J,WESCHLER C J,et al. The association between asthma and allergic symptoms in children and phthalates in house dust:a nested case-control study[J].Environ Health Perspect,2004,112(14):1393-1397.
[15] KOIKE E,INOUE K,YANAGISAWA R,et al. Di-(2-ethylhexyl) phthalate affects immune cells from atopic prone mice in vitro[J]. Toxicology,2009,259(1/2):54.
[16] NISHIOKA J,IWAHARA C,KAWASAKI M,et al. Di-(2-ethylhexyl) phthalate induces production of inflammatory molecules in human macrophages[J]. Inflam Res, 2012,61(1):69-78.
[17] 罗鹏,张爱华,吴应宽,等. 三氧化二砷对大鼠血细胞参数影响的实验分析[J]. 贵阳医学院学报,2009,34(4):374-377.
[18] 王先庆. 铅作业工人血细胞损害早期指标探讨[J]. 中国社区医师(医学专业),2012,14(31):248-249.

