春小麦品种川育19抗叶锈性遗传分析
袁军海,沈凤英,吴伟刚,张爱香(河北北方学院 植物保护系,河北 宣化 075131)
叶锈病是我国小麦的重要病害,主要发生在小麦生长的中后期,因夏孢子堆的出现造成发病部位水分过度散失,最终导致小麦减产甚至死亡。小麦叶锈病的主要防治措施有种植抗病品种和喷洒化学药剂。其中,种植抗病品种经济、有效、简便且对环境安全,更易被种植者采用。基于孟德尔遗传规律的经典遗传分析,可以明确抗病基因的显隐性、对数和相互作用关系等,一直是培育抗病品种的理论基础,但由于该分析一般需要3~4 a的时间,所以更适宜对重要材料进行深入研究。我国关于小麦抗叶锈病遗传分析方面的研究始于20世纪90年代[1],到目前为止,用于筛选分子标记的相关研究较多[2-3],而真正较为深入的、传统意义上的遗传分析仍然很少[4],难以对抗病育种形成系统的理论指导。川育19由中国科学院成都生物研究所选育,区试代号为46648-1,系谱为川育5号/墨460//绵阳26,属春性、早熟品种,综合农艺性状较好[5-6]。2003—2009年,分别在北京冬麦区接种优势致病类型、在张家口春麦区自然发病,多次进行抗病性测定发现,该品种对叶锈病一直表现为慢病。通过基因推导认为,川育19含有Lr1、Lr3和其他未知基因[7]。本试验在此基础上,结合等位性验证,分别在苗期和成株期进行抗病性测定,对川育19的抗叶锈性进行了遗传分析,以期为小麦抗叶锈病育种提供理论依据。
1 材料和方法
1.1 试验材料
小麦品种川育19最初由中国科学院成都生物研究所提供,小麦抗叶锈病近等基因系Lr1和Lr3的载体品系Tc*6/Centenario和Tc*6/Democrat最初由国际小麦玉米改良中心(CIMMYT)提供,感病对照品种为Thatcher;小麦叶锈病菌致病类型BGD/HL、FBC/GN、PHT/RP、SHJ/GL、THT/TP,从采自我国不同地区的小麦叶锈病标样中分离鉴定而来,按照Long等[8]和Singh[9]提出的密码规则命名。上述材料均由中国农业科学院植物保护研究所麦病组繁殖、保存并提供。
1.2 试验方法
配制了Thatcher×川育19、Tc*6/Centenario(Lr1)×川育19和Tc*6/Democrat(Lr3)×川育19共3个杂交组合。获得F1代种子后,随机选取6~8粒播种,花期套袋自交,6~8株所获得的种子混合即为F2群体,再从中随机选取180粒种子播种,每粒种子的后代作为1个F3株系。
苗期抗病性测定在小型塑料盒内进行,预先放入营养土,种子穴播,穴深1 cm、穴距5 cm,每穴5~7粒种子。杂交亲本川育19、Tc*6/Centenario(Lr1)、Tc*6/Democrat(Lr3)和Thatcher分别播种5~7粒种子,各杂交组合的F1和F2分别播种8粒和600粒种子,F3播种150个株系,每个株系约70粒种子。当小麦第一叶片充分展开时,先用清水去蜡,然后喷洒含0.05%吐温20的夏孢子粉悬浮液,放入保湿桶内,在室温、黑暗条件下保湿约16 h,然后置于RXZ-280B型人工气候箱(宁波江南仪器厂生产)中培养,条件为:温度18 ℃、相对湿度95%以上、光照强度12 000 lx,每天光照14 h。10~12 d后,当感病对照充分发病时,按照Roelfs[10]确定的侵染型标准,划分为0、;、1、2、X、3、4等7个级别调查;若同时出现2种侵染型,则多者列前少者列后,如“;1”表示以“;”为主,还有少量“1”,根据前者判断抗病或感病类型;X表示同时出现“;”、“1”、“2”、“3”和“4”等侵染型中的3个或3个以上类型。将7个级别转换为抗感反应,具体为0—免疫、;—近免疫、1—高度抗病、2和X—中度抗病、3—中度感病、4—高度感病,遗传分析时 0~X归为抗病类型,3~4归为感病类型。由于工作量较大,F3仅判断整个株系属全部抗病、抗感分离或全部感病,未做单株调查。
成株期抗病性测定在河北北方学院南校区农场进行。小区宽2.2 m、长11 m,行距0.333 3 m,即每小区34行,两端为保护行,中间每隔10行设1行诱发行,其余30行为鉴定行。各鉴定行横向分为3部分:左、右各1 m播种待鉴定材料,中间留出约0.2 m空间,与各鉴定行垂直方向,纵向播种1行诱发行。保护行和诱发行品种均为Thatcher。杂交亲本均条播1行,行长1 m;各杂交组合播种量同苗期,但F1和F2均点播,株距10 cm,F3条播,每个株系行长1 m。小麦返青后拔节前,选择晴天无风的傍晚,用致病类型PHT/RP和THT/TP的等比混合菌种接种。先在植株基部浇水至土壤含水量过饱和,然后将叶片用清水去蜡、喷洒含0.05%吐温20的夏孢子粉悬浮液,最后盖塑料膜保湿,次日日出前揭膜。管理同一般大田。待感病对照品种充分发病后,调查各植株旗叶的抗感反应和严重度。抗感反应根据Roelfs[10]确定的侵染型标准调查后转换为抗感反应类型;严重度根据Peterson等[11]确定的方法估测,记为0~100%。
2 结果与分析
2.1 供试小麦品种(系)抗叶锈性测定
川育19在苗期对PHT/RP和THT/TP表现高度感病,对其他供试致病类型均表现免疫,在成株期表现感病,但严重度仅为5%~10%。在苗期,Lr1的载体品系Tc*6/Centenario对致病类型BGD/HL和FBC/GN,及Lr3的载体品系Tc*6/Democrat对BGD/HL和SHJ/GL,均表现为近免疫,其他组合均表现为高度感病;二者在成株期均表现为高度感病。Thatcher在苗期和成株期均表现为高度感病(表1)。

表1 供试小麦品种(系)抗叶锈性测定结果
2.2 川育19苗期抗叶锈病遗传分析
对Thatcher×川育19杂交组合接种致病类型BGD/HL,8株F1均表现抗病,F2共测定523株,484株归为抗病类型、39株归为感病类型,符合15(抗病)∶1(感病)的期望比例,说明川育19对致病类型BGD/HL的抗病性由2对独立遗传的显性抗叶锈病基因控制;F3共测定150个株系,其中58个株系全部抗病、80个株系抗感分离、12个株系全部感病,符合7(全部抗病)∶8(抗感分离)∶1(全部感病)的期望比例,可验证F2的结果(表2)。对Tc*6/Centenario(Lr1)×川育19杂交组合接种致病类型BGD/HL,F2共测定517株,全部抗病,说明川育19含有Lr1,或群体尚小未出现感病植株。若为后者,则Tc*6/Centenario(Lr1)×川育19杂交组合至少含有4对独立遗传的显性抗叶锈病基因,才能满足517(抗病)∶0(感病)的分离情况,即川育19中至少含有3对显性抗叶锈病基因,但这与相同情况下Thatcher×川育19杂交组合的分离情况不符合,故否定此可能性,认为川育19含有Lr1。同理可推断川育19亦含有Lr3。综合判断,在Thatcher×川育19杂交组合中,控制对致病类型BGD/HL抗病性的2对显性抗叶锈病基因是川育19所含有的Lr1和Lr3。
对Thatcher×川育19杂交组合接种致病类型FBC/GN,6株F1均抗病,F2的分离符合3(抗病)∶1(感病)的期望比例,说明川育19对FBC/GN的抗病性由1对显性抗叶锈病基因控制,F3的分离情况可验证上述结果(表2)。相同情况下对于Tc*6/Centenario(Lr1)×川育19杂交组合,538株F2全部抗病,同上述分析,可认为川育19含有Lr1。即在Thatcher×川育19杂交组合中,控制对致病类型FBC/GN抗病性的1对显性抗叶锈病基因是Lr1。相同条件下,Tc*6/Democrat(Lr3)×川育19杂交组合的F2符合3(抗病)∶1(感病)的分离比例,考虑到FBC/GN对Lr3有毒性而对Lr1无毒性(表1),故起作用的1对显性抗叶锈病基因是川育19所含有的Lr1,否则,若川育19含有其他对FBC/GN有抗病作用的基因,则与相同情况下Thatcher×川育19杂交组合的分离情况无法相互验证。同理可推断,在Thatcher×川育19和Tc*6/Centenario(Lr1)×川育19杂交组合中,控制对致病类型SHJ/GL抗病性的1对显性抗叶锈病基因均为川育19所含有的Lr3。
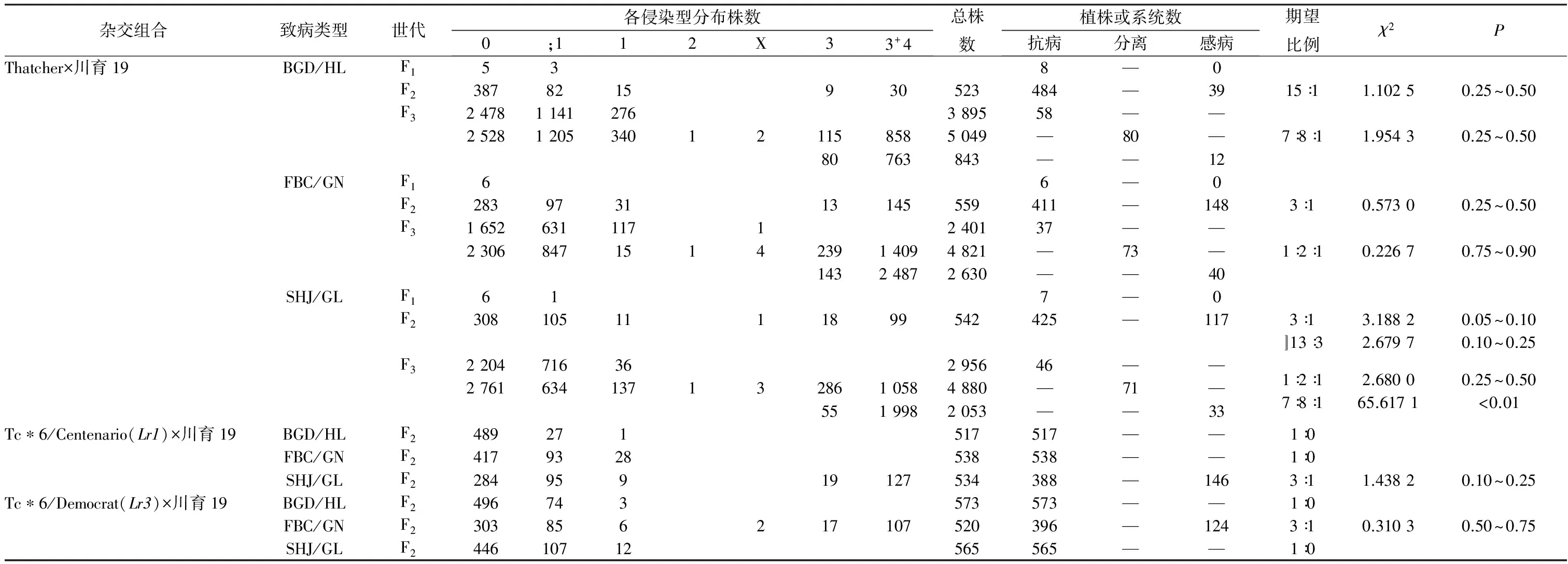
表2 川育19苗期抗叶锈病遗传分析
2.3 川育19成株期抗叶锈病遗传分析
对Thatcher×川育19杂交组合,6株F1均表现为中度抗病,且严重度均低于30%;F2共测定557株,其中65株中度抗病、228株中度感病至感病,且严重度均低于30%,可归为抗病类型,20株中度感病至感病,且严重度为31%~60%,考虑到在生产上尚有一定应用价值,也归为抗病类型,其余188株中度感病至感病及56株感病,且严重度均高于60%,可归为感病类型,313株抗病、244株感病,符合9(抗病)∶7(感病)的期望比例,说明在Thatcher×川育19杂交组合中,成株期的抗病性由2对互补遗传的显性抗叶锈病基因控制;根据上述F2的抗病与感病的分界线判断,F3有13个株系全部抗病、77个株系抗感分离、60个株系全部感病,符合1(全部抗病)∶8(抗感分离)∶7(全部感病)的期望比例,可验证F2的结果(表3)。
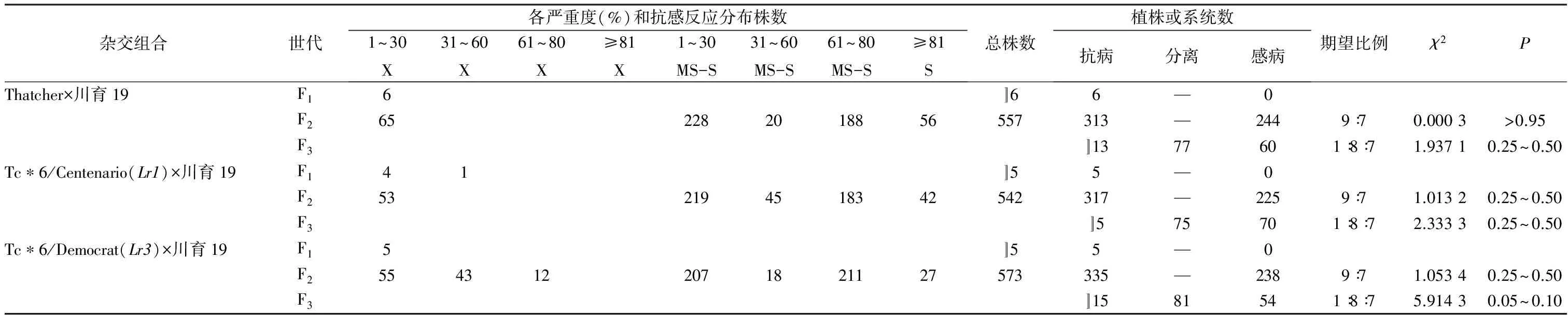
表3 川育19成株期抗叶锈病遗传分析
注:S.感病;MS-S.中度感病至感病。
对Tc*6/Centenario(Lr1)×川育19杂交组合,5株F1均表现为中度抗病,除1株严重度为31%~60%外,其余4株均低于30%;根据上述分析确定的F2的抗感分界线判断,F2有317株抗病、225株感病,符合9(抗病)∶7(感病)的期望比例;F3有5个株系全部抗病、75个株系抗感分离、70个株系全部感病,也符合1(全部抗病)∶8(抗感分离)∶7(全部感病)的期望比例。说明Tc*6/Centenario(Lr1)×川育19杂交组合在成株期的抗病性亦由2对互补遗传的显性抗叶锈病基因控制,与Thatcher×川育19杂交组合相同,同时也说明在Tc*6/Centenario(Lr1)×川育19杂交组合中,抗病性由川育19提供,Tc*6/Centenario(Lr1)的抗病性在成株期不起作用,可验证表1结果。同理,Tc*6/Democrat(Lr3)×川育19杂交组合在成株期的抗病性也由川育19提供的2对互补遗传的显性抗叶锈病基因控制,Tc*6/Democrat(Lr3)的抗病性在成株期亦不起作用。
3 结论与讨论
川育19含有呈显性遗传的Lr1和Lr3,在苗期分别控制对致病类型FBC/GN和SHJ/GL的抗病性,且2对基因相互独立遗传,均控制对致病类型BDG/HL的抗病性;Lr1和Lr3的抗病性在成株期不起作用,川育19的成株期抗病性由2对互补遗传的显性抗叶锈病基因控制。
Lr1和Lr3在我国小麦品种中的出现频率分别约为13.42%和9.17%[12]。由于较早的、广泛性的应用,导致病原物中相应的毒性基因频率上升,反过来克服抗病基因的抗病性,故Lr1和Lr3在我国早已经失效。我国首次正式报道小麦叶锈菌群体毒性时,Lr1和Lr3的毒性频率已分别达到30.02%和89.10%[13],而在近期的许多报道中,二者均已达95%以上[14-15]。美国的情况也很相似[16]。但与合适的基因组合起来,Lr1和Lr3尚可发挥“残存”的抗病性,提高整体抗病能力。如Lr1和Lr34在成株期的抗病性分别为90S和T-20M(T表示微量侵染型,M表示混合侵染型,分别与本研究中的近免疫侵染型“;”和中度抗病侵染型“X”近似),将二者组合在同一品系中抗病性为T-5M[17];Lr1、Lr3和Lr13在成株期的抗病性分别为80S、70S和60MR(MR表示中度抗病),而Lr1和Lr13组合起来的抗病性为20MR-30MS,Lr3和Lr13组合起来的抗病性为10MR[18]。
在已正式命名的抗叶锈病基因中,仅Lr27和Lr31呈显性遗传且互补起作用[19-20]。陈万权等[21]用我国叶锈菌优势致病类型测定发现,Lr27+Lr31在成株期出现0(免疫)和65S 2种情况,怀疑是种子混杂所致,但在许多关于小麦叶锈菌群体毒性分析中,Lr27+Lr31的毒性频率均在60%以上[15,21-22],故65S的鉴定结果更可信,说明Lr27+Lr31的抗病性在我国已基本失效。而川育19在成株期的表现为5~10S,仅后期出现少量感病孢子堆,前期接近免疫,说明其抗病性仍比较有效。当然,也可能出现Lr27+Lr31与Lr13或Lr34等基因互作提高抗病性的情况,但若如此,川育19在成株期的抗病性应呈现3对及3对以上抗病基因分离的情况。所以,川育19中控制成株期抗病性的2对互补遗传的显性抗叶锈病基因更可能是新基因。
抗感分界线的划分是遗传分析的关键之一。本试验的苗期结果,明显分为2部分,分别与抗病亲本和感病亲本的侵染型接近,没有中间类型,或中间类型很少,且考虑到所有可能的期望比例后,划归抗病类型或感病类型均对最终结果无影响,直接根据F2即可判断抗感分界线。但成株期的结果,中间类型较多,如果仍仅根据F2判断,可能存在多个抗感分界线,能够分别符合各自的期望比例。对此,杨作民[23]认为,根据F3系统的不同分离情况反过来划分F2单株类别,才是较合理的做法,这也是本试验进行抗感分界线划分时遵循的基本原则。
致谢:中国农业科学院植物保护研究所的刘太国研究员和冯晶副研究员参与部分工作,谨此致谢!
参考文献:
[1]赤国彤,王焕如,朱之堉.7个小麦品种抗叶锈病遗传研究初报[J].河北农业大学学报,1991,14(4):76-78.
[2]王佳真,李在峰,李星,等.小麦品系5R618抗叶锈病基因的初步定位[J].植物遗传资源学报,2014,15(6):1348-1351.
[3]张培培,周悦,董海焦,等.周麦11、西农1163-4抗叶锈病基因与周8425B中LrZH84的关系[J].江苏农业科学,2015,43(10):33-36.
[4]袁军海,陈万权.春小麦品种青春221抗叶锈性遗传分析[J].植物保护学报,2013,40(1):20-26.
[5]刘正德,姚革,蒋滨,等.四川省小麦条锈病、白粉病、赤霉病抗性鉴定及抗原筛选[J].西南农业学报,2005,18(3):291-294.
[6]伍玲,朱华忠,邓丽,等.1997—2007年通过四川省区试审定的小麦品种述评[J].西南农业学报,2008,21(3):562-569.
[7]袁军海,刘太国,陈万权.中国47个小麦新品种(系)苗期抗叶锈病基因推导[J].中国农业科学,2007,40(9):1925-1935.
[8]Long D L,Kolmer J A.A North American system of nomenclature forPucciniareconditaf.sp.tritici[J].Phytopathology,1989,79(5):525-529.
[9]Singh R P.Pathogenicity variations ofPucciniareconditaf.sp.triticiandP.graminisf.sp.triticiin wheat-growing areas of Mexico during 1988 and 1989[J].Plant Disease,1991,75(7):790-794.
[10]Roelfs A P.Race specificity and methods of study[M]//Bushnell W R,Roelfs A P.The cereal rust Ⅰ.Origins,specificity,structure,and physiology.New York:Academic Press,1985:134.
[11]Peterson R F,Campbell A B,Hannah A E.A diagrammatic scale for estimating rust intensity on leaves and stems of cereals[J].Canadian Journal of Research (Section C),1948,26(4):496-500.
[12]袁军海,陈万权.中国小麦主要抗叶锈病基因的有效性评价[J].麦类作物学报,2011,35(7):794-801.
[13]郭爱国,赤国彤,杨文香,等.1990年河北省小麦叶锈菌群体的毒性分析[J].河北农业大学学报,1992,15(1):43-46.
[14]赵盼盼,孟庆芳,郭楠,等.2009—2011年河南省小麦叶锈菌毒性结构分析[J].河南农业科学,2013,42(4):91-94.
[15]原宗英,武英鹏,刘敏捷.山西省小麦叶锈菌致病类型及毒性监测[J].山西农业科学,2017,45(3):448-450.
[16]Kolmer J A,Hughes M E.Physiologic specialization ofPucciniatriticinaon wheat in the United States in 2013[J].Plant Disease,2015,99(10):1261-1267.
[17]German S E,Kolmer J A.Effect of geneLr34 in the enhancement of resistance to leaf rust of wheat[J].Theoretical and Applied Genetics,1992,84(1):97-105.
[18]Kolmer J A.Enhanced leaf rust resistance in wheat conditioned by resistance gene pairs withLr13[J].Euphytica,1992,61(1):123-130.
[19]Singh R P,McIntosh R A.Complementary genes for reaction toPucciniareconditatriticiinTriticumaestivum.Ⅰ.Genetic and linkage studies[J].Canadian Journal of Genetics and Cytology,1984,26(6):723-735.
[20]Singh R P,McIntosh R A.Complementary genes for reaction toPucciniareconditatriticiinTriticumaestivum.Ⅱ.Cytogenetic studies[J].Canadian Journal of Genetics and Cytology,1984,26(6):736-742.
[21]陈万权,秦庆明.国际上已知小麦抗叶锈病基因在中国的可利用性研究[J].中国农业科学,2002,35(7):794-801.
[22]Liu T G,Chen W Q.Race and virulence dynamics ofPucciniatriticinain China during 2000—2006[J].Plant Disease,2012,96(11):1601-1607.
[23]杨作民.小麦对条锈病抗性遗传的研究[J].作物学报,1981,7(2):81-90.

