复方中药联合TP方案治疗晚期非小细胞肺癌的临床疗效观察
杨美菊,程哲#商丘市第一人民医院呼吸内科,河南 商丘476 郑州大学第一附属医院呼吸内科,郑州455
中国是肺癌的高发国家,其中,大多数为非小细胞肺癌(non‐small cell lung cancer,NSCLC),且患者确诊时多已处于中晚期,已失去手术治疗的机会,以化疗、靶向治疗和免疫靶向治疗等为主要治疗手段[1]。但化疗对患者产生的不良反应较大,部分患者因无法耐受而不得不放弃治疗。复方中药根据传统中医药理论组方,可以降低放化疗的不良反应,防止NSCLC的复发和转移,改善晚期NSCLC患者的临床症状,延长患者的生存期[2]。临床研究已证实,联合使用复方中药(如艾迪注射液)可以发挥减毒增效的作用,进而提高患者对药物的耐受性[3]。肺癌患者体内除辅助性T细胞1/2(helper T lymphocyte1/2,Th1/Th2)失衡外,还存在明显的调节性T细胞(regulatory T cell,Treg)/Th17失衡,这种失衡的发生促进了肿瘤的进展[4]。艾迪注射液是否可以调节肺癌患者体内Treg/Th17的失衡,国内外尚未见研究。本研究对比了艾迪注射液联合多西他赛+奈达铂(TP)方案与单用TP方案治疗晚期NSCLC的临床疗效及对Treg/Th17的影响,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2014年1月至2016年12月于商丘市第一人民医院呼吸内科和郑州大学第一附属医院收治的95例晚期NSCLC患者的临床资料,男62例,女33例,平均年龄(58.9±8.5)岁;按照治疗方法的不同将患者分为对照组47例和观察组48例。纳入标准:①均经CT、病理学检查确诊;②无手术适应证;③预计生存时间>3个月;④KPS评分>60分。排除标准:①缺乏影像学可测量的肿瘤组织;②合并其他原发性恶性肿瘤;③体质较差,无法接受化疗;④合并心、肝、肾等脏器严重功能障碍。对照组患者给予TP化疗方案进行治疗,观察组患者在给予TP方案治疗的基础上加用艾迪注射液进行治疗。两组患者的临床资料比较,差异无统计学意义(P>0.05),具有可比性,详见表1。

表1 两组患者的临床资料
1.2 治疗方法
两组患者均给予TP方案进行治疗,第1天静脉滴注多西他赛75 mg/m2;第1~3天静脉滴注奈达铂80~100 mg/m2。观察组患者在给予TP方案治疗的基础上,第1天加用艾迪注射液静脉滴注,每次50 ml。两组患者均以治疗3周为1个治疗周期。所有患者均完成2个周期的治疗。
1.3 评价标准及观察指标
治疗2个周期后,根据实体瘤疗效评价标准(RECⅠST1.0版)[5]进行近期疗效评价,完全缓解(complete response,CR):所有可见病变完全消失,并至少维持4周以上;部分缓解(partial response,PR):肿瘤病灶的最大径及其最大垂直径的乘积减少≥50%,并维持4周以上;稳定(stable disease,SD):肿瘤病灶两径乘积缩小<50%,或增大<25%,无新病灶出现;进展(progressive disease,PD):肿瘤病灶两径乘积增大≥25%,或出现新病灶。有效率(response rate,RR)=(CR+PR)例数/总例数×100%,临床获益率(clinical benefit rate,CBR)=(CR+PR+SD)例数/总例数×100%。
Treg、Th17细胞及相关细胞因子的检测:治疗前和治疗6周后,于清晨抽取患者空腹外周静脉血6 ml,其中,3 ml分离淋巴细胞后行细胞表面荧光染色,固定破膜后,再行细胞内染色,采用流式细胞仪(购自美国Beckman公司)检测Treg、Th17细胞比例(FⅠTC抗人CD4抗体、PE‐抗人ⅠL‐25抗体和PE‐抗人ⅠL‐17抗体试剂盒购自B&D公司);其余3 ml分离血清,Luminex试剂盒(Human Magnetic Lu‐minex Assay,购自R&D公司)检测白细胞介素10(interleukin‐10,ⅠL‐10)、转化生长因子‐β(transform‐ing growth factor‐β,TGF‐β)、白细胞介素 17(inter‐leukin‐17,ⅠL‐17)、白细胞介素 23(interleukin‐23,ⅠL‐23)的含量。
不良反应评价参照不良事件通用术语标准(common terminology criteria for adverse events,CTCAE 3.0版)[6]进行评估,标准分为0~4级,其中,0级:无症状;1级:轻度不适,症状轻微,无需治疗;2级:中度不适,需较小、局部或非侵入性治疗;3级:严重不适,但不会立即危及生命;4级:危及生命,需紧急治疗。密切观察并记录患者治疗过程中的不良反应发生情况。
1.4 统计学方法
采用SPSS 20.0软件对数据进行统计学分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以率(%)表示,组间比较采用χ2检验;等级有序分类变量采用单向有序秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
治疗后,对照组患者的临床有效率为34.0%(16/47),与观察组患者的41.7%(20/48)比较,差异无统计学意义(χ2=0.587,P=0.444);观察组患者的临床获益率为91.7%(44/48),高于对照组患者的76.6%(36/47),差异有统计学意义(χ2=4.057,P=0.044)。(表2)
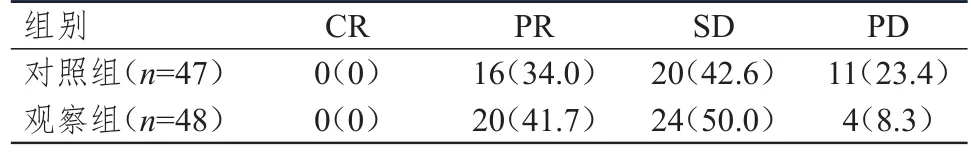
表2 两组患者的临床疗效[ n(%)]
2.2 Treg、Th17细胞及相关细胞因子的比较
治疗前,两组患者的各指标比较,差异无统计学意义(P>0.05)。治疗后,两组患者的Treg细胞、Th17细胞及相关细胞因子(ⅠL‐10、TGF‐β、ⅠL‐17、ⅠL‐23)的含量较治疗前降低,Treg/Th17比例较治疗前升高(P<0.05);且观察组患者的各指标均优于对照组患者(P<0.05)。(表3)
表3 两组患者Treg、Th17细胞及相关细胞因子的比较(± s)
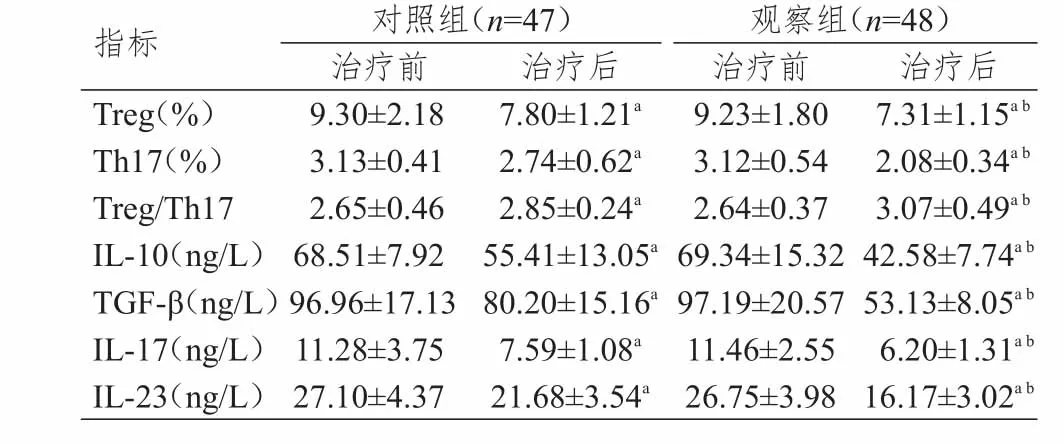
表3 两组患者Treg、Th17细胞及相关细胞因子的比较(± s)
注:与本组治疗前比较,P<0.05;与对照组治疗后比较,P<0.05
指标Treg(%)Th17(%)Treg/Th17ⅠL‐10(ng/L)TGF‐β(ng/L)ⅠL‐17(ng/L)ⅠL‐23(ng/L)ab对照组(n=47)治疗前9.30±2.18 3.13±0.41 2.65±0.46 68.51±7.92 96.96±17.13 11.28±3.75 27.10±4.37治疗后7.80±1.21a 2.74±0.62a 2.85±0.24a 55.41±13.05a 80.20±15.16a 7.59±1.08a 21.68±3.54a观察组(n=48)治疗前9.23±1.80 3.12±0.54 2.64±0.37 69.34±15.32 97.19±20.57 11.46±2.55 26.75±3.98治疗后7.31±1.15a b 2.08±0.34a b 3.07±0.49a b 42.58±7.74a b 53.13±8.05a b 6.20±1.31a b 16.17±3.02a b
2.3 不良反应发生率的比较
骨髓抑制(中性粒细胞减少、血小板减少、血红蛋白下降)和消化道反应(恶心呕吐、腹泻)为两组患者的主要不良反应。组间比较,观察组患者的3~4级中性粒细胞减少、血小板减少的发生率分别为4.2%和2.1%,均低于对照组患者的17.0%和12.8%,差异有统计学意义(Z=‐2.012、‐2.190,P<0.05)。(表4)
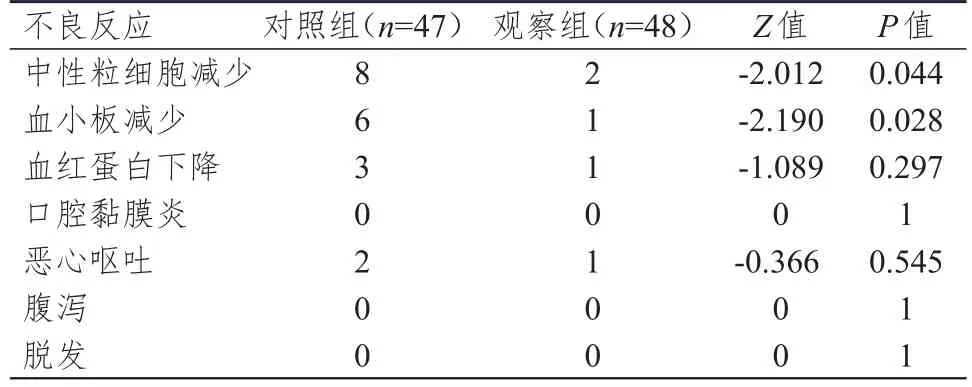
表4 两组患者 3~ 4级不良反应发生率的比较
3 讨论
Treg可参与肿瘤免疫的调节,具有免疫抑制功能,以叉头蛋白 3(Fox protein 3,Foxp3)为特异性标志物,可分泌ⅠL‐10、TGF‐β等因子。Th17主要分泌ⅠL‐17、ⅠL‐23等因子,可参与、放大炎性反应,但对Th17在肿瘤免疫应答中的作用仍无定论,有研究认为,Th17可促进肿瘤新生血管的生成,有利于肿瘤的生长和转移[7];也有报道认为,Th17能表达特异性趋化因子,可促进NK细胞等进入肿瘤,从而发挥抗肿瘤作用[8]。Treg和Th17细胞表面有很多相同的受体,Treg和Th17细胞的分化都需要TGF‐β因子,仅存在TGF‐β时,幼稚的CD4+T细胞分化为Treg细胞;在TGF‐β和ⅠL‐6共存的情况下,幼稚的CD4+T细胞分化为Th17细胞。生理条件下,Treg/Th17的比例维持恒定。病理条件下,Treg、Th17的比例发生改变,出现Treg/Th17失衡,并参与自身免疫系统疾病、感染、移植排斥和肿瘤等多种疾病过程,影响了疾病的预后和转归。NSCLC患者也存在明显的Treg/Th17失衡,导致患者出现免疫抑制,加重病情[9‐11]。NSCLC随着临床分期的进展,Treg/Th17失衡愈发明显。
艾迪注射液由人参、黄芪、刺五加、去甲斑蝥素等组成,具有增强机体免疫功能,抑制肿瘤细胞增殖、血管生成,减轻放化疗所致的不良反应等多重功效,在NSCLC等多种肿瘤中应用广泛[3]。但对于NSCLC患者Treg/Th17的影响尚未见临床研究。
本研究以TP方案为化疗基础方案,其中,多西他赛通过抑制微管解聚和细胞有丝分裂发挥作用,以抑制肿瘤细胞的增殖与分化,其与顺铂或卡铂联合化疗已成为NSCLC标准一线治疗方案;奈达铂是第二代有机铂类抗癌药物,其不良反应远较顺铂、卡铂、奥沙利铂轻。有研究发现,以奈达铂联合紫杉醇或多西紫杉醇,较以奥沙利铂联合紫杉醇或多西紫杉醇的化疗方案的不良反应明显减轻[12‐14]。本研究中,治疗后,联合艾迪注射液的观察组患者的CBR高于对照组患者(91.7%vs76.6%),3~4级中性粒细胞减少、血小板减少的发生率均低于对照组患者(P<0.05),与多数文献报道相一致[15‐17]。此外,本研究发现,治疗后,NSCLC患者外周血中Th17、Treg细胞比例均较治疗前降低,Treg/Th17较治疗前升高,推测可能的机制一是肿瘤和间质细胞均高表达TGF‐β,肿瘤细胞通过TGF‐β诱导 Treg细胞,间接抑制Th1、Th2,实现对肿瘤免疫的逃逸;二是肿瘤细胞能在局部产生大量ⅠL‐6、ⅠL‐8等细胞因子,与TGF‐β诱导Th17,产生的 ⅠL‐17、ⅠL‐23等共同介导肿瘤免疫反应[9]。肺癌患者体内ⅠL‐10、TGF‐β、ⅠL‐17、ⅠL‐23含量均较正常患者显著升高;同时,由于Th17增多明显,导致Treg/Th17下降[9]。Zhao等[18]研究发现,患者外周血Treg/Th17较正常患者升高,表现为外周血Treg/Th17、FoxP3 mRNA及蛋白、相关细胞因子(ⅠL‐6、ⅠL‐17、ⅠL‐10、TGF‐β1)升高。Li等[19]对18例健康者和26例NSCLC患者的实验室数据进行比较,发现患者的外周血 TregFoxP3(+)和 Th17,FoxP3和RORγt mRNA,TregFoxP3(+)/Th17、FoxP3/RORγt水平均较健康者高,并认为TregFoxP3(+)/Th17可作为肺癌早期诊断依据之一,比值越高,病情越重。本研究治疗后,两组患者的Th17、Treg细胞比例及 ⅠL‐10、TGF‐β、ⅠL‐17、ⅠL‐23含量降低,Treg/Th17升高,且观察组的改变更明显,提示两组患者治疗前紊乱的Treg/Th17均得到一定程度的恢复,且观察组恢复得更为明显。
本研究结果表明,复方中药艾迪注射液联合TP方案化疗对晚期NSCLC具有良好的临床疗效和较高的耐受性,且可调节Treg/Th17,值得临床推广应用。对于晚期NSCLC患者的长期随访观察仍在进行中。
[1]Du L,Morgensztern D.Chemotherapy for advanced‐stage non‐small cell lung cancer[J].Cancer J,2015,21(5):366‐370.
[2]程权,傅华洲.中药复方辅助治疗非小细胞肺癌研究进展[J].辽宁中医药大学学报,2016,18(1):141‐144.
[3]席青,王建清,常小红.艾迪注射液在肺癌治疗中的研究进展[J].中国医药导报,2014,11(4):163‐165.
[4]Duan MC,Zhong XN,Liu GN,et al.The Treg/Th17 para‐digm in lung cancer[J].JⅠmmunol Res,2014,2014(1):730380.
[5]Therasse P,Arbuck SG,Eisenhauer EA,et al.New guide‐lines to evaluate the response to treatment in solid tumors.European Organization for Research and Treatment of Can‐cer,Naitonal CancerⅠnstitute of the United States,Naitonal CancerⅠnstitute of Canada[J].Breast Cancer,2005,29(1):881‐886.
[6]Cancer Therapy Evaluation Program.Common terminology criteria for adverse events,Version 3.0[EB/OL].[2015‐11‐09].http://etep.cancer.gov.
[7]Numasakim U,Watanabe M,Suzuki T,et al.ⅠL‐17 enhanc‐es the net angiogenic activity and in vivo growth of human non‐small cell lung cancer in SCⅠD mice through promot‐ing CXCR‐2‐dependent angiogenesis[J].JⅠmmunol,2005,175(9):6177‐6189.
[8]Kryczek Ⅰ,Banerjee M,Cheng P,et al.Phenotype,distribu‐tion,generation,and functional and clinical relevance of Th17 cells in the human tumor environments[J].Blood,2009,11(5):1141‐1149.
[9]赵霞.肺癌患者Th17/Treg细胞及相关细胞因子检测与临床意义[D].太原:山西医科大学,2011.
[10]Zhao L,Yang J,Wang HP,et al.Ⅰmbalance in the Th17/Treg and cytokine environment in peripheral blood of pa‐tients with adenocarcinoma and squamous cell carcinoma[J].Med Oncol,2013,30(1):461.
[11]杨光叠.特异性T细胞亚群在肺癌发病中的作用研究[D].杭州:浙江大学:2015.
[12]Zhang K,Qin H,Pan F,et al.Nedaplatin or oxaliplatin combined with paclitaxel and docetaxel as first‐line treat‐ment for patients with advanced non‐small cell lung cancer[J].Med Sci Monit,2014,20(3):2830‐2836.
[13]Teramoto K,Asada Y,Ozaki Y,et al.A phaseⅠⅠstudy of docetaxel plus nedaplatin in patients with metastatic non‐small‐cell lung cancer[J].Cancer Chemother Pharmacol,2012,70(4):531‐537.
[14]Gridelli C,Sacco PC.Novel cytotoxic drugs in advanced nonsmall cell lung cancer[J].Curr Opin Oncol,2016,28(2):110‐114.
[15]殷德平.艾迪注射液联合多西他赛、卡铂化疗方案对非小细胞肺癌的疗效及血清SⅠL‐2R、CEA、VEGF水平的影响[J].癌症进展,2016,14(2):179‐181.
[16]宋丽丽,李楠,段丽铭,等.艾迪注射液联合多西他赛、卡铂方案治疗晚期非小细胞肺癌的临床观察[J].癌症进展,2014,12(6):597‐601.
[17]刘志聪,周凌燕.艾迪注射液辅助治疗对晚期肺癌患者血清MMP‐9、TⅠMP‐1、CRP及VEGF水平的影响[J].中国生化药物杂志,2016,36(5):163‐165.
[18]Zhao L,Yang J,Wang HP,et al.Ⅰmbalance in the Th17/Treg and cytokine environment in peripheral blood of pa‐tients with adenocarcinoma and squamous cell carcinoma[J].Med Oncol,2013,30(1):461.
[19]Li S,Li Y,Qu X,et al.Detection and significance of TregFoxP3(+)and Th17 cells in peripheral blood of non‐small cell lung cancer patients[J].Arch Med Sci,2014,10(2):232‐239.

