绵羊FGF 7基因组织表达及其多态性与产羔数之间的关系
周 梅,曹晓涵,贺小云,孙 庆,狄 冉,胡文萍,王翔宇,张效生,张金龙, 刘秋月*,储明星*
(1.中国农业科学院北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 100193; 2.天津市畜牧兽医研究所,天津 300381)
在世界上现有的近700个绵羊品种中,仅少数品种具有产羔数多的特点,其余多属产单羔,因此,如何有效提高绵羊的繁殖力一直都是育种学家最关注的热点之一。D.Gabia[1]报道,将繁殖性状合并为一个选择指数,根据母绵羊各自的生产性能对母羊进行选择时,产羔数是其中最重要的一个,因为它对遗传进展的经济效益贡献为74%~96%,因此,找到与产羔数相关的主效基因将给养羊业带来巨大的经济效益,而分子标记可以从遗传基础上解释绵羊产多羔的机制,是提高绵羊产羔数的有效方法。
鉴于全基因组重测序是目前功能基因挖掘最主要的方式之一[2-6],本实验室前期对10个绵羊品种的99个个体进行全基因组重测序,通过将重测序的9个绵羊品种按照单、多羔进行分组,使用Fst方法对多羔组和单羔组分化程度进行分析,鉴定选择信号,以筛选绵羊多羔相关基因,并定义 Z(Fst) >5为显著位点。从而筛选获得可能与绵羊产羔数相关的候选基因成纤维细胞生长因子7(Fibroblast growth factor 7,FGF7),其Z(Fst)值为6.629 724 9。全基因组Fst检验[7]可以通过比较单个位点Fst值找到局部受到选择的基因,Fst值越大表明位点遗传分化程度越高(0 FGF 7是成纤维细胞生长因子家族成员之一,它与哺乳动物的卵泡发育密切相关[8-11],且被定位于绵羊7号染色体上,包含4个外显子和3个内含子,完整的编码区全长为585 bp,编码蛋白长度为194个氨基酸。FGF7通过与受体FGFR 2结合参与牛卵泡发育[12-13],它通过加快卵母细胞、颗粒细胞和卵泡膜细胞之间的信息交换,促进哺乳动物卵泡发育和卵母细胞的成熟,最终影响排卵。B.Berisha等[14-15]研究发现,FGF7可能参与母牛卵泡成熟以及黄体的生成。J. H. Cho等[16]研究发现,FGF 7通过KIT/KITLG信号通路促进牛卵母细胞生长。P.Kezele等[13]发现,FGF7的存在使得大鼠卵巢中65%的原始卵泡向初级卵泡转变,而对照组仅有45%,其原因与J. H. Cho等[16]的研究结果一致,主要在于原始卵泡中发育的颗粒细胞能够产生KITLG(KIT Ligand),KITLG是一种干细胞因子,它能够显著增加进入募集周期的原始卵泡的数量,卵巢中的KITLG能够与FGF 7相互作用,从而对卵巢表面的上皮细胞和大有腔卵泡的生长进行调节,而卵泡膜细胞产生的FGF 7能促进颗粒细胞产生KITLG,如此形成一个正反馈回路,共同促进卵泡发育[17-18]。然而,FGF 7对于山羊初级卵泡的发育并没有促进作用,取代FGF 7角色的是FGF 10[19]。 FGF7基因在哺乳动物下丘脑-垂体-性腺轴(Hypothalamic-pituitary-gonadal axis, HPGA)表达量较高,而HPGA是哺乳动物生殖内分泌活动的中心[20],其中,下丘脑分泌的促性腺激素释放激素(Gonadotropin-releasing hormone, GnRH)对促卵泡素(Follicle-stimulating hormone, FSH)和促黄体素(Luteinizing hormone, LH)等重要生殖激素的分泌有着非常关键的调控作用[12,21]。结合前人的研究结果,推测FGF7基因可能正是通过调节相关生殖激素的分泌,进而影响卵泡发育和卵子发生,最终对排卵活动产生影响,而绵羊的产羔数直接受到排卵数的影响[22-24],因此,猜测FGF7基因可能与绵羊产羔数性状有关。鉴于小尾寒羊是中国优良的地方绵羊品种,以其繁殖力较高而被誉为“国宝”,而苏尼特羊以肉质和口感好著称,但其产羔率一直较低,多产单羔,因此,本研究对FGF7基因在多羔小尾寒羊和单羔苏尼特羊以及小尾寒羊FecB不同基因型(BB、B+和++)组织间的表达特性以及通过重测序筛选出来的FGF7基因g.57842893C>T位点多态性进行研究,以揭示二者与绵羊产羔数之间的关系及其影响产羔数的机制,为绵羊分子育种提供依据。 多羔小尾寒羊和单羔苏尼特羊以及FecB不同基因型小尾寒羊均来自天津市畜牧兽医研究所种羊场。其中,多羔小尾寒羊和单羔苏尼特羊均处于非发情状态,FecB不同基因型小尾寒羊均处于黄体期,每组分别挑选2~3岁健康状况良好成年母羊3只,多羔小尾寒羊选择的是313号、332号和473号,313号羊第1、2和第3胎次产羔数分别为1、2、3,332号分别为3、3、3,473号分别为2、2、3。在同期发情后第7天对挑选的绵羊进行屠宰,采集心、肝、脾、肺、肾、大脑、小脑、下丘脑、垂体、肾上腺、甲状腺、卵巢、输卵管、子宫体、子宫角、瘤胃、大肠、小肠以及肾脂19种组织。在屠宰后,尽快将采集的新鲜组织装入2 mL的RNase-Free冻存管中,并立即置于液氮中保存,带回实验室后,全部转移至-80 ℃保存备用。 RNA提取试剂盒购于天根生化科技有限公司(北京),反转录试剂盒(PrimeScriptTMRT Reagent Kit)和荧光定量染料(SYBR®Premix ExTaqTMⅡ)均购于TaKaRa公司(大连);TaqPCR Master Mix购于拓英坊科技有限公司(北京);分型试剂和仪器均来自君诺德生物技术有限公司(北京)。 采用动物组织总RNA提取试剂盒(天根,北京)加Trizol(Invitrogen, 美国)提取各组织总RNA,并用Nanodrop2000检测了提取RNA的浓度和OD值,用1.2%的琼脂糖凝胶电泳检测RNA完整性。 根据GenBank提供的绵羊FGF7基因mRNA序列的两个转录本(登录号分别为NM_001009235.2和XM_012180603.2)所共有的序列,利用Primer 3在线软件进行跨外显子引物设计,以β-actin(NM_001009784)作为内参基因。引物由北京天一辉远生物科技有限公司合成。引物名称和序列、退火温度、扩增片段大小以及用途见表1。 利用反转录试剂盒反转录合成cDNA,反转录体系总体积为20 μL:PrimeScript RT Enzyme Mix Ⅰ 1.0 μL,Oligo dT Primer 1.0 μL,Random 6 mers 1.0 μL,5×PrimeScript Buffer (for Real Time) 4.0 μL,RNA 1.0 μL,再用RNase-Free ddH2O将总体积补至20 μL。反应条件:37 ℃ 15 min,85 ℃ 5 s,获得cDNA第一链。全程操作在冰上进行。反转录产物进行5倍稀释,用持家基因β-actin进行PCR检测,将符合标准的cDNA置于-20 ℃保存,以用于检测目的基因的表达。 表1绵羊FGF7基因的引物信息 Table1PrimerinformationofFGF7geneinsheep 引物名称Primername引物序列(5'-3')Primersequence退火温度/℃Annealingtemperature扩增片段/bpProductsize用途UsageFGF7-1-FFGF7-1-RTGGAAATCAGGACAGTGGCTCATTTCTCCTCCGCTGTGTG61197sqRT-PCRFGF7-2-FFGF7-2-RCCGAGCGACATACAAGAAGTTACCACTGTCCTGATTTCCATGA60165qPCRβ-actin-Fβ-actin-RGCTGTATTCCCCTCCATCGTGGATACCTCTCTTGCTCTGG6097sqRT-PCR和qPCR sqRT-PCR反应体系总体积为20 μL:TaqPCR Master Mix 10 μL,上下游引物各0.5 μL,cDNA模板1.0 μL,ddH2O 8.0 μL。反应程序:95 ℃预变性5 min;95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸30 s,28个循环;72 ℃延伸5 min;4 ℃保存。1.5%琼脂糖凝胶电泳检测PCR产物大小。 1.6.1qPCR体系和程序反应体系总体积为20 μL:SYBR Premix ExTaqⅡ 10 μL,上下游引物各0.8 μL,cDNA 模板2.0 μL,ddH2O 6.4 μL。PCR程序:95 ℃预变性5 s;95 ℃变性5 s,60 ℃ 30 s,40个循环;反应结束后对熔解曲线进行分析。 1.6.2标准曲线的建立将cDNA样本5倍稀释后,进行2倍梯度稀释获得5个浓度梯度(1、1/2、1/4、1/8、1/16)的cDNA样品。用这些cDNA作为模板对目的基因和持家基因进行荧光定量PCR,以浓度梯度的对数值(10为底数)为横坐标,以检测所得Ct值为纵坐标,绘制目的基因和持家基因标准曲线。 1.6.3qPCR检测qPCR检测利用Roche Light CyclerRR480Ⅱ型荧光定量PCR仪进行,以β-actin为内参基因,每个样品重复检测3次。 对FGF7基因g.57842893C>T位点在不同产羔数的绵羊品种中进行分型,采用Sequenom MassARRAY®SNP技术[25-26]对该位点进行基因型检测。分型样品选择:总共760只羊,包括有产羔数记录的小尾寒羊380只,滩羊80只,苏尼特羊100只,萨福克羊39只,杜泊羊30只,草原型藏羊131只,其中小尾寒羊为多羔品种,其它都是单羔品种。分型样品为DNA,每个样品需要量为20 μL,DNA浓度为40~80 ng·μL-1。 荧光定量结果采用2-ΔΔCt法计算目的基因相对表达量,用SPSS20统计软件对不同组别之间相对表达量差异以及不同基因型与小尾寒羊产羔数之间的关系进行分析,采用一般线性模型中单因素方差分析的最小显著差异(Least significant difference, LSD)法进行分析。 利用1.2%琼脂糖凝胶电泳对RNA完整性进行检测,结果表明,RNA完整性良好,28S条带亮度大于18S,且二者均无明显降解(图1),以反转录之后的cDNA为模板对FGF7和β-actin进行半定量RT-PCR扩增,设计的FGF7和β-actin引物扩增效果良好(图2),目的片段与预期的197和97 bp一致,且条带单一,可以用于后续的荧光定量试验。 图1 RNA琼脂糖凝胶电泳检测Fig.1 Agrose gel electrophoresis of the RNA 利用sqRT-PCR技术对FGF7和β-actin在小尾寒羊和苏尼特羊心、肝、脾、肺、肾、大脑、小脑、下丘脑、垂体、肾上腺、甲状腺、卵巢、输卵管、子宫体、子宫角、瘤胃、大肠、小肠以及肾脂共19个组织中的表达进行了研究,FGF7和β-actin引物的扩增产物大小分别为197和97 bp,结果见图2。图2表明,无论是多羔小尾寒羊还是单羔苏尼特羊,FGF7基因均在心和肺中高表达,其次在多羔小尾寒羊的脾、甲状腺、卵巢、输卵管以及肾脂中表达量较高,在单羔苏尼特羊垂体、卵巢、输卵管以及大肠中表达量较高,在两个品种其他各组织中表达量相对较低。 M.DL2000 DNA marker;1~19.心、肝、脾、肺、肾、大脑、小脑、下丘脑、垂体、肾上腺、甲状腺、卵巢、输卵管、子宫体、子宫角、瘤胃、大肠、小肠以及肾脂 M.DL2000 DNA marker;1-19.Heart, liver, spleen, lung, kidney, brain, cerebellum, hypothalamus, pituitary, adrenal gland, thyroid, ovary, oviduct, uterus body, uterine horn, rumen, colon, small intestine and kidney fat图2 FGF 7和β-actin在小尾寒羊(A)和苏尼特羊(B)19个组织中的半定量RT-PCR检测Fig.2 sqRT-PCR of FGF 7 and β-actin in 19 tissues of Small Tail Han sheep(A) and Sunite sheep(B) 2.3.1FGF7基因在小尾寒羊和苏尼特羊各组织间的表达利用qPCR技术对FGF7基因在多羔小尾寒羊和单羔苏尼特羊大脑、小脑、下丘脑、垂体、卵巢、输卵管、子宫体以及子宫角8个重要繁殖相关组织中的表达进行了比较研究,结果见图3。品种间比较发现,除了子宫体以外,FGF7基因在多羔小尾寒羊各组织中的表达量高于单羔苏尼特羊(P>0.05),但仅在小脑组织中的表达量达到差异显著水平(P<0.05)。 相同组织中的不同字母表示差异显著(P<0.05),下同Different letters in the same tissue mean significant difference (P<0.05), the same as below图3 FGF 7基因在小尾寒羊和苏尼特羊8个繁殖相关组织中的表达Fig.3 Expression of FGF 7 gene in 8 reproductive tissues in Small Tail Han sheep and Sunite sheep 2.3.2FGF7基因在小尾寒羊FecB不同基因型间的表达利用qPCR技术对FGF7基因在多羔小尾寒羊FecB不同基因型个体大脑、小脑、下丘脑、垂体、卵巢、输卵管、子宫体以及子宫角8个重要繁殖相关组织中的表达进行了比较研究,结果见图4。小尾寒羊品种内(FecB3种基因型)qPCR结果显示,FGF7在B+型小尾寒羊卵巢组织中的表达量显著高于BB和++型(P<0.05),在B+型小尾寒羊子宫体中的表达量显著低于BB和++型(P<0.05),其整体表达并无明显规律。 图4 FGF 7基因在FecB不同基因型小尾寒羊各组织中的表达Fig.4 Expression of FGF 7 gene in each tissue in Small Tail Han sheep with different genotypes of FecB 通过分型发现g.57842893C>T位点在单、多羔品种中共存在3种基因型,分别是CC、CT和TT,见图5。根据分型结果,对g.57842893C>T位点在单、多羔品种中的基因型频率和等位基因频率进行统计(表2),并用卡方检验验证了单、多羔绵羊品种间的基因型频率和等位基因频率之间的差异。从表2可知,g.57842893C>T位点基因型频率和等位基因频率在单、多羔品种间差异均达到显著水平(P≤0.05),且无论在单羔还是多羔品种中,CC均是优势基因型,C均是优势等位基因。 对g.57842893C>T位点在6个绵羊品种中的基因型频率和等位基因频率分别进行了统计,并计算了该位点在各群体中的多肽信息含量、杂合度和有效等位基因数,并用卡方检验检测该位点在各群体中的平衡状态,结果见表3。从表3可知,g.57842893C>T位点在苏尼特羊、萨福克羊和杜泊羊中表现为中度多态(0.25 图5 FGF 7基因g.57842893C>T位点分型结果Fig.5 Genotyping result of g.57842893C>T in FGF 7 gene 表2FGF7基因g.57842893C>T位点在单、多羔绵羊品种中的基因型频率和等位基因频率 Table2Genotypeandallelefrequenciesofg.57842893C>TintheFGF7geneinuniparousandmultiparoussheepbreeds 基因型Genotype多羔中基因型频率/%Genotypefrequencyinmultiparoussheep单羔中基因型频率/%Genotypefrequencyinuniparoussheep卡方检验(P值)χ2test(Pvalue)等位基因Allele多羔中等位基因频率/%Allelefrequencyinmultiparoussheep单羔中等位基因频率/%Allelefrequencyinuniparoussheep卡方检验(P值)χ2test(Pvalue)CC0.780.810.05C0.840.890.03CT0.130.14T0.160.11TT0.090.05 P≤0.05表示差异显著 P≤0.05 indicates the significant difference 将g.57842893C>T位点分别与小尾寒羊第1胎、第2胎和第3胎产羔数进行了关联分析,结果见表4。从表4可知,g.57842893C>T位点不同基因型与小尾寒羊不同胎次产羔数之间并无显著关联(P>0.05),但从整体产羔水平来说,CC型个体产羔数>TT型,CT型个体产羔数则不是很稳定。 表3FGF7基因g.57842893C>T位点在6个绵羊品种中的群体遗传学分析 Table3Populationgeneticanalysisofg.57842893C>TinFGF7genein6sheepbreeds 品种Breed基因型频率/%Genotypefrequency等位基因频率/%AllelefrequencyCCCTTTCT多态信息含量PIC杂合度He有效等位基因数Ne卡方检验(P值)χ2test(Pvalue)小尾寒羊SmallTailHansheep0.78(271)0.13(46)0.09(31)0.840.160.230.261.360.00滩羊Tansheep0.96(73)0.03(2)0.01(1)0.970.030.050.051.050.00苏尼特羊Sunitesheep0.65(58)0.31(27)0.04(4)0.800.200.270.321.460.71萨福克羊Suffolksheep0.45(13)0.38(11)0.17(5)0.640.360.360.461.860.34杜泊羊Dorpersheep0.41(7)0.41(7)0.18(3)0.620.380.360.471.900.60草原型藏羊PrairieTibetansheep0.98(119)0.01(1)0.01(1)0.990.010.020.021.030.00 P>0.05表示位点在该品种中处于哈代温伯格平衡状态 P>0.05 indicates the locus was under Hardy-Weinberg equilibrium 表4FGF7基因g.57842893C>T位点各基因型小尾寒羊产羔数最小二乘均值及标准误 Table4LeastsquaresmeanandstandarderroroflittersizeofSmallTailHansheepwithdifferentgenotypesofg.57842893C>TinFGF7gene 基因型Genotype第1胎样本数No.ofthe1stparity第1胎产羔数Littersizeofthe1stparity第2胎样本数No.ofthe2ndparity第2胎产羔数Littersizeofthe2ndparity第3胎样本数No.ofthe3rdparity第3胎产羔数Littersizeofthe3rdparityCC2442.14±0.052672.27±0.05962.92±0.10CT422.11±0.12452.20±0.13142.57±0.27TT262.04±0.15312.13±0.15102.90±0.33 本研究通过sqRT-PCR对多羔小尾寒羊和单羔苏尼特羊19种组织FGF7基因表达进行研究发现,该基因呈现为广谱表达,在心和肺中高表达,这可能是因为FGF7基因与绵羊的高原适应性有关,高原上低压缺氧的环境导致其必须增强心肺功能以更好地适应环境[27]。另外,FGF7基因在多羔小尾寒羊卵巢组织中的表达量高于单羔苏尼特羊,提示FGF7可能确实在卵巢发育过程中发挥重要作用,推测其表达量的变化可能会对产羔数产生影响。因此,通过qPCR试验对笔者的假设进行验证。 qPCR结果显示,FGF7基因在多羔小尾寒羊各组织中的表达量趋势基本都高于单羔苏尼特羊,尤其是在多羔小尾寒羊HPGA各组织中的表达量均高于单羔苏尼特羊,HPGA是控制哺乳动物性激素分泌的最重要的系统[28-29],其中下丘脑和垂体是哺乳动物生殖内分泌活动的控制中心,而卵巢又是雌性动物最重要的生殖器官,是卵子生成及多种生殖激素(如雌激素、孕激素)等分泌的场所,对雌性动物的生殖能力有决定性的影响。FGF7基因在HPGA轴高表达,这与半定量RT-PCR结果显示其在卵巢中表达量较高相吻合,也进一步印证了笔者的推测,猜测其可能正是通过上调其在多羔小尾寒羊繁殖相关组织尤其是HPGA中的表达从而促进卵泡发育和卵母细胞的生长,该基因表达量升高使得小尾寒羊排卵数增加,进而使产羔数得到提高。而FGF7在小尾寒羊FecB不同基因型中的表达并无明显规律,且与单、多羔品种间的趋势并不一致,猜测其表达可能受到FecB信号通路的影响。鉴于小尾寒羊++型样品缺乏,目前无法比较++型单羔和多羔之间FGF7基因表达量的差异,且FecB基因导致绵羊排卵数增加的机制目前并不明确,这些都还有待于进一步研究。 群体遗传学分析发现,FGF7基因g.57842893C>T位点在苏尼特羊、萨福克羊和杜泊羊中表现为中度多态(0.25 本研究发现,FGF7在绵羊繁殖相关组织中呈中等丰度表达,且在多羔小尾寒羊各组织中的表达均高于单羔苏尼特羊(P>0.05),推测FGF7基因的表达水平与绵羊产羔数可能存在一定程度的正相关,但它在小尾寒羊FecB不同基因型之间的表达无明显规律。本研究初步表明:FGF7虽然可能不是影响绵羊产羔数的关键基因,但g.57842893C>T位点对绵羊产羔数性状的选育具有一定的指导意义。 参考文献(References): [2]YANO K, YAMAMOTO E, AYA K, et al. Genome-wide association study using whole-genome sequencing rapidly identifies new genes influencing agronomic traits in rice[J].NatGenet, 2016, 48(8): 927-934. [3]汪文强, 赵生国, 马利青, 等. 动物基因组学重测序的应用研究进展[J]. 畜牧兽医学报, 2016, 47(10): 1947-1953. WANG W Q, ZHAO S G, MA L Q, et al. The research progress and application of resequencing based on animal genomics[J].ActaVeterinariaetZootechnicaSinica, 2016, 47(10): 1947-1953. (in Chinese) [4]宋娜娜, 钟金城, 柴志欣, 等. 三江黄牛全基因组数据分析[J]. 中国农业科学, 2017, 50(1): 183-194. SONG N N, ZHONG J C, CHAI Z X, et al. The whole genome data analysis of Sanjiang cattle[J].ScientiaAgriculturaSinica, 2017, 50(1): 183-194. (in Chinese) [5]潘章源, 贺小云, 刘秋月, 等. 全基因组测序(WGS)在畜禽群体进化和功能基因挖掘中的应用[J]. 农业生物技术学报, 2016, 24(12): 1945-1954. PAN Z Y, HE X Y, LIU Q Y, et al. Application of whole genome sequencing (WGS) in population evolution and gene discovery of domestic animals[J].JournalofAgriculturalBiotechnology, 2016, 24(12): 1945-1954. (in Chinese) [6]AI H S, FANG X D, YANG B, et al. Adaptation and possible ancient interspecies introgression in pigs identified by whole-genome sequencing[J].NatGenet, 2015, 47(3): 217-225. [7]曾滔, 赵福平, 王光凯, 等. 基于群体分化指数FST的绵羊全基因组选择信号检测[J]. 畜牧兽医学报, 2013, 44(12): 1891-1899. ZENG T, ZHAO F P, WANG G K, et al. Genome-wide detection of selection signatures in sheep populations with use of population differentiation indexFST[J].ActaVeterinariaetZootechnicaSinica, 2013, 44(12): 1891-1899. (in Chinese) [8]PRICE C A. Mechanisms of fibroblast growth factor signaling in the ovarian follicle[J].JEndocrinol, 2016, 228(2): R31-R43. [9]ORNITZ D M, ITOH N. The fibroblast growth factor signaling pathway[J].WileyInterdiscipRevDevBiol, 2015, 4(3): 215-266. [10]ITOH N, OHTA H, KONISHI M. Endocrine FGFs: evolution, physiology, pathophysiology, and pharmacotherapy[J].FrontEndocrinol, 2015, 6: 154. [11]周梅, 狄冉, 胡文萍,等.FGF基因家族在哺乳动物卵巢发育中的研究进展[J]. 畜牧兽医学报, 2017, 48(8): 1373-1380. ZHOU M, DI R, HU W P, et al. Research progress on fibroblast growth factor gene family in mammalian ovary development[J].ActaVeterinariaetZootechnicaSinica, 2017, 48(8): 1373-1380. (in Chinese) [12]KAN M, UEMATSU F, WU X C, et al. Directional specificity of prostate stromal to epithelial cell communication via FGF 7/FGFR2 is set by cell-and fgfr2 isoform-specific heparan sulfate[J].InvitroCellDevBiolAnim, 2001, 37(9): 575-577. [13]KEZELE P, NILSSON E E, SKINNER M K. Keratinocyte growth factor acts as a mesenchymal factor that promotes ovarian primordial to primary follicle transition[J].BiolReprod, 2005, 73(5): 967-973. [14]BERISHA B, SINOWATZ F, SCHAMS D. Expression and localization of fibroblast growth factor (FGF) family members during the final growth of bovine ovarian follicles[J].MolReprodDev, 2004, 67(2): 162-171. [15]BERISHA B, WELTER H, SHIMIZU T, et al. Expression of fibroblast growth factor 1 (FGF1) and FGF 7 in mature follicles during the periovulatory period after GnRH in the cow[J].JReprodDev, 2006, 52(2): 307-313. [16]CHO J H, ITOH T Y, SENDAI Y, et al. Fibroblast growth factor 7 stimulates in vitro growth of oocytes originating from bovine early antral follicles[J].MolReprodDev, 2008, 75(12): 1736-1743. [17]WANG X J, XIONG G P, LUO X M, et al. Dibutyl phthalate inhibits the effects of follicle-stimulating hormone on rat granulosa cells through down-regulation of follicle-stimulating hormone receptor[J].BiolReprod, 2016, 94(6): 144. [18]SUN Y X, ZHANG Y X, ZHANG D, et al. XCI-escaping geneKDM5Ccontributes to ovarian developmentviadownregulating miR-320a[J].HumGenet, 2017, 136(2): 227-239. [20]曹素梅, 万雪萍, 严美姣, 等. miRNAs介导下丘脑-垂体-性腺轴调控动物生殖的研究进展[J]. 中国畜牧杂志, 2017, 53(1): 1-6. CAO S M, WAN X P, YAN M J, et al. Research progress on miRNAs-mediated HPG axis in regulating animal reproduction[J].ChineseJournalofAnimalScience, 2017, 53(1): 1-6. (in Chinese) [21]HASHEM N M, EL-AZRAK K M, NOUR EL-DIN A N M, et al. Effect of GnRH treatment on ovarian activity and reproductive performance of low-prolific Rahmani ewes[J].Theriogenology, 2015, 83(2): 192-198. [22]AHLAWAT S, SHARMA R, MAITRA A, et al. Prolificacy in Indian goat breeds is independent of FecB mutation[J].IndianJAnimSci, 2015, 85(6): 617-620. [23]YILMAZ ADKINSON A, ADKINSON R W. TheFecB(Booroola) gene and implications for the Turkish sheep industry[J].TurkJVetAnimSci, 2013, 37(6): 621-624. [24]ZUO B Y, QIAN H G, WANG Z Y, et al. A study onBMPR-IBgenes of Bayanbulak sheep[J].Asian-AustralasJAnimSci, 2013, 26(1): 36-42. [25]JOHANSEN P, ANDERSEN J D, BØRSTING C, et al. Evaluation of the iPLEX®Sample ID Plus Panel designed for the Sequenom MassARRAY®system. A SNP typing assay developed for human identification and sample tracking based on the SNPforID panel[J].ForensicSciInt:Genet, 2013, 7(5): 482-487. [26]ORTEGA M S, DENICOL A C, COLE J B, et al. Use of single nucleotide polymorphisms in candidate genes associated with daughter pregnancy rate for prediction of genetic merit for reproduction in Holstein cows[J].AnimGenet, 2016, 47(3): 288-297. [27]唐晓惠, 强巴央宗. 藏绵羊对高原低氧环境的适应性及抗病性相关基因研究进展[J]. 畜牧与兽医, 2017, 49(2): 115-118. TANG X H, QIANGBA Y Z. Research progress in Tibetan sheep adaptability to hypoxia and disease-related genes[J].AnimalHusbandry&VeterinaryMedicine, 2017, 49(2): 115-118. (in Chinese) [28]CAMILLE MELóN L, MAGUIRE J. GABAergic regulation of the HPA and HPG axes and the impact of stress on reproductive function[J].JSteroidBiochemMolBiol, 2016, 160: 196-203. [29]SONG H Y, WANG M X, WANG Z K, et al. Characterization ofKISS2 andKISSR2 genes and the regulation of kisspeptin on the HPG axis inCynoglossussemilaevis[J].FishPhysiolBiochem, 2017, 43(3): 731-753.1 材料与方法
1.1 样品采集和主要试剂
1.2 组织总RNA的提取和检测
1.3 引物设计
1.4 cDNA合成

1.5 sqRT-PCR反应
1.6 qPCR反应
1.7 基因分型
1.8 数据分析
2 结 果
2.1 总RNA提取与cDNA合成
2.2 FGF 7基因在不同绵羊品种各组织中的sqRT-PCR检测

2.3 FGF 7基因组织表达分析

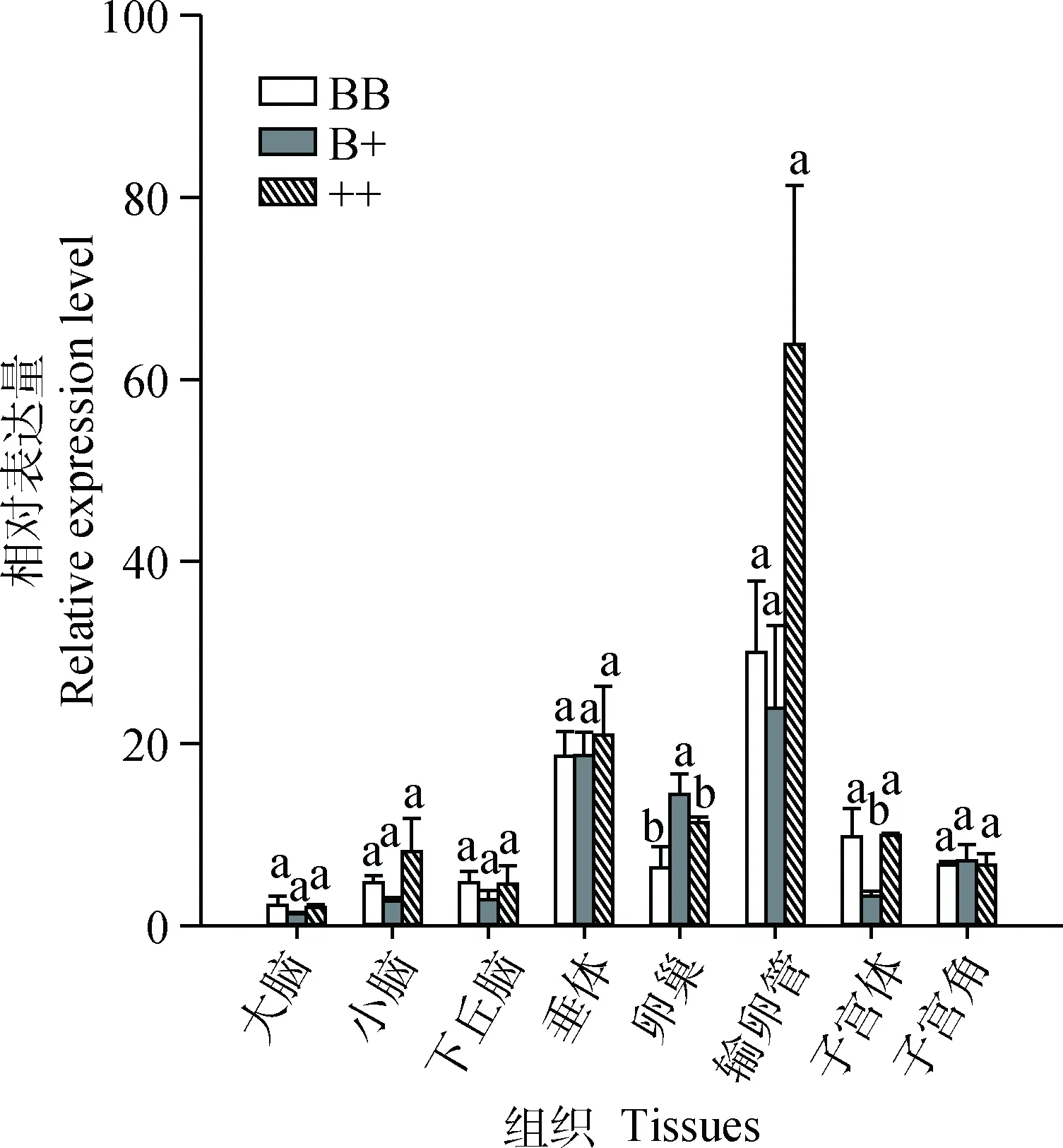
2.4 FGF 7基因多态性分析

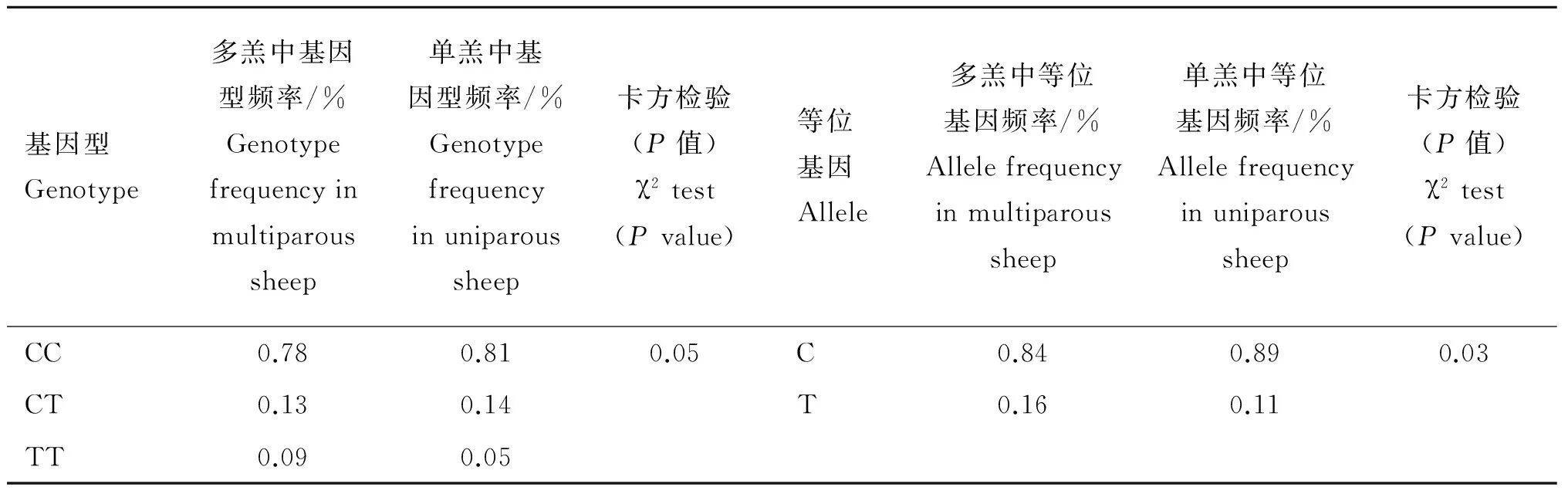
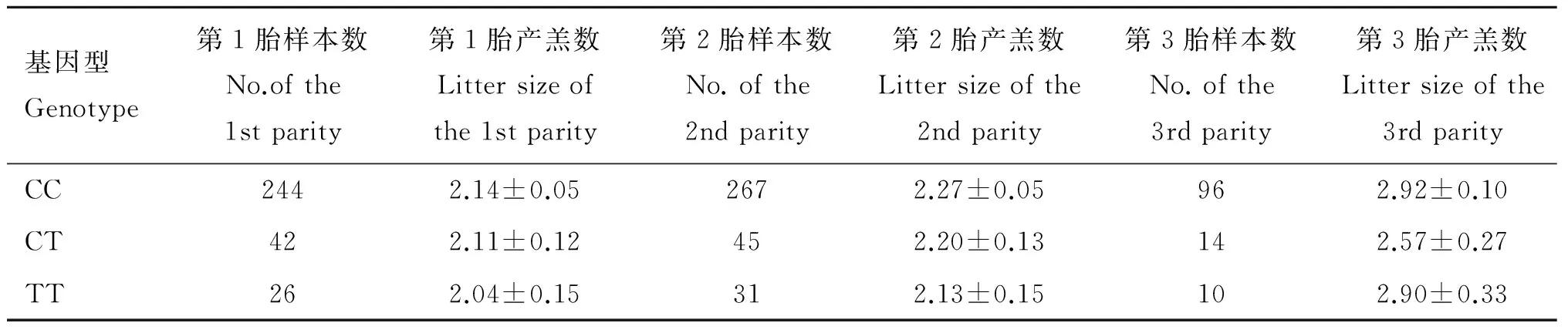
2.5 FGF 7基因g.57842893C>T位点与小尾寒羊产羔数的关系

3 讨 论
3.1 FGF 7基因表达分析
3.2 FGF 7基因与绵羊繁殖性状之间的关系
4 结 论


