QuEChERS法动态监测及评价山西省韭菜中12种农药残留
郭丽丽 花 锦
(1山西中医药大学制药与食品工程学院,山西晋中 030619;2山西出入境检验检疫局检验检疫技术中心,山西太原 030024)
韭菜是我国的特色蔬菜,味道鲜美、香味独特,具有丰富的营养价值。韭菜含有VC、VB1等多种维生素及矿物质,还含有丰富的纤维素,可以促进肠道蠕动。韭菜中硫化物的独特辛香味具有一定的杀菌消炎作用,有助于提高人体免疫力(商飞飞,2012)。然而韭菜生产中韭蛆、灰霉病等病虫害多发,种植过程中需要适量使用农药以减少病虫害损失(Farha et al.,2017)。但是一些菜农为了追求产量,经常采用灌根的方法将一些高毒农药用于韭蛆的防治(宋丹 等,2016),造成韭菜中农药残留超标,中毒事件频频发生(王文娇 等,2011)。2017年11月1日起,山东省全面启动实施韭菜产品“双证制”管理,严禁无《合格证》和《市场销售凭证》的韭菜产品进入食用农产品市场、生产加工、餐饮服务环节。这一举措反映出韭菜农药残留问题的日益严重性,相关部门应加强韭菜中农药残留的监测及监管。
目前韭菜中农药残留的检测方法已有很多研究和报道,相关的国家食品安全标准、农业标准及行业标准等也陆续出台。Xu等(2017)以薄层色谱作为净化方式,结合超高效液相色谱-Qtrap串联质谱检测韭菜中的有机磷农药残留;Shi等(2013)采用固相萃取结合气质联用技术检测韭菜中毒死蜱的用量;Rahman等(2012)利用气相色谱-微电子捕获法检测温室种植条件下韭菜中的溴虫腈;Song等(2007)以凝胶渗透色谱法作为净化方式检测了韭菜中有机磷和有机氯的残留;Zou等(2016)以快速多插头式过滤为净化方式检测了韭菜中183种农药残留。近年来,一种被称为QuEChERS(quick,easy,cheap,effective,rugged,safe) 的样品净化方法在农药残留检测中逐渐流行起来,该方法在韭菜农残检测中的应用也有很多报道(Pay á et al.,2007;Qu et al.,2010;Han et al.,2015;He et al.,2015;马杰 等,2016)。本试验采用QuEChERS法,依据农业部GB 2763—2016 《食品安全国家标准 食品中农药最大残留限量》选择韭菜种植中重点关注的12种农药(吡虫啉、敌敌畏、毒死蜱、多菌灵、腐霉利、甲胺磷、甲氰菊酯、克百威、六六六、氯丹、氯氟氰菊酯和高效氯氟氰菊酯、阿维菌素),采用超高效液相色谱串联质谱或气相色谱串联质谱检测农药残留情况,旨在验证方法可行性的同时对山西省60批韭菜进行农药残留监测及评估分析,并从样品的采样时期、采样区域和销售方式3个方面进行相应的分类、总结和归纳,从不同角度比较了韭菜中农药残留量与不同采样时期、采样区域和销售方式之间的关系,以期为山西省韭菜农产品种植工艺的改进提供实践基础,同时也为质量监督管理部门加强食品安全监管重点工作的实施提供科学指导。
1 材料与方法
1.1 仪器与试剂
ACQUITY Ultra Performance LCTM超高效液相色谱仪(美国Waters公司);TQD串联四极杆质谱仪(美国Waters公司);Agilent 6890N+5975B型气相色谱串联质谱仪(美国安捷伦科技有限公司);HC-3518型离心机(安徽中科中佳科学仪器有限公司);Advanced Vortex Mixer涡旋混合器(美国Talboys公司);KQ-500DB型超声波(成都康宇科技有限公司)。
十八烷基三甲氧基硅烷(Trimethoxyoctadecylsilane,C18) 和 乙 二 胺 -N-丙 基 硅 烷(Primary secondary amine,PSA)( 天津博纳艾杰尔公司);12种农药标准物质(德国Dr.Ehrenstorfer公司);甲醇、乙腈(美国Fisher公司);甲酸(天津科密欧有限公司);试验用水均为蒸馏水。
标准储备液:自配,分别称取5~10 mg(精确至0.1 mg)农药及相关化学品标准物质于10 mL容量瓶中,用甲醇、乙腈或丙酮等溶剂溶解并定容至刻度,避光4 ℃保存,6个月内可用。
混合标准中间溶液:自配,分别准确移取一定体积的每种标准储备液,用水∶乙腈为1∶1(体积比)定容成1.0 μg⋅mL-1的混合标准中间液,避光4 ℃保存,1个月内可用。
1.2 试验方法
1.2.1抽样2017年6~11月,分别从山西省大同、忻州、朔州、太原、吕梁、晋中、晋城、长治、临汾等地的农贸市场或超市随机抽取韭菜样品,共计60份。每个样品均采取非无菌采样方式(即采样过程未在无菌条件下进行)抽取1.5 kg,封装于塑料袋内。所抽取的样品具体信息如表1所示。
1.2.2提取分别取适量韭菜样品,用研钵研磨成糊状后,准确称取5 g(精确到0.01 g)置于50 mL的具塞离心管中,加入少许氯化钠,再加入10 mL乙腈,涡旋混匀,超声提取15 min,4 000 r⋅min-1离心10 min后取上清液。每个样品平行提取3次。
1.2.3净化取上述提取液1 mL于试管中,分别加入25 mg C18和25 mg PSA,充分涡旋混合后,用0.22 μm滤膜过滤,供液相色谱质谱仪、气相色谱串联质谱仪测定。
1.2.4检测条件液相色谱条件:色谱柱:C18柱(100 mm×2.1 mm,1.8 μm);流动相:0.1%甲酸和乙腈,梯度洗脱,具体程序见表2;流速:0.3 mL⋅min-1;进样量:10 μL;柱温:35 ℃。
气相色谱条件:不分流进样,进样量1 μL;进样口温度280 ℃;HB-5MS色谱柱(30 m×250 μm,0.25 μm), 载 气 为 高 纯 He, 流 速 1.0 mL⋅min-1;程序升温至90 ℃,以60 ℃⋅min-1升至180 ℃,以10 ℃⋅min-1升至240 ℃,再以80℃⋅min-1升至320 ℃,保持6.25 min;MSD传输线温度280 ℃。
液相色谱串联质谱条件:电离方式:电喷雾电离(ESI+);扫描方式:正离子扫描;离子源温度110 ℃;脱溶剂气温度380 ℃;锥孔气流,氮气,流速50 L⋅h-1;去溶剂气流,氮气,流速600 L⋅h-1;碰撞气,氩气,碰撞气压3.50×10-4MPa;检测方式,多反应监测(MRM)。
气相色谱串联质谱条件:自动调谐;溶剂延迟2 min;电子轰击(EI)离子源,电子能量70 eV,离子源温度230 ℃;多反应监测模式(MRM);四极杆MS1和MS2温度均为150 ℃;碰撞池淬灭气(He)2.25 mL⋅min-1,碰撞气(N2)1.5 mL⋅min-1。

表1 所抽取的韭菜样品信息

表2 梯度洗脱程序
1.3 数据统计
采用Origin 9.0软件对试验数据进行统计计算和分析,并进行图表的绘制。
2 结果与分析
2.1 韭菜中12种农药残留检测方法的评价
2.1.1方法的线性范围和灵敏度选取不含上述12种农药的韭菜为样品,按照1.2.2和1.2.3步骤进行空白基质溶液的制备,然后以此配制基质匹配标准溶 液(2.5、5.0、20、50、100 μg⋅L-1), 测 定 后绘制标准曲线,得到线性回归方程,相关系数R为0.995 1~0.999 9,表明各目标农药线性关系良好。12种农药在韭菜中的检出限(LOD)均为0.001 5 mg⋅kg-1,定量限(LOQ)均为 0.005 mg⋅kg-1(表 3)。本方法检出限、定量限远远低于农业部GB 2763—2016《食品安全国家标准 食品中农药最大残留限量》的最高残留量(MRL值),能够满足检测要求。

表3 12种农药的线性回归方程、相关系数、线性范围、检出限和定量限
2.1.2方法的回收率和精密度在空白韭菜样品中添加3个水平(LOQ、2倍LOQ及1个共性的农残限量点,分别对应于0.005、0.010和0.100 mg⋅kg-1)的农药混合标准溶液,进行添加回收试验,6次重复。各目标农药的平均回收率为75%~110%,相对标准偏差(RSD)为5.2%~11.6%,符合我国残留检测相关标准和法规要求(中华人民共和国国家质量监督检验检疫总局,SN/T 0001—2016,GB/T 27417—2017)。
2.1.3市售韭菜样品中12种农药残留的检测利用所建立的QuEChERS快速法对60份韭菜样品中的12种农药残留进行检测。结果表明,60份韭菜样品中只有12份未检出农药残留,其余48份样品均检出至少1种农药残留,检出率为80%,其中有12份样品农药残留超标,总体超标率为20%(表4)。超标样品中有9份为腐霉利,占总超标率的75%,是韭菜产品不合格的主要因素,其中1份样品的残留检测浓度达到4.22 mg⋅kg-1,超标高达20多倍;有1份样品为甲氰菊酯超标,超标1.3倍;有2份样品为(高效)氯氟氰菊酯超标,其中1份样品超标近2倍。值得注意的是,六六六是国家明令禁止使用的农药,但它的检出率高达26.70%;甲胺磷和克百威也属于蔬菜生产中禁用的高毒高残留农药,然而这两种农药均有检出,检出率分别为8.33%和1.67%(表4)。以上数据说明在山西省韭菜生产过程中,仍有多种高毒高残留农药在违规使用。
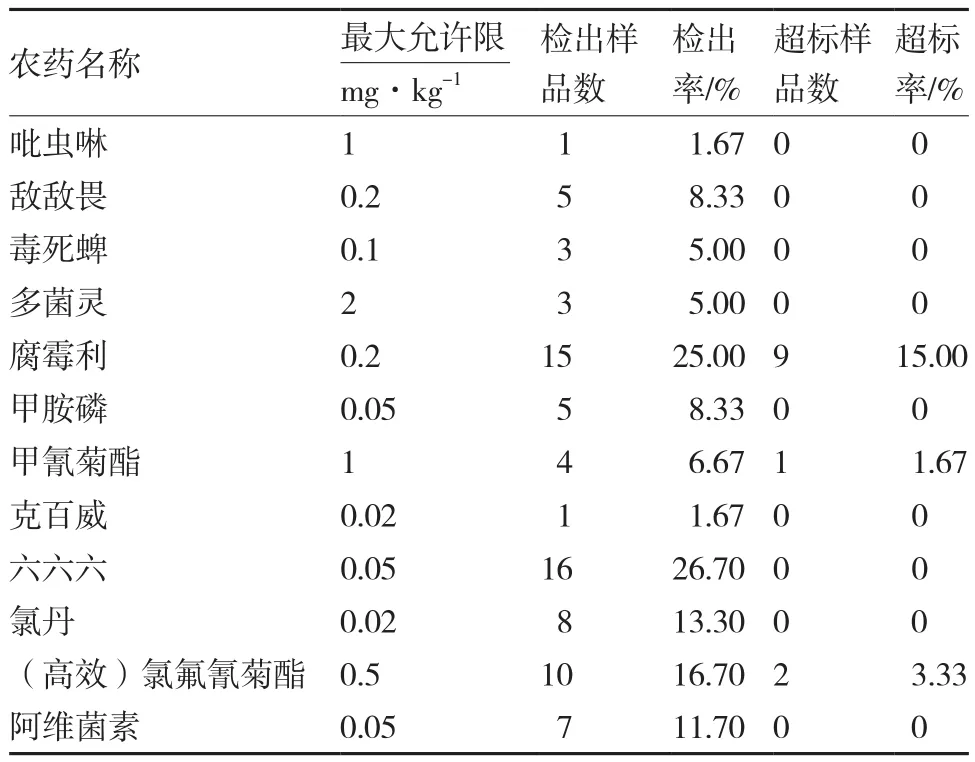
表4 60份韭菜样品中12种农药残留的检测结果
2.2 韭菜农药残留量随不同采样时期的变化
以不同采样时期为划分标准,对60份韭菜样品的农残检测数据进行整理,比较3个地区(太原及周边、晋北和晋南)韭菜中农药残留量随种植和收获期的变化规律。结果表明,多菌灵、腐霉利、甲氰菊酯和(高效)氯氟氰菊酯是太原及周边地区韭菜种植过程中容易使用的4种农药,6~11月期间,这4种农药的检出率分别为9.1%、24.2%、15.2%和21.2%,超标率分别为0、18.2%、3.0%和3.0%。其中(高效)氯氟氰菊酯和腐霉利的超标均发生在10~11月,多菌灵的检出主要发生在10月,甲氰菊酯的检出和超标发生在8~9月。可见多菌灵和腐霉利的使用高峰期为10~11月,主要用于杀菌;甲氰菊酯和(高效)氯氟氰菊酯用于杀虫杀螨,但前者使用高峰期为8~9月,后者使用高峰期为10月。
相似的情况也出现在晋北地区,该地区腐霉利的检出和超标均发生在10月,且腐霉利的检出率为38.5%,超标率为23.1%。对于晋南地区来说,6~8月以(高效)氯氟氰菊酯的使用为主,用于杀虫杀螨,但平均使用量并未超标。其次,该地区在夏季还会适量配合使用腐霉利,还存在使用禁用农药六六六的现象。
综上所述,山西省韭菜种植中使用比较多的农药是吡虫啉、敌敌畏、多菌灵、腐霉利、甲氰菊酯和(高效)氯氟氰菊酯,且一般来说夏季韭菜在生长过程中以使用杀虫剂为主,而冬季则多使用杀菌剂。本试验发现,韭菜种植过程中农药的残留超标主要发生在10~11月期间,应当加强此期间内市售韭菜的质量安全管理。
2.3 韭菜农药残留量随不同采样区域的变化
以不同采样区域为划分标准,以韭菜中使用较多的6种农药〔吡虫啉、敌敌畏、多菌灵、腐霉利、甲氰菊酯和(高效)氯氟氰菊酯〕为目标,比较同一采样时期内韭菜中平均农药残留量随不同采样区域(太原及周边、晋北和晋南)的变化规律。由图1可知,6~7月,太原及周边地区的农药残留量与晋南地区相近,但使用的农药种类明显不同:6月太原及周边地区以使用甲氰菊酯和(高效)氯氟氰菊酯2种杀虫杀螨剂为主,而晋南地区以使用腐霉利杀菌剂为主;7月后,太原及周边地区将甲氰菊酯、(高效)氯氟氰菊酯和敌敌畏三者配合使用,而晋南地区则以使用(高效)氯氟氰菊酯为主。8月后,太原及周边地区的农药残留水平明显高于晋南地区,但均未超出标准规定的最大允许限。10月太原及周边地区与晋北地区的腐霉利残留量均超标,但前者的超标量远高于后者。
2.4 韭菜农药残留量随不同销售方式的变化
以不同销售方式为依据,以韭菜中使用较多的6种农药〔吡虫啉、敌敌畏、多菌灵、腐霉利、甲氰菊酯和(高效)氯氟氰菊酯〕为目标,比较太原及周边地区在同一采样时期内韭菜中农药残留量随不同销售方式(农贸市场和超市)的变化规律。不同销售方式下韭菜农药残留量无明显规律,即农贸市场与超市韭菜样品中农药残留的检出率相近(图2),但农药残留的超标率差别较大,其中前者超标率为27.3%,后者超标率为9.1%,说明农贸市场与超市所流通的韭菜中均存在农药残留,但超市中韭菜的安全性要略高于农贸市场。

图2 韭菜中农药残留量随韭菜销售方式的变化
3 结论与讨论
本试验发现,对于太原及周边地区(包括榆次、汾阳、离石、阳泉)来说,10~11月为农药使用投入最多的月份,其中以腐霉利的使用最多,使得10~11月该地区有6份样品腐霉利超标,有的超标高达数十倍。而9月使用比较多的是甲氰菊酯,这就提示质量监督部门应当于每年9~11月,加强太原及周边地区市售韭菜中腐霉利和甲氰菊酯的检测,同时也提示该地区内的消费者在此期间内选购韭菜时,要额外注意韭菜的清洗。腐霉利属于低毒性杀菌剂,兼具保护和治疗作用,可用于防治韭菜的灰霉病,灰霉病会随着昼夜温差和湿度的加大而加重,随着10月后气候的转变,为了有效预防灰霉病,菜农会适度使用腐霉利(石凤梅,2014;余婧和周彬彬,2017)。但山西省种植韭菜的菜农在合理和安全使用农药方面尚缺乏有效的指导,存在超量用药的不良现象。虽然腐霉利属于低毒农药,但随着该农药用量的逐年增多,其残留量势必会得到一定程度的蓄积,终将给人类及生存环境带来极大的危害,因此并不可因其毒性低而在使用时随意加大剂量和使用次数。
本试验还分析了韭菜中农残量与销售方式之间的关系,发现农贸市场韭菜的超标率高于超市,这可能与2个环节管理与监管模式的不同有关。农贸市场运行机制不健全,监管难度较大,因此导致蔬菜农药残留超标率较为严重;超市有健全的管理和行政体制,要求进入卖场的农产品提供有效的检验报告,在一定程度上保证了产品的质量。需要说明的是,本试验所采集的韭菜样品均为普通食品,并未涉及到绿色、有机或无公害等认证食品,因此本试验的结论仅适用于普通的韭菜产品。
本试验建立了韭菜中12种农药的QuEChERS快速检测方法,该方法快速、高效,且可一步式完成定性与定量。利用所建立的方法对流通于山西省农贸市场与超市中的60批韭菜样品进行了检测,着重从不同采样时间、采样区域和销售方式3个方面对所得结果进行分析,结果显示市售韭菜样品中农药残留的总检出率为80%,超标率为20%,腐霉利超标是韭菜产品不合格的主要因素。农业相关部门应当加强韭菜种植环节的管理,加大安全用药的宣传和指导,同时加强在流通环节对韭菜农药残留的监管,建立健全相关的管理和运行机制,保障市售韭菜产品的安全,促进韭菜产业的健康可持续发展。
马杰,李青,白梅,姜楠,郭金芝,蒋素.2016.QuEChERS前处理技术与在线凝胶渗透色谱-气相色谱质谱联用法测定蔬菜水果中20种农药残留.食品安全质量检测学报,7(1):20-26.
商飞飞.2012.韭菜中毒死蜱的高残留原因及去除技术研究〔硕士论文〕.海口:海南大学.
石凤梅.2014.80%腐霉利可湿性粉剂对番茄灰霉病的防效研究.黑龙江农业科学,(7):68-69.
宋丹,李传仁,贾春虹,朱晓丹,贺敏.2016.韭菜上五种有机磷农药的残留监测与安全性评价.应用昆虫学报,53(6):1255-1260.
王文娇,张涛,陈健美,陈振德.2011.韭菜农药残留现状及防控技术.山东农业科学,(10):82-84.
余婧,周彬彬.2017.固相萃取-气相色谱-质谱法检测食品中腐霉利的残留量.食品安全质量检测学报,8(2):516-520.
Farha W,Abd El-Aty A M,Rahman M M,Jeong J H,Shin H,Wang J,Shin S S,Shim J.2017.Analytical approach,dissipation pattern,and risk assessment of pesticide residue in green leafy vegetables:a comprehensive review.Biomedical Chromatography,32(1):e4134.
Han Y T,Zou N,Song L,Li Y J,Qin Y H,Liu S W,Li X S,Pan C P.2015.Simultaneous determination of 70 pesticide residues in leek,leaf lettuce and garland chrysanthemum using modified QuEChERS method with multi-walled carbon nanotubes as reversed-dispersive solid-phase extraction materials.Journal of Chromatography B,1005:56-64.
He Z Y,Chen S S,Wang L,Peng Y,Luo M,Wang W W,Liu X W.2015.Multiresidue analysis of 213 pesticides in leek and garlic using QuEChERS-based method and gas chromatographytriple quadrupole mass spectrometry.Analytical and Bioanalytical Chemistry,407(9):2637-2643.
Pay á P,Anastassiades M,Mack D,Sigalova I,Tasdelen B,Oliva J,Barba A.2007.Analysis of pesticide residues using the Quick Easy Cheap Effective Rugged and Safe(QuEChERS)pesticide multiresidue method in combination with gas and liquid chromatography and tandem mass spectrometric detection.Analytical and Bioanalytical Chemistry,389(6):1697-1714.
Qu L J,Zhang H,Zhu J H,Yang G S,Aboul-Enein H Y.2010.Rapid determination of organophosphorous pesticides in leeks by gas chromatography-triple quadrupole mass spectrometry.Food Chemistry,122(1):327-332.
Rahman M M,Choi J,Abd El-Aty A M,Park J H,Park J,Im G,Shim J.2012.Determination of chlorfenapyr in leek grown under greenhouse conditions with GC-μECD and confirmation by mass spectrometry.Biomedical Chromatography,26(2):172-177.
Shi Y,Han T,Qi J H.2013.Residue of chlorpyrifos in processed leeks by solid phase extraction and gas chromatography-mass spectrometry.BioTechnology,7(10):398-401.
Song S L,Ma X D,Li C J.2007.Multi-residue determination method of pesticides in leek by gel permeation chromatography and solid phase extraction followed by gas chromatography with mass spectrometric detector.Food Control,18(5):448-453.
Xu Y Y,Song N H,Zhang Q,Liu J N,Chen G S,Shi L L,Wang J K.2017.A strategy for the evaluation of an analytical approach for selected pesticide residues in complex agricultural product matrices—a case study of leek.Food Chemistry,221:205-213.
Zou N,Han Y T,Li Y J,Qin Y H,Gu K J,Zhang J R,Pan C P,Li X S.2016.Multiresidue method for determination of 183 pesticide residues in leeks by rapid multiplug filtration cleanup and Gas chromatography-tandem mass spectrometry.Journal of Agricultural and Food Chemistry,64(31):6061-6070.

