优化短短芽孢杆菌施用技术对番茄和辣椒幼苗生长的影响
车建美 刘 波 刘国红 陈倩倩 张海峰
(福建省农业科学院农业生物资源研究所,福建福州 350003)
近年来,随着化学肥料和农药的大量使用,许多环境问题不断出现,如大量不可再生能源浪费、土壤板结、农作物品质降低、土壤肥力下降及农田有机质不足等(曾玲玲 等,2009)。微生物肥料具有改善土壤、促进植物生长等优势,同时对环境无污染,具有广泛的应用前景(葛诚和吴薇,1994;葛均青 等,2003)。
微生物肥料种类很多,包括细菌类肥料、放线菌类肥料以及真菌类肥料等,其中细菌类肥料中以芽孢杆菌居多(葛均青 等,2003;Kloepper et al.,2004;Ort í zcastro et al.,2008;张艳群 等,2013;Goswami et al.,2014;Cherif-Silini et al.,2016)。地衣芽孢杆菌(Bacillus licheniformis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)、短小芽孢杆菌(Bacillus pumilus)和巨大芽孢杆菌(Bacillus megaterium)等是微生物肥料中的常用菌种,对促进植物生长,提高抗病能力与品质具有明显效果(曹凤明 等,2008;鲍朋和许章峰,2013;Asari et al.,2016;Islam et al.,2016;Meng et al.,2016;Xu et al.,2016)。
短短芽孢杆菌(Brevibacillus brevis)属于短芽孢杆菌属,在自然界中广泛存在,由于其不含内毒素,能够形成芽孢,环境适应力强,具有较强与土著微生物的竞争力等(Panwar et al.,2000),在环保、生防、化工、食品等方面得到了很好的应用(黄学等,2006;葛慈斌 等,2009;Che et al.,2015)。研究表明,喷施短短芽孢杆菌FJAT-0809-GLX的菌体、发酵上清液及发酵液的番茄幼苗叶片数明显增加,茎长和茎粗也显著高于对照(车建美 等,2015),但目前对其在田间的具体施用方法还未进行优化研究。为获得更好的田间施用效果,本试验从不同喷施方式、不同喷施浓度及不同喷施次数等方面研究短短芽孢杆菌FJAT-0809-GLX的施用技术及最适施用效果,以期为其田间的施用提供技术指导。
1 材料与方法
1.1 试验材料
试验于2016年8月在福建省农业科学院农业生物资源研究所微生物研究中心育苗室进行。供试短短芽孢杆菌FJAT-0809-GLX为本所农业微生物研究中心保存。辣椒幼苗(阿拉特)、番茄幼苗(金石王)和土壤均从厦门如意生物科技公司购买。供试培养基为NA培养基。
1.2 试验方法
1.2.1菌株发酵从冻存管中取10 μL短短芽孢杆菌FJAT-0809-GLX菌液于NA平板中,划线,30 ℃培养24 h。用灭菌牙签挑取单菌落于50 mL液体培养液,30 ℃、170 r⋅min-1培养24 h。以1%的接种量向装液量为200 mL的1 L三角瓶中加入发酵培养液,30 ℃、170 r⋅min-1培养48 h,采用梯度稀释法统计菌体数量为2.8×108cfu⋅mL-1。
1.2.2短短芽孢杆菌不同施用方式对辣椒幼苗生长的影响辣椒幼苗室内种植7 d后,将短短芽孢杆菌发酵液(1×108cfu⋅mL-1)稀释100倍施用。共设3个处理,处理1:叶面喷施,CK1:喷水对照;处理2:灌根,CK2:水灌根对照;T3:叶面喷施+灌根,CK3:叶面喷水+水灌根对照。每个处理4盆,每盆4株,3次重复。叶面喷施用量为20 mL,灌根量为100 mL。分别于处理后0 d和14 d测定幼苗株高、茎粗、叶片大小及叶片数,计算净增长量。
1.2.3短短芽孢杆菌不同浓度处理对番茄和辣椒幼苗生长的影响番茄幼苗和辣椒幼苗种植7 d后,将短短芽孢杆菌发酵液(1×108cfu⋅mL-1)分别稀释10、100、500、1 000、10 000倍。采用无菌水作为对照。每处理7盆,每盆2株,3次重复。灌根量为50 mL。分别于处理后0 d和14 d测定幼苗株高、茎粗、叶片大小及叶片数。
1.2.4短短芽孢杆菌不同灌根次数对番茄和辣椒幼苗生长的影响番茄幼苗和辣椒幼苗室内种植7 d后,采用短短芽孢杆菌发酵液稀释100倍对幼苗进行灌根处理。共设4个处理,T1:定植时灌根1次;T2:定植时灌根1次,7 d后灌根1次,共2次;T3:定植时灌根1次,7 d和15 d后各灌根1次,共3次;T4:定植时灌根1次,7、15、30 d后各灌根1次,共4次。采用无菌水作为对照。每处理10盆,每盆2株,3次重复。灌根量为50 mL。分别于处理后0、42 d测定幼苗株高、茎粗、叶片大小及叶片数,计算净增长量。
1.2.5数据处理试验数据采用SPSS统计软件one-way ANOVA进行分析,差异显著性采用Duncan氏新复极差法进行多重比较,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 短短芽孢杆菌不同施用方式对辣椒幼苗生长的影响
从表1可以看出,叶面喷施+灌根处理的辣椒幼苗株高和茎粗显著增加,施用14 d后辣椒株高净增长达到20.00 cm,茎粗净增长达到0.16 mm。3种处理方式的叶片数和叶片长度均显著增加,叶面喷施处理的辣椒幼苗叶片宽度显著增加。灌根和叶面喷施结合使用对辣椒幼苗生长的促进作用更好。

表1 短短芽孢杆菌不同施用方式对辣椒幼苗生长的影响
2.2 短短芽孢杆菌不同浓度处理对番茄和辣椒幼苗生长的影响
2.2.1不同浓度处理对番茄幼苗生长的影响从表2可以看出,短短芽孢杆菌发酵液稀释100倍和500倍处理的番茄株高净增长显著高于对照及其他处理,净增长分别达20.29 cm和19.71 cm。稀释500倍处理的茎粗和叶片数显著高于对照和其他处理。稀释10、100、500、1 000倍处理均能显著促进叶片长度的增长。总体来看,短短芽孢杆菌发酵液稀释500倍对番茄幼苗促生效果最好。
2.2.2不同浓度处理对辣椒幼苗生长的影响从表3可以看出,不同浓度短短芽孢杆菌发酵液对辣椒幼苗生长均具有明显的促进作用,其中稀释10倍效果最明显,株高的净增长达21.25 cm,茎粗的净增长达0.37 mm,叶片数、叶长和叶宽均显著高于对照。
2.3 短短芽孢杆菌不同灌根次数对番茄和辣椒幼苗生长的影响
2.3.1不同灌根次数对番茄幼苗生长的影响从表4可以看出,短短芽孢杆菌灌根2次(T2)和3次(T3)处理的番茄幼苗株高、茎粗、叶片数和叶片宽度净增长明显高于对照和其他处理。其中灌根3次处理的株高净增长最大,达54.40 cm,叶片宽度和长度净增长也最大,分别达4.50 mm和6.60 mm;灌根2次处理的茎粗和叶片数净增长最大,分别达到1.28 mm和13.80片。从总体来看,灌根2~3次对番茄幼苗生长促进效果最好。
2.3.2不同灌根次数对辣椒幼苗生长的影响从表5可以看出,短短芽孢杆菌不同灌根次数对辣椒株高影响不显著。灌根2次(T2)和3次(T3)处理的辣椒幼苗茎粗净增长显著高于对照及其他处理,分别达0.50 mm和0.52 mm;灌根2次处理的叶片数、叶片长度和宽度最大,净增长分别达47.67片、66.84 mm和25.73 mm。综上,灌根2次对辣椒幼苗生长促进效果最好。

表2 不同浓度短短芽孢杆菌对番茄幼苗生长的影响

表3 不同浓度短短芽孢杆菌对辣椒幼苗生长的影响
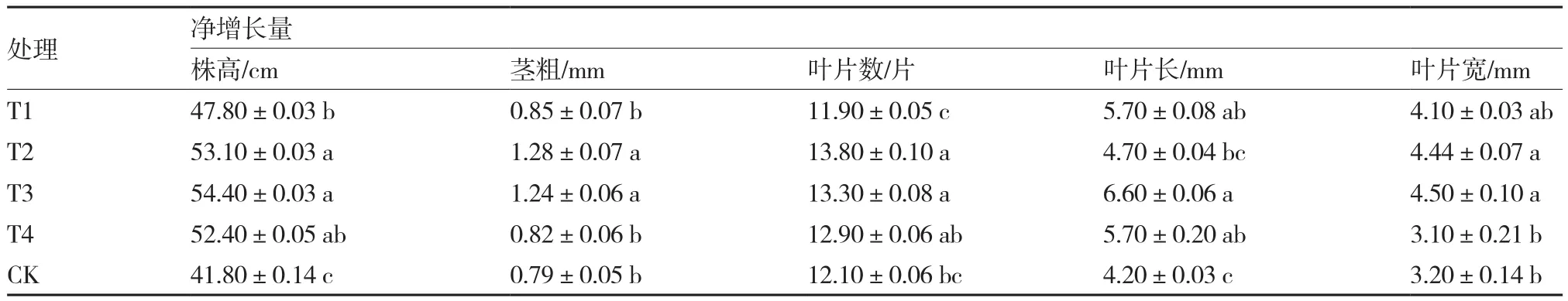
表4 短短芽孢杆菌不同灌根次数对番茄幼苗生长的影响

表5 短短芽孢杆菌不同灌根次数对辣椒幼苗生长的影响
3 结论与讨论
短短芽孢杆菌FJAT-0809-GLX对茄科作物具有明显的促长作用(车建美 等,2015)。灌根和叶片喷施是芽孢杆菌类微生物肥料常用的施用方法。张雯景等(2011)研究表明,叶面喷施由乳酸菌、酵母菌、芽孢杆菌和沼泽红假单胞菌组成的微生态菌剂,可以增加翠菊和鼠尾草的叶片长和叶片数。喷施加灌施枯草芽孢杆菌生物菌剂对五味子生长具有明显的促进作用,可以促进叶面积增大,提高光合作用有机物的合成(回云静 等,2011)。本试验结果与前人相同,短短芽孢杆菌FJAT-0809-GLX叶面喷施可以明显促进辣椒幼苗的生长,灌根和叶面喷施结合使用对辣椒幼苗生长的促进作用更好。
芽孢杆菌菌剂施用的浓度、次数对植株的生长具有不同的影响(刘拴成 等,2010)。枯草芽孢杆菌Bs2004菌剂对莴苣的促生防病效果与施药时间、次数和浓度有关(刘勇 等,2008);菌株Thhy1培养液浓度在40%以下对番茄种子萌发具有强的促生作用,大于40%时对番茄种子萌发具有抑制作用(王美琴 等,2011)。本试验结果表明,不同浓度短短芽孢杆菌FJAT-0809-GLX均能促进番茄和辣椒幼苗的生长,其中稀释500倍对番茄幼苗的促生效果最好,稀释10倍对辣椒幼苗的促生效果最好,不同稀释浓度对番茄和辣椒幼苗生长影响不同,这很可能与番茄和辣椒苗期生长营养需求不同有关。康少辉等(2014)发现,不同浓度枯草芽孢杆菌在一定程度上均能提高黄瓜秧苗的长势和质量,其中能够产生显著影响的最低施用浓度为6×105cfu⋅mL-1。不同浓度枯草芽孢杆菌B67菌液对黄瓜苗期促生作用呈正态分布,20%枯草芽孢杆菌B67菌液,施药2次(间隔期7 d)的促生效果最佳(孙中华 等,2017)。本试验中,短短芽孢杆菌FJAT-0809-GLX不同灌根次数对番茄和辣椒幼苗生长影响也有所不同,灌根2次和3次更有利于株高、茎粗、叶片数和叶片大小的增长,这与刘勇等(2008)的研究结果相似。本试验结果表明,在定植时灌根1次,定植后15 d内再灌根1~2次,更利于植株生长,这很可能因为在植株生长前期进行短短芽孢杆菌灌根处理,可以提高植株在土壤中的适应能力,建议田间应用时,在植株生长前期进行短短芽孢杆菌灌根处理。
短短芽孢杆菌FJAT-0809-GLX不同施用方式、施用浓度和次数对番茄和辣椒幼苗生长的影响有所不同,因而在田间施用时,需结合作物的生长状态和耕作方式等对施用方法和施用浓度进行适当调整,以利于取得较好的促长效果。为更好地了解该菌株的促长作用机理,后续将克隆与短短芽孢杆菌FJAT-0809-GLX促生相关的基因,验证和研究这些基因的促生相关功能。
鲍朋,许章峰.2013.巨大芽孢杆菌在生物肥料上的研究现状与发展方向.农技服务,30(6):601-602.
曹凤明,沈德龙,李俊,关大伟,姜昕,李力,冯瑞华,杨小红,陈慧君,葛一凡.2008.应用多重PCR鉴定微生物肥料常用芽孢杆菌.微生物学报,48(5):651-656.
车建美,刘波,郭慧慧,刘国红,葛慈斌,刘丹莹.2015.短短芽孢杆菌FJAT-0809-GLX对番茄促长作用的研究.福建农业学报,30(5):498-503.
葛诚,吴薇.1994.我国微生物肥料的生产、应用及问题.中国农学通报,(3):24-28.
葛慈斌,刘波,蓝江林,黄素芳,朱育菁.2009.生防菌JK-2对尖孢镰刀菌抑制特性的研究.福建农业学报,24(1):29-34.
葛均青,于贤昌,王竹红.2003.微生物肥料效应及其应用展望.中国生态农业学报,11(3):87-88.
黄学,伍晓林,侯兆伟.2006.短短芽孢杆菌和蜡状芽孢杆菌降解原油烃机制研究.石油学报,27(5):92-95.
回云静,吴长宝,徐小明,蔡金艳,朱峰,任跃英.2011.枯草芽孢杆菌生物菌剂对五味子白粉病防效及生长的影响.菌物研究,9(2):100-104.
康少辉,苏浴源,栗淑芳,申领艳,闫凤岐,刘晓婕,吕丽霞.2014.不同浓度枯草芽孢杆菌对黄瓜秧苗长势和质量的影响.河北农业科学,(3):52-53.
刘拴成,杨进成,马丽华,张翠英,何月秋,普莉华.2010.解淀粉芽孢杆菌B96.1-Y2提高玉米生长和产量效应.玉米科学,18(6):78-82,85.
刘勇,柯绍英,黄小琴,刘林.2008.枯草芽孢杆菌Bs2004菌株的防病促生效果.中国生物防治学报,(s1):46-49.
孙中华,赵铂锤,陈仕红,纪明山.2017.枯草芽孢杆菌B67对黄瓜幼苗生长发育的影响.中国瓜菜,(2):15-18.
王美琴,刘慧平,韩巨才.2011.内生枯草芽孢杆菌Thhy1的促生与定殖力研究.中国农学通报,27(16):196-199.
张雯景,冀宇婷,刘晨,吴丹薇,闫海,马作敏.2011.微生态叶面肥对翠菊和鼠尾草生长的效应.化学与生物工程,28(10):47-49.
张艳群,来航线,韦小敏,王旭东.2013.生物肥料多功能芽孢杆菌的筛选及其作用机理研究.植物营养与肥料学报,19(2):489-497.
曾玲玲,崔秀辉,李清泉,刘峰,王成,王俊强,张成亮,季生栋.2009.微生物肥料的研究进展.贵州农业科学,37(9):116-119.
Asari S,Matz é n S,Petersen M A,Bejai S,Meijer J.2016.Multiple effects ofBacillus amyloliquefaciensvolatile compounds:plant growth promotion and growth inhibition of phytopathogens.Fems Microbiology Ecology,92(6):fiw070.
Che J M,Liu B,Chen Z,Shi H,Liu G H,Ge C B.2015.Identification of ethylparaben as the antimicrobial substance produced byBrevibacillus brevisFJAT-0809-GLX.Microbiological Research,172:48-56.
Cherif-Silini H,Silini A,Yahiaoui B,Ouzari I,Boudabous A.2016.Phylogenetic and plant-growth-promoting characteristics of Bacillus,isolated from the wheat rhizosphere.Annals of Microbiology,66(3):1-11.
Goswami D,Dhandhukia P,Patel P,Thakker J N.2014.Screening of PGPR from saline desert of Kutch:growth promotion inArachis hypogeabyBacillus licheniformisA2.Microbiological Research,169(1):66-75.
Islam S,Akanda A M,Prova A,Islam M T,Hossain M M.2016.Isolation and identification of plant growth promoting rhizobacteria from cucumber rhizosphere and their effect on plant growth promotion and disease suppression.Frontiers in Microbiology,6:1360-1367.
Kloepper J W,Ryu C M,Zhang S.2004.Induced systemic resistance and promotion of plant growth byBacillusssp. Phytopathology,94(11):1259-1266.
Meng Q X,Jiang H,Hao J J.2016.Effects ofBacillus velezensisstrain BAC03 in promoting plant growth.Biological Control,98:18-26.
Ort í zcastro R,Valenciacantero E,L ó pezbucio J.2008.Plant growth promotion byBacillus megateriuminvolves cytokinin signaling.Plant Signaling & Behavior,3(4):263-265.
Panwar S,Singh L,Sunaina V.2000.Evaluation ofBrevibacillus brevisandBacillus firmusstrains in management of fungal pathogens.Pesticide Research Journal,18(2):159-161.
Xu S J,Park D H,Kim J Y,Kim B S.2016.Biological control of gray mold and growth promotion of tomato usingBacillusspp.isolated from soil.Tropical Plant Pathology,41(3):169-176.

