拟南芥防御素基因PDF1.2启动子与GUS重组载体的构建与转化
刘志霞,周 舟,蔡 薇,程 姣,任春梅,2*
(1湖南农业大学生物科学技术学院,长沙 410128;2作物基因工程湖南省重点实验室,长沙 410128)
PDF1.2基因是一个广泛存在于植物中与抗逆相关的基因[1~4]。由于其参与植物体内众多的防御反应,近年来一直受到广泛的关注和研究。目前人们已经从许多不同的植物中克隆出了该基因,如拟南芥、小麦、棉花等[5~7]。
在植物体内,PDF1.2基因主要功能是编码产生一类名为植物防御素的抗性蛋白。植物防御素不仅能抑制真菌的生长,同时也能在一定程度上抑制细菌的生长,抑制酶的活性,这些独特的生物学特性使得植物防御素能有效的帮助植物抵抗来自于各种不利条件如真菌入侵、病毒感染、不良环境等逆境胁迫的侵害[8~10]。然而目前对于防御素提高植物抗性的作用机制并不是很明确。因此,利用基因工程技术研究PDF1.2基因的表达模式对于了解防御素的作用机制具有十分重要的意义。
由于具有操作简单、反应快速、检测准确、技术成熟等优点,将目的基因的启动子与GUS基因融合并转化植物,对转基因植物进行GUS染色,通过观察GUS蛋白在转基因植物中不同器官及组织的表达来研究目的基因的表达模式是基因工程常用的技术之一。如胡佳等人利用GUS基因作为显色基因来研究拟南芥叶片中油体含量[11];张鑫平等人利用GUS染色技术来分析拟南芥和油菜花药的特异性表达[12]。因此,本试验中选择 GUS基因作为报告基因来构建PDF1.2基因启动子的重组载体。
1 材料与方法
1.1 实验材料
实验所用拟南芥(Arabidopsis thaliana)野生型Col-0,大肠杆菌(Escherichia coli)DH5α,根癌农杆菌 (Agro bacterium tumefactions) GV3101,载 体pCAMBIA1301等都由作物基因工程湖南省重点实验室植物信号传导课题组提供。
1.2 植株培养条件
将拟南芥种子置于消毒液(20%bleach+0.1%Triton100)中浸泡10~15 min,于超净工作台上用无菌水冲洗4~5遍,适当密度播撒在MS固体培养基上,4℃春化3 d,转入光照培养室22℃长日照(16 h光照/8 h黑暗)培养。长至7 d时,将其转入营养土(东北黑土与蛭石的体积比为1∶1)中,盖上透明塑料薄盖1~2 d。
1.3 载体的构建
在TAIR网上查询拟南芥PDF1.2基因并选取上游启动子区域序列,用在线软件Plantcare对其进行启动子元件分析。利用Primer Premier 5.0引物设计软件设计1对扩增引物PDF1.2-F/PDF1.2-R,在引物5′端分别加上PstⅠ和NcoⅠ酶切位点,扩增引物序列为:

用SDS法提取拟南芥总DNA,以此为模板,用引物PDF1.2-F/PDF1.2-R进行PCR扩增,琼脂糖凝胶电泳后回收目的片段并纯化。将回收纯化后的目的片段和pCAMBIA1301载体用PstⅠ和NcoⅠ限制性内切酶在37℃下过夜双酶切,将得到的目的片段和目的载体进行回收。用T4连接酶将PDF1.2基因启动子连接至pCAMBIA1301载体的预期位点。通过热激法将重组表达载体转化至大肠杆菌DH5α,挑取阳性克隆进行菌落PCR鉴定,正确的进行测序鉴定。
1.4 表达载体的遗传转化
挑选测序正确的重组质粒,通过电击法转化到根癌农杆菌GV3101中,将转化液置于含有卡那霉素(50 mg/L)、庆大霉素(100 mg/L)、利福平(50 mg/L)的YEB固体培养基上28℃黑暗过夜培养,挑取阳性菌进行扩大培养。采用浸花法转化拟南芥Col-0野生型。收获T0代种子播种于含有潮霉素(25 mg/L)的MS固体培养基上,长日照条件下培养2周后将抗性植株移栽至营养土中正常生长。
1.5 GUS染色
GUS染色液配制:将X-gluc溶于磷酸钠缓冲液中(含100 mmol/L pH 7.0的磷酸钠缓冲液,10 mmol/L EDTA,5 mmol/L铁氰化钾,5 mmol/L亚铁氰化钾),终浓度为 1 mmol/L。
挑选长日照条件下生长7 d的抗性植株浸入GUS染色液中,37℃避光过夜。用不同浓度酒精脱色,显微镜下观察染色情况。
2 结果与分析
2.1 目的片段克隆
在Plantcare网站对PDF1.2基因起始密码子ATG上游约2000 bp左右的启动子序列进行分析,结果发现其中包含了大量核心启动子元件TATA-box、CAAT-box,进一步分析发现其还含有部分与生物胁迫相关的顺式调控原件。这一结果表明该段PDF1.2基因启动子序列能正常启动该基因的表达,且PDF1.2基因在植物的抗逆和抗病等方面起到重要作用。
以拟南芥野生型基因组DNA为模板,利用引物PDF1.2-F/PDF1.2-R进行扩增,并利用电泳检测扩增片段,结果如图1所示。所得扩增片段大小约2000 bp左右,与预期大小相符,且没有非特异性扩增条带。这一结果表明目的片段克隆成功,PCR产物可用于下一步实验。
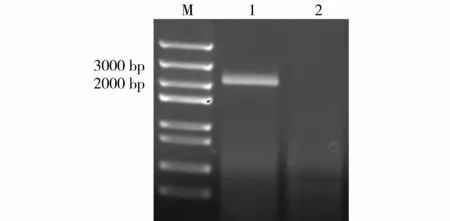
图1 PDF1.2基因启动子PCR扩增结果Fig.1 PCR result of PDF1.2 promoter
2.2 重组表达载体构建
将扩增所得目的片段与带有报告基因GUS的pCAMBIA1301载体进行酶切并用T4连接酶连接,将pPDF1.2∶∶GUS重组表达载体通过热激法转化至大肠杆菌DH5α。下一步挑选阳性菌进行菌落PCR来检测转化结果,如图2所示。2~5号样本中,转化成功的菌落成功的检测到目的片段,转化未成功样本无法检测到目的片段。进一步对检测成功的菌落样本进行PstⅠ和NcoⅠ双酶切验证。挑取检测正确菌落进行测序鉴定,通过序列比对保留目的片段大小正确、无移码突变现象、且连接处与预期位置相符的样本进行遗传转化。
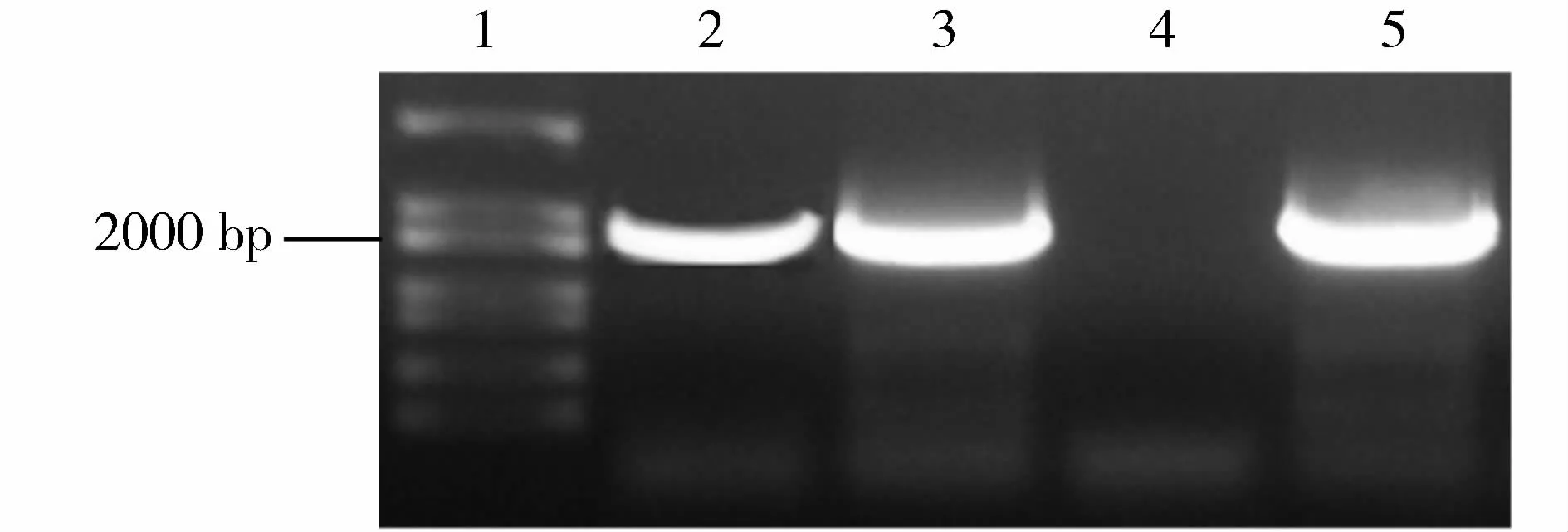
图2 菌落PCR结果Fig.2 PCR result of recombinant colonies
2.3 pPDF1.2::GUS重组表达载体的遗传转化
通过电击法将转化正确的重组质粒转入农杆菌细胞中,利用PCR来检测转入情况,结果如图3所示。在转入质粒的农杆菌样本中成功检测到大小为2000 bp左右与目的片段大小相似的条带,证明重组质粒成功转入到农杆菌中。
挑选转入成功的农杆菌进行扩大培养,采用浸花法将农杆菌的重组表达载体转入拟南芥Col-0野生型植株中。利用载体上的潮霉素抗性标记基因对转基因植株种子进行筛选,结果如图4所示。转入成功的植株带潮霉素抗性,在含25 mg/L潮霉素MS固体培养基上正常生长,未成功转入的植株则在潮霉素培养基上无法正常生长。
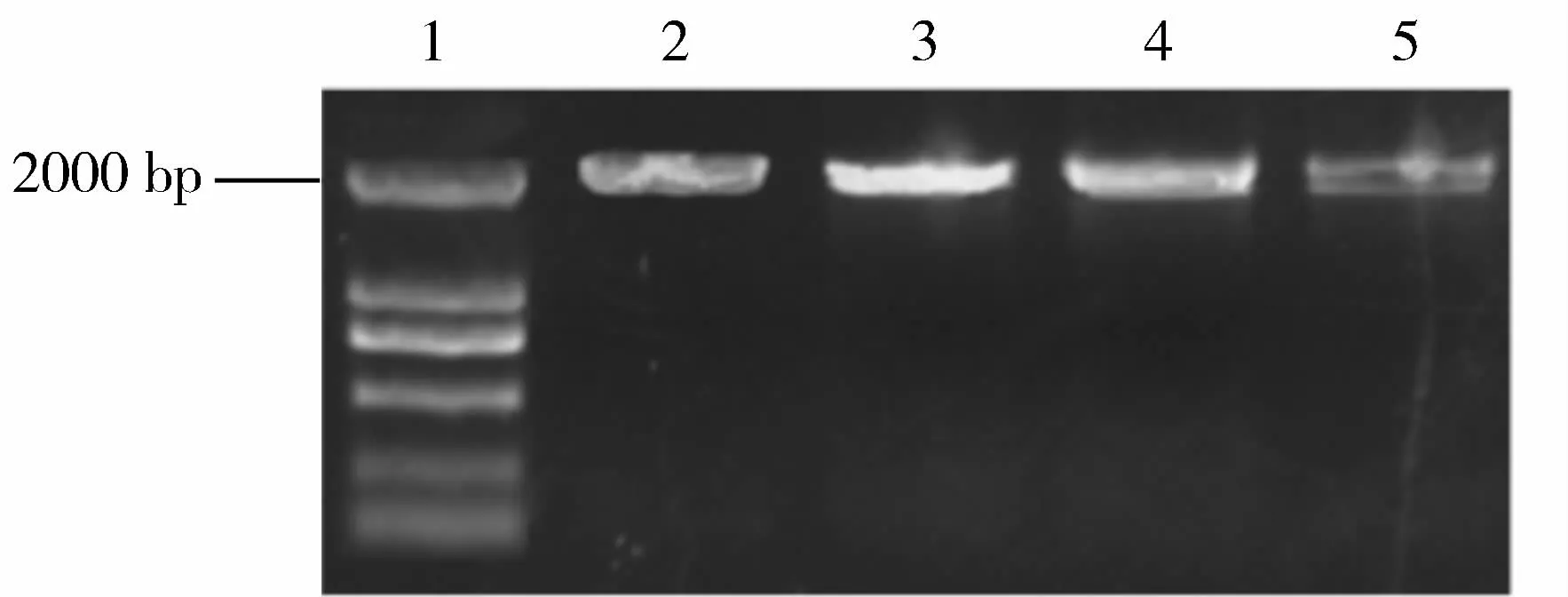
图3 农杆菌菌落PCRFig.3 PCR of agro bacterium colony

图4 转基因植株的抗性筛选Fig.4 Resistance screening of transgenic plants
2.4 GUS染色检测转基因植株
为了检测重组载体是否成功转入拟南芥植株中,将通过PCR鉴定的转基因植株种子铺种在含有25 mg/L潮霉素的MS培养基上,长日照条件下生长7 d。挑选无菌的幼苗进行GUS组织化学染色,利用体式显微镜观察染色结果,如图5所示。转入pCAMBIA1301质粒(含有35S启动子)的阳性对照幼苗中,GUS基因在根、茎、叶等器官中都高度表达;未转入GUS基因的阴性对照幼苗中,GUS基因没有任何表达;在转入拟南芥PDF1.2基因启动子与GUS融合重组载体的转基因植株中,GUS基因在根中有少量表达,在下胚轴及子叶中有较强的表达,在真叶叶柄部位有表达而在叶片上没有表达。

图5 转基因植株GUS染色表型Fig.5 The GUS staining phenotype of transgenic plants
3 结论与讨论
本研究成功克隆了PDF1.2基因启动子片段并成功构建了PDF1.2基因启动子与GUS重组载体,同时利用农杆菌浸渍转化法将重组载体转入拟南芥植株中并对转基因植株进行了GUS染色验证。本实验结果为进一步研究PDF1.2基因在植物体内的表达以及植物防御素的作用机制打下基础。
随着科学技术的发展,在现代农业生产中,利用高效、天然、无害的杀菌剂来代替传统的化学杀虫剂帮助植物抵御外界病虫害及各种逆境的危害是一种趋势。植物体内PDF1.2基因所编码的植物防御素由于其具有广谱的杀菌活性,能抑制多种细菌及真菌的生长,同时对动植物细胞无明显的毒性的特点,使其成为代替传统化学杀虫剂的选择之一。研究PDF1.2基因的表达模式有利于了解植物防御素的作用机制。基因的表达受到启动子、终止子等众多原件的调控,启动子决定了基因转录的起始位点以及转录频率,对基因的表达起到了十分重要的作用。因此构建PDF1.2基因启动子重组载体对于研究PDF1.2基因的表达模式以及植物防御素的作用机制是很有必要的。
GUS染色的结果显示,拟南芥PDF1.2启动子与GUS基因的融合重组载体成功的转入了拟南芥野生型中。在转基因植株中,PDF1.2基因在下胚轴及子叶中有较强的表达,说明PDF1.2基因所参与和介导的防御途径在下胚轴及子叶中比较活跃;在真叶叶片上没有表达,说明PDF1.2基因所参与和介导的防御途径在这一时期的真叶叶片中未被激活。PDF1.2基因在根、叶片、下胚轴等部位的表达差异,说明了植物防御素在拟南芥不同组织和部位存在着特异性的表达,然而这种特异性的表达有待于进一步研究。
参考文献:
[1] 张海文,谢丙炎,卢向阳,等.拟南芥防卫基因PDF1.2启动子中GCC盒是应答茉莉素反应必要的顺式作用元件[J].科学通报,2004,49(23):2444-2448.
[2] 封功能.水稻穗发育相关突变体pla1-5、pdf1和tri1的鉴定、基因定位与克隆研究[D].扬州:扬州大学博士学位论文,2013.
[3] 冀瑞琴,董祥柏,冯 辉,等.PDF1.2基因在转草酸氧化酶基因甘蓝型油菜中的表达[J].植物生理学报,2009,45(5):479-482.
[4] 邱玲玉.葡萄PDF基因的启动子功能分析及ERF转录因子对PDF基因表达的调控[D].大连:辽宁师范大学硕士学位论文,2011.
[5] 张海文.PDF1.2启动子中茉莉素应答的顺式作用元件及其相关转录因子的研究[D].长沙:湖南农业大学博士学位论文,2002.
[6] 史灵敏,张 斌,丁汉凤,等.三个小麦防御素基因的克隆及序列分析[J].山东农业科学,2016,48(11):1-8.
[7] 郑云娜.海岛棉GbPDF2基因的克隆及功能分析[D].杭州:浙江农林大学硕士学位论文,2014.
[8] 何 玲,杨素云,刘 媛,等.植物防御素在抗植物病害方面的应用[J].现代农业科技,2017,7(3):147-149.
[9] 朱立成,罗 辉,任 悍.植物防御素结构与功能及其抗真菌机制研究进展[J].生物技术通报,2014(3):9-14.
[10]张 宏,胡春香,张德禄,等.植物防御素研究进展[J].西北师范大学学报,2006,42(5):112-117.
[11]胡 佳,曾文婕,刘春林.叶片中GUS染色观测油体含量技术体系的建立[J].植物生理学报,2017,53(2):185-190.
[12]张鑫平.拟南芥和油菜花药特异表达启动子的克隆与功能分析[D].武汉:华中农业大学硕士学位论文,2015.

