Sysmex XS-800i 血细胞分析仪血小板计数性能评价
马跃飞, 欧启水, 汤绍鹏, 王炳龙, 林锦骠, 杨 滨
Sysmex XS-800i全自动血细胞分析仪具有故障率低、噪音低、稳定性强、操作简单等特点,并且检测成本适中,适合于大、中、小型的医疗单位使用。因其可进行微量血液检测(仅需20 μL),更加适用于小儿科、化疗科等采血相对困难的人群。Sysmex XS-800i仪器计数血小板(platelet,PLT)联合应用电阻抗法和浮动界标技术,即根据红细胞(red blood cell,RBC)和PLT因体积大小不同所致分布曲线的差别,用微积分方法计算两者交界处的最低点,作为PLT和RBC的分界线,一般在10~35 fL。小于此分界线的血细胞数量即为PLT数。但是,电阻抗法本身无法完全排除非PLT颗粒(如细胞碎片、细菌、真菌等)的干扰[1-2]。笔者科室的Sysmex XS-800i仪主要用于儿科患者末梢血标本的检测,自使用以来已经建立了完善的复检规则。但随着设备使用时间增长,仪器报警增多,PLT计数的假阴性率有增高趋势。为保证PLT计数的准确性,依据ISO 15189《医学实验室质量和能力认可准则》的要求[3],笔者科室对Sysmex XS-800i仪检测PLT的性能和影响因素重新进行全面评估,以期为修订该仪器的PLT复检规则提供依据,现报道如下。
1 材料与方法
1.1标本 收集2017年3-5月在笔者医院儿科就诊患儿的末梢及静脉血液标本共498例。所有受检标本用EDTA-K2抗凝,充分混匀防止凝固,2 h内完成检测。
1.2主要仪器与试剂
1.2.1仪器 全自动血细胞分析仪(Sysmex XS-800i,日本希森美康公司);全自动血细胞分析仪(ADVIA 2120i,德国西门子公司);OLYMPUS普通光学显微镜(CX31,日本奥林帕斯公司);改良牛鲍计数板、EDTA-K2真空负压采血管(批号:OTD6O26,福州长庚医疗器械公司);微量采血管(批号:V29S518E5,美国MEDLANCE公司)。
1.2.2试剂 Sysmex XS-800i检测试剂:CELLPACK稀释液(批号:G 6459),低值质控品(批号:70780810),中值质控品(批号:70780811),高值质控品(批号:70780812),均为希森美康公司。ADVIA 2120i检测试剂:RBC/PLT计数(批号:90995),SHEATH/RINCE(批号:0247),中值质控品(批号:TP 72035),高值质控品(批号:TP 73035),均为德国西门子公司。1%草酸铵稀释液(PLT稀释液)参照文献[4]的要求配置,4 ℃保存。Baso瑞氏吉姆萨染色液(批号:416092,珠海贝索公司)。
1.3PLT 测定方法
1.3.1仪器计数法
1.3.1.1阻抗法(PLT-I) 按照Sysmex XS-800i的标准操作规程操作。操作前参照文献[5]进行校准,确保仪器正常运行。运行质控在控,试剂无过期变质现象。记录PLT计数结果,观察直方图,记录相关报警(如PLT直方图异常、PLT聚集、RBC碎片、小RBC等)。
1.3.1.2光学法(PLT-O)二维激光法 按照ADVIA 2120i的标准操作规程操作。操作前确保仪器正常运行。运行质控在控,试剂无过期变质现象。记录PLT计数结果。
1.3.2显微镜计数法(PLT-M) 参照文献[4]操作。由2名技术熟练的技师采用双盲法进行显微镜下PLT的计数,取2人计数平均值。2人计数差别较大时,则由第3人计数。取3次结果中相近的2次均值作为显微镜检计数值。
1.3.3镜检估值法 取标本5 μL,制成血涂片,进行瑞氏-吉姆萨染色。正常情况下在血片厚薄适中区域(RBC散开,互相接触但不重叠,相邻RBC的距离不超过1个RBC),每个油镜视野约有8~15个PLT,或每10~30个RBC中见到1个PLT。油镜下计数11个视野的PLT总数各2次,取平均值。此法作为PLT过高或过低时,显微镜计数法的补充方法,同时作为PLT聚集和大PLT验证及筛查方法。
1.4性能评价 参照文献[6]执行。
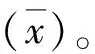
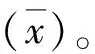
1.4.3线性实验 将相同血型,PLT高值(>900×109L-1)、低值(<30×109L-1)两份静脉血标本按5∶1,4∶2,3∶3,2∶4及1∶5的比例配制成系列浓度,加上原标本,共7个标本,每个标本重复检测3次取平均值,以计算理论值为x轴,实际测试值为y轴,做线性回归分析。
1.4.4携带污染率 取1份PLT高值(PLT>900×109L-1)标本连续测定3次(H1,H2,H3),再取1份PLT低值(PLT<30×109L-1)标本连续测定3次(L1,L2,L3),用公式(L1-L3)/(H1-L3)×100%计算携带污染率。
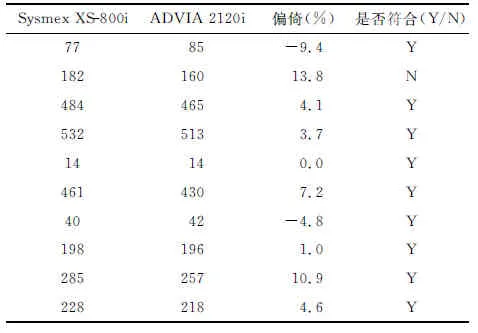
1.4.5正确度验证 取一定浓度范围内10份新鲜末梢血液标本,在Sysmex XS-800i和ADVIA 2120i上同时检测PLT,以参加室间质评的ADVIA 2120i为基准仪器,计算偏倚,偏倚应≤12.5%。若PLT<40×109L-1,偏倚应≤15.0%。80%以上符合为正确度验证合格。
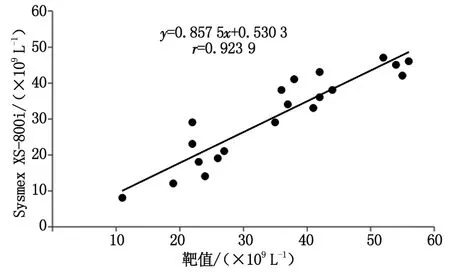
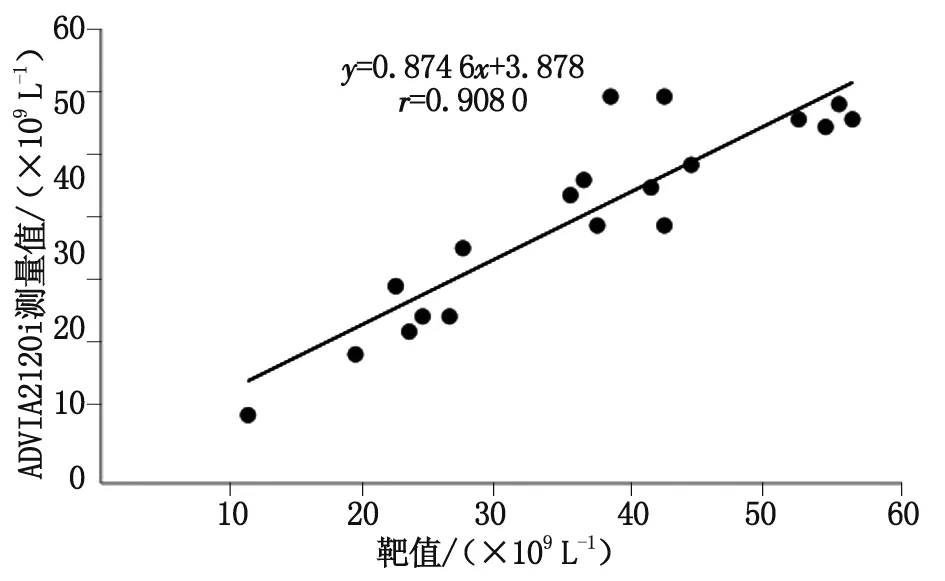
1.4.6低值PLT一致性验证 选取20例PLT低值(<55×109L-1)末梢血标本,涂片染色后镜下观察无大PLT、小RBC/RBC碎片干扰,无PLT聚集等干扰现象。分别用Sysmex XS-800i分析仪、ADVIA 2120i分析仪和显微镜检法计数PLT。以镜检法为参考方法,通过线性回归分析血液分析仪与镜检法的一致性。
1.5影响因素评价
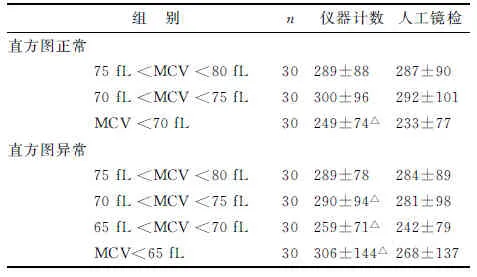
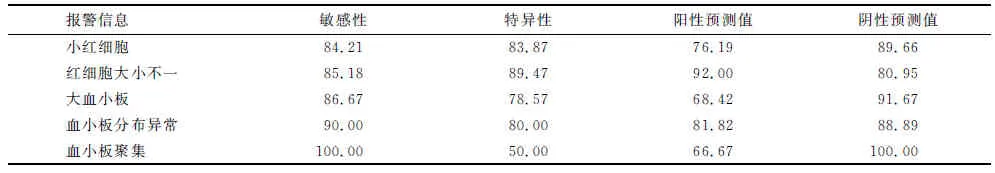
1.5.1小RBC干扰评价 分为2组实验。
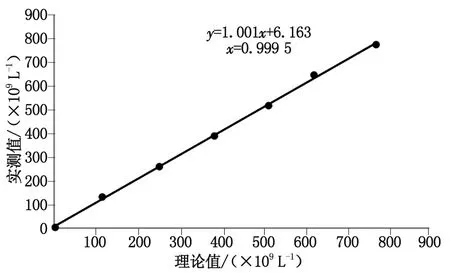
第1组实验选取PLT直方图正常、无大PLT且平均红细胞体积(mean corpuscular volume,MCV)<80 fL的末梢血标本90例。为了提供更精确的复检规则依据,本组中以80,75和70为节点分成3小组,即75 fL 第2组实验选取PLT直方图异常(峰高降低、右侧不平滑且不与横坐标相切、峰底变宽、翘尾等现象,或仪器有报警提示)、无大PLT且MCV<80 fL末梢血标本120例,因本实验室目前建立的复检规则为“MCV<65 fL时需镜检”,为了验证和细化该规则,本组按75 fL 1.6仪器报警有效性验证实验 影响PLT计数的报警类型主要为“小RBC”、“RBC大小不一”、“大PLT”“PLT分布异常”及“PLT聚集”。选取含上述报警和无报警的末梢血标本共189例进行人工涂片镜检。分别计算各仪器报警的敏感性、特异性、阳性预测值和阴性预测值。 1.7统计学处理 运用SPSS 17.0软件及Excel软件进行数据处理,对各组间差别性比较采用配对t或独立样本t检验,P<0.05为差别具有统计学意义。 2.1精密度分析 低、中、高值日内和批间精密度分别为4.27%,1.39%,1.15%和4.09%,1.38%,1.90%,均在可接受精密度范围内(≤5.0%)(表1)。 表1 精密度实验结果 2.2线性分析 对高、低值标本进行等浓度梯度稀释后,以理论计算值为x轴,实际测试值为y轴,回归方程为y=1.001x+6.163,r=0.999 5,实际测量值与理论计算值相关性良好,表明仪器在厂家提供的测量范围内线性良好(图1)。 图1 线性分析结果Fig 1 Results of linearity experiment 2.3携带污染率 PLT高值分别为H1:962×109L-1,H2:971×109L-1,H3:971×109L-1。低值分别为L1:22×109L-1,L2:21×109L-1,L3:21×109L-1。携带污染率为0.11%,符合标准要求(≤4.0%)。 2.4正确度验证 在测量范围内,Sysmex XS-800i与参加室间质评的西门子ADVIA 2120i的检测符合率达90%,符合标准要求(表2)。 2.5低值PLT一致性评价 对于低值范围内的PLT(11×109~55×109L-1),两台仪器检测与镜检法的一致性均良好,Sysmex XS-800i分析仪回归方程:y=8.575×10-1x+ 0.530 3,r=0.923 9。ADVIA 2120i分析仪回归方程y=8.746×10-1x+3.878,r=0.908 0。数据提示Sysmex XS-800i对11×109~55×109L-1范围内的低值PLT的准确性良好,略优于ADVIA 2120i(图2,3)。 2.6小RBC干扰评价 PLT直方图正常组与人工显微镜检计数相比,MCV<70 fL时仪器计数结果差别有统计学意义(P=0.004);PLT直方图异常组MCV<75 fL时,各实验组仪器检测结果差别有统计学意义(P=0.043,0.003,0.000)(表3)。 表2 正确度验证实验结果 图2 Sysmex XS-800i与镜检法的低值PLT检测一致性Fig 2 Correlation of Sysmex XS-800i with manual microscopy for low-value PLT count 图3 ADVIA2120i与镜检法的低值PLT检测一致性Fig 3 Correlation of ADVIA2120i with manual microscopy for low-value PLT count Tab3Comparation of PLT count between Sysmex XS-800i and manual microscopy in different small RBC groups 组别n仪器计数人工镜检直方图正常75fL MCV:平均红细胞体积. 与人工镜检比较,△:P<0.05. 表4不同大血小板组仪器与显微镜检血小板计数结果比较 Tab4Comparation of PLT count between Sysmex XS-800i and manual microscopy in different large PLT groups 组别n仪器计数人工镜检MPV>x+s20231±99238±103MPV>x+2s20262±144△275±149MPV>x+3s20207±121△224±131 MPV:平均血小板体积. 人工镜检比较,△:P<0.05. 2.8仪器报警有效性验证 影响仪器计数PLT的报警有效性验证结果如表5所示。各报警的敏感性、阴性预测值均较好。特异性较高的报警为“RBC大小不一”和“小RBC”,较差的是“PLT聚集”。阳性预测值最高的报警为“RBC大小不一”,较低的是“PLT聚集”和“大PLT”。 表5 影响血小板计数的相关报警有效性验证结果 多数医院使用全自动血液分析仪计数PLT。性能优越、稳定的仪器可以大大提高工作效率,缓解人力压力。但是,仪器计数只是“筛选”手段,各单位应全面了解仪器的检测性能,定期进行性能验证和评估[4],建立适用的人工镜检规则,以保证仪器计数的稳定性和准确性[7-9]。 本研究显示,PLT检测的精密度、携带污染率、线性、正确度均符合要求,提示Sysmex XS-800i仪检测PLT性能良好,结果可靠。低值PLT检测的准确性对于血液病诊断、输血意义重大。研究发现,对于低值PLT的检测,PLT-I和PLT-O检测的不精密度均较高[10]。本研究中,Sysmex XS-800i仪检测低值标本的不精密度高于中、高值标本。笔者还对低值标本仪器与人工的检测一致性进行了初步评估,研究发现在选取的PLT低值区间(11×109~55×109L-1),Sysmex XS-800i仪与镜检计数法的一致性良好,r=0.923 9,略优于使用光学法(PLT-O)的ADVIA 2120i仪(r=0.908 0),与文献报道的结论相符[11]。也有报道认为,当PLT数在20×109~50×109L-1及10×109~20×109L-1时,PLT-I法的AUC为0.895和0.830[12],表明PLT计数减少导致PLT-I检测的准确性下降,但是结果的可靠性依然较高。因此,在日常工作中对于低值PLT可使用PLT-I法检测,必要时采用镜检法进行确认。当怀疑低值结果是由标本质量问题或存在特殊情况干扰所导致时,更应该采用镜检法以便直观、真实地反映 PLT状况[13]。本研究中选取的标本例数尤其是极低值(<20×109L-1)的标本较少,后续研究中,还需增加标本数,以便对极低值标本的检测一致性进行更客观的评估。 [1] Briggs C,Harrison P,Machin S J.Continuing developments with the automated platelet count[J].IntJLabHematlo,2007,29(2):77-91. [2] 凌 励,周道银,惠小阳,等.激光染色法与电阻抗法检测PLT方法的比较[J].中华检验医学杂志,2004,27(10):717-718. [3] 中国合格评定国家认可委员会.CNAS-CL02(ISO15189:2012)医学实验室质量和能力认可准则[S].北京:中国计量出版社,2013. [4] 尚 红,王毓三,申子瑜.全国临床检验操作规程[M].4版.北京:人民卫生出版社,2014. [5] 中华人民共和国卫生部.WS/T 347-2011 血细胞分析校准指南[S]. 北京:人民卫生出版社,2011. [6] 中华人民共和国卫生部.WS/T 406-2012临床血液学检验常规项目分析质量要求[S]. 北京:人民卫生出版社,2012. [7] Rooh S. Implementation of international slide review criteria for improving the efficiency of the haematology laboratory[J].ApolloMedicine,2010,7(11):286-288. [8] 王 悦,刘汝锋,任颖佳,等.肿瘤专科血液复检规则的初步建立和评价[J].临床检验杂志,2013,31(1):1-3. [9] 王月芳, 江咏梅, 张 鸽,等.妇儿专科医院血液分析复检规则的建立及验证[J].检验医学,2013,28(4):296-300. [10] 黄 媛,黄春梅,李建英,等.XN-2000血液分析仪低值PLT计数复检规则的制定[J].临床检验杂志,2014,32(1):48-51. [11] 胡梅霞,李学梅.4种检测方法在低值血小板计数中的应用比较[J].检验医学与临床,2017,14(12):1828-1830. [12] 张 蕾,李晶华,李 智,等.Sysmex XE-2100全自动血液分析仪对低值血小板检测应用探讨[J].中华检验医学杂志,2010,33(5):457-459. [13] 华 江,潘 扬.不同检测方法计数血小板的准确性评价[J].临床检验杂志,2015,33(1):12-13.
2 结 果

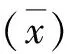

3 讨 论


