泛素羧基末端水解酶37在宫颈癌组织中的表达及对宫颈癌细胞增殖的影响
杨雪梅 傅晓冬
1西南医科大学临床医学院(四川泸州 611230);2四川崇州市妇幼保健院(四川崇州 611280)
在全球范围内,宫颈癌是女性发病率最高的恶性肿瘤之一,其致死率高居所有妇科系统肿瘤首位[1-3]。随着早期诊断技术的发展及综合治理手段的应用,宫颈癌的预后得到了显著的改善[4-6]。然而,目前对于宫颈癌发生及进展的病理生理机制我们仍知之甚少。根据分子标志物的表达情况,实施有针对性的靶向治疗也是极具潜力的治疗方式。因此,进一步寻找宫颈癌中潜在的治疗靶点,对于改善宫颈癌患者预后具有着极高的现实意义。
泛素羧基末端水解酶37(UCH37)是去泛素化酶家族成员,可与多种蛋白复合物相连,通过与蛋白酶体的相互作用,而去除与靶蛋白结合的泛素[7-8]。近年来,研究显示UCH37在多种肿瘤中表达水平异常升高,并可作为诊断和预后的分子标注物[9-10]。然而,宫颈癌组织中UCH37的表达及其对宫颈癌细胞增殖的影响,尚无研究报道。本研究拟通过qRT⁃PCR技术检测宫颈癌组织及癌旁组织中UCH37在的表达情况,并分析其临床相关性。本研究首次证明了UCH37在宫颈癌组织中表达异常升高,并与宫颈癌患者FIGO分期密切相关。更为重要的是,UCH37可促进宫颈癌HeLa细胞增殖,抑制其凋亡,是潜在的治疗靶点。
1 资料与方法
1.1一般资料收集在2013年1月至2015年12月期间西南医科大学附属医院妇产科接受宫颈癌根治术的67例患者肿瘤组织及配对癌旁组织标本。标本收取后冻于液氮中供后续提取RNA使用。入组患者在术后3个月后开始进行随访,随访截止时间点设定为患者因肿瘤复发死亡或至2016年12月31日。入组患者详细临床病理资料见表1。本研究已经西南医科大学附属医院伦理委员会审核并批准,所有入组患者均亲自签署知情同意书,授权课题组使用其组织标本进行本项科学研究。
1.2方法
1.2.1RNA提取及反转录将液氮冷冻过的组织研磨成粉末状,加入1 mL美国Sigma公司Trizol继续研磨至裂解液呈透明状。12 000 r/min 4℃离心5 min,上清转移至一新离心管中。加入裂解液1/5体积的氯仿,用力振荡至充分乳化。12 000 r/min 4℃离心15 min。吸上清液至一新的离心管中,加入等体积异丙醇,颠倒15次,静置10 min。12 000 r/min 4℃离心15 min。弃上清,75%的乙醇1 mL,12 000 r/min 4℃离心5 min。沉淀加入20 μL去离子水,即为所需RNA。反转录采用10 μL体系,RNA定量后,取1 μL RNA,加入2 μL日本TaKaRa公司5× PrimeScript RT master,7 μL去离子水。轻柔混匀后,进行反转录反应。反应条件为:37℃15 min,85℃ 5 s,4℃。
1.2.2qRT⁃PCR采用TaKaRa公司SYBR premix Ex TaqⅡ试剂盒进行实时定量PCR,首先配置PCR反应液,PCR反应采用25 μL体系,组分如下:12.5 μL SYBR premix Ex TaqⅡ,1 μL UCH37或β⁃actin正义链引物,1 μL UCH37或β⁃actin反义链引物,2 μL反转录产物,8.5 μL去离子水。PCR反应条件为:预变性 95℃ 30 s;扩增95℃ 15 s,60℃30 s,共40个循环。反应结束后样品保存于4℃。UCH37引物序列如下:正义链 5′⁃TGTCTCATG⁃GAAAGCGACCC⁃3′,反义链 5′⁃ACCACAACGGA⁃AACACG⁃3′;β⁃actin 引物序列如下:正义链 5′⁃CGTCTTCCCCTCCATCGT⁃3′?,反义链5′⁃GAAGGT⁃GTGGTGCCAGATTT⁃3′。 计算公式为:UCH37 相对表达量:2-ΔΔCt=2-((CTUCH37-CTβ⁃actin)待测样本–(CTUCH37-CTβ⁃actin)校准样本)。
1.2.3细胞增殖转染UCH37及UCH37 siRNAs 48 h至HeLa细胞,将转染UCH37 NC的HeLa细胞命名为UCH37⁃NC组,将转染UCH37 siRNA1的HeLa细胞命名为UCH37⁃siRNA1组,将转染UCH37 siRNA2的HeLa细胞命名为UCH37⁃siRNA2组。各组细胞接种于96孔板中,每组细胞设置8个复孔。培养 24、48、72、96、120 h后取 96孔板加入CCK⁃8试剂,37℃孵育45 min后,将96孔板置于酶标仪450 nm波长检测吸光度值,绘制细胞增殖曲线。
1.2.4细胞凋亡分组同1.2.3,制备细胞悬液,用5 mL PBS,1 000 r/min离心 5 min,反复洗涤3次后,弃上清;加入100 μL流式洗液和FITC标记的Annexin⁃V(20 μg/mL)10 μL,及PI(50 μg/mL)5 μL,避光反应20 min后,加入400 μL流式洗液,同时以加入FITC标记的Annexin⁃V及PI的同型对照抗体细胞作为同型对照。利用FACScan流式细胞仪检测。
1.2.5细胞周期取分组同1.2.3。制备细胞悬液,用5 mL PBS,1 000 r/min离心5 min,反复洗涤3次后,弃上清;加入100 μL流式洗液及PI(50 μg/mL)5 μL,避光反应20 min后,加入400 μL流式洗液,同时以加入PI的同型对照抗体细胞作为同型对照。利用FACScan流式细胞仪检测。
1.3统计学方法本研究均采用IBM SPSS 22.0进行统计学分析,计量资料数据以表示,利用t检验分析67例宫颈癌患者癌组织及癌旁组织中UCH37的表达差异,利用Spearman秩相关分析UCH37与宫颈癌患者临床病理特征的相关性,利用方差分析及t检验分析UCH37⁃NC组与UCH37⁃siRNAs组增殖、凋亡和周期的差异,所有统计数据以P<0.05为差异具有统计学意义。
2 结果
2.1UCH37 mRNA在宫颈癌及癌旁组织中的表达差异qRT⁃PCR结果显示,宫颈癌组织中UCH37表达水平为7.237±1.452,癌旁组织UCH37的表达水平为1.514±0.275。利用t检验分析67例宫颈癌患者癌组织及癌旁组织UCH37表达情况,发现两者之间UCH37 mRNA表达水平差异具有统计学意义(图1,t=6.328,P=0.007),宫颈癌组织中UCH37 mRNA的表达水平高于癌旁组织。
2.2UCH37的表达与宫颈癌患者临床病理特征的关系以UCH37 mRNA表达水平的均数4.52为界限,将宫颈癌患者分为UCH37高表达组及UCH37低表达组,其中,UCH37高表达组患者例数为37例,UCH37低表达组例数为30例。利用Spearman秩相关分析UCH37表达水平与宫颈癌患者临床病理特征的相关性。结果显示:UCH37的表达水平与宫颈癌患者FIGO分期(P=0.032,表1)呈正相关,而与其他病理特征无显著相关性(表1)。

表1 宫颈癌临床病理特征与USP表达水平的关系Tab.1 The association between clinical features of cervical cancer and UCH37 mRNA expression 例
2.3UCH37对宫颈癌HeLa细胞增殖的影响qRT⁃PCR结果显示,转染UCH⁃siRNAs的HeLa细胞中,UCH37的表达水平较转染UCH⁃NC者显著下调,两条针对UCH37的siRNA均可显著抑制HeLa细胞中UCH37的表达(图2A,P<0.05)。CCK⁃8实验显示,转染UCH37⁃siRNAs的HeLa细胞增殖能力较转染UCH37⁃NC组增殖能力显著降低(图2B,t=4.143,P=0.035)。以上结果提示,UCH37可促进宫颈癌HeLa细胞的增殖。
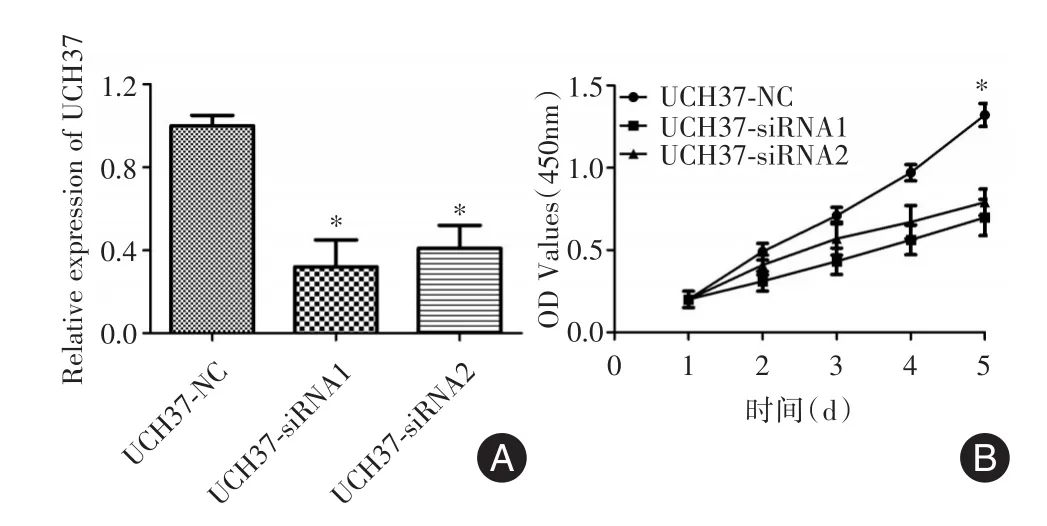
图2 UCH37对HeLa细胞增殖的影响Fig.2 Effects of UCH37 on the proliferation of HeLa cells
2.4UCH37对宫颈癌HeLa细胞凋亡的影响转染UCH37⁃siRNAs的HeLa细胞凋亡细胞(第2象限+第4象限)比例显著高于转染UCH37⁃NC组(图3,t=5.768,P=0.014)。以上结果提示,沉默HeLa细胞中UCH37的表达可促进细胞凋亡。
2.5UCH37对宫颈癌HeLa细胞周期的影响转染UCH37⁃siRNAs的HeLa细胞G1期细胞比例显著高于转染UCH37⁃NC组(图3,P< 0.05),而S期细胞比例则显著低于转染UCH37⁃NC组(图3,t=3.134,P=0.041),两组G2期细胞比例无显著差异。以上结果提示,沉默HeLa细胞中UCH37的表达可阻滞细胞周期于G1期。
3 讨论
UCH37是去泛素化酶家族成员,可与多种蛋白复合物相结合而进一步发挥功能。其主要机制为通过与蛋白酶体相互作用,移除靶蛋白的泛素,使靶蛋白免于被泛素酶水解[7-8]。近年来,蛋白酶体的去泛素化酶已成为新兴的抗癌靶点[11-12]。UCH37也被证实在多种肿瘤中表达异常上调,如卵巢上皮癌、肝细胞癌[9]和食管鳞状上皮癌[10]。在这些肿瘤中,异常高表达的UCH37与肿瘤的恶性病理特征及不良预后密切相关。与这些研究相符,本研究结果显示,UCH37在宫颈癌组织中表达水平显著高于癌旁组织。更为重要的是,UCH37表达水平与宫颈癌FIGO分期呈正相关,提示其可能参与宫颈癌的进展。

图3 UCH37对HeLa细胞凋亡的影响Fig.3 Effects of UCH37 on the apoptosis of HeLa cells
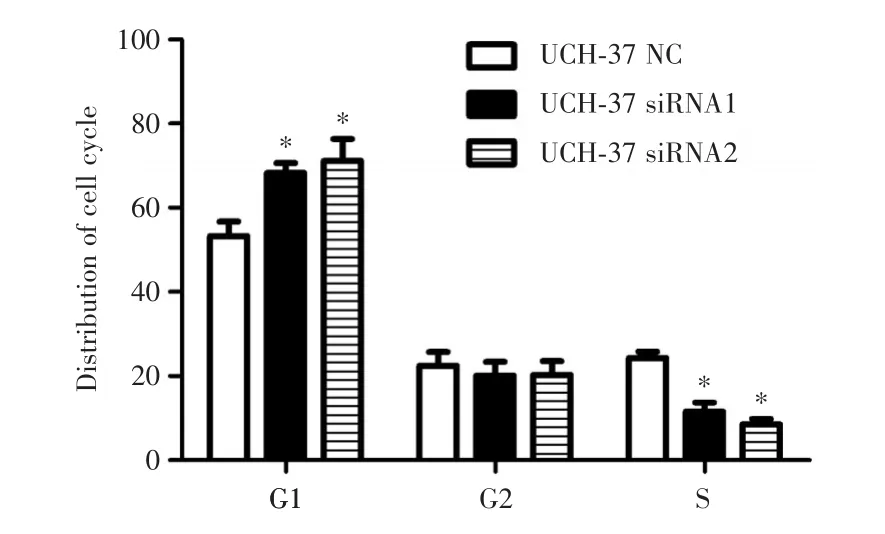
图4 UCH37对HeLa细胞周期的影响Fig.4 Effects of UCH37 on cell cycle of HeLa cells
UCH在肿瘤中发挥功能的方式主要通过与肿瘤发生及进展中的关键分子结合并移除其表面的泛素。如在肝细胞癌中,UCH37通过与RNA剪切的关键分子PRP19相结合,并使其去泛素化,从而促进肝细胞癌的侵袭及转移[9]。另有研究表明,UCH37可移除E2启动子区结合分子1(E2 promoter binding factor 1,E2F1)表面的赖氨酸-63连接的泛素,而促进其转录活化。此外,沉默UCH37的表达后,E2F1增殖相关的靶分子的表达水平亦相应降低,肿瘤的生长也受到显著抑制。此外,沉默UCH37的表达后,可活化Caspase⁃9和Capase⁃3的表达,从而促进细胞凋亡。本研究结果显示,沉默宫颈癌HeLa细胞中UCH37的表达后细胞增殖受到明显抑制,而凋亡细胞比率则明显增多,细胞周期被阻滞于G1期。以上研究及本研究结果提示,UCH37在肿瘤的增殖与凋亡中发挥着总要的调控作用。
综上所述,本研究通过检测宫颈癌组织及癌旁组织中UCH37 mRNA的表达水平及相关统计分析,初步证实了UCH37在宫颈癌组织中表达异常升高,并与宫颈癌患者FIGO分期密切相关。更为重要的是,UCH37可促进宫颈癌HeLa细胞增殖,抑制其凋亡。本研究结果提示UCH37在宫颈癌为潜在的致癌分子,是潜在的治疗靶点。
[1]TORRE L A,BRAY F,SIEGEL R L,et al.Global cancer sta⁃tistics,2012[J].CA Cancer J Clin,2015,65(2):87⁃108.
[2]陈悦张小薇,邓志校,等.P16基因表达与宫颈癌预后相关性分析[J].实用医学杂志,2014,30(15):2417⁃2420.
[3]汪青松,杨林.根治性子宫切除术联合辅助放疗与同步放化疗治疗宫颈癌比较[J].实用医学杂志,2016,32(23):3886⁃3889.
[4]LI J,NING N Y,RAO Q X,et al.Pretreatment glycemic con⁃trol status is an independent prognostic factor for cervical can⁃cer patients receiving neoadjuvant chemotherapy for locally ad⁃vanced disease[J].BMC Cancer,2017,17(1):517.
[5]BANERJEE S.Bevacizumab in cervical cancer:a step forward for survival[J].Lancet,2017[Epub ahead of print].
[6]夏作利,陈国荣,潘丹,等.HPV E6/E7联合液基细胞学检查在宫颈癌前病变筛查中的意义[J].实用医学杂志,2017,32(18):3053⁃3056.
[7]YAO T,SONG L,JIN J,et al.Distinct modes of regulation of the Uch37 deubiquitinating enzyme in the proteasome and in the Ino80 chromatin⁃remodeling complex[J].Mol Cell,2008,31(6):909⁃917.
[8]YAO T,SONG L,XU W,et al.Proteasome recruitment and activation of the Uch37 deubiquitinating enzyme by Adrm1[J].Nat Cell Biol,2006,8(9):994⁃1002.
[9]FANG Y,FU D,TANG W,et al.Ubiquitin C⁃terminal Hydro⁃lase 37,a novel predictor for hepatocellular carcinoma recur⁃rence,promotes cell migration and invasion via interacting and deubiquitinating PRP19[J].Biochim Biophys Acta,2013,1833(3):559⁃572.
[10]CHEN Y,FU D,XI J,et al.Expression and clinical signifi⁃cance of UCH37 in human esophageal squamous cell carcinoma[J].Dig Dis Sci,2012,57(9):2310⁃2317.
[11]D′ARCY P,BRNJIC S,OLOFSSON M H,et al.Inhibition of proteasome deubiquitinating activity as a new cancer therapy[J].Nat Med,2011,17(12):1636⁃1640.
[12]TIAN Z,D′ARCY P,WANG X,et al.A novel small molecule inhibitor of deubiquitylating enzyme USP14 and UCHL5 induc⁃es apoptosis in multiple myeloma and overcomes bortezomib re⁃sistance[J].Blood,2014,123(5):706⁃716.

