巢湖水中溶解性有机物分子大小分布、亲疏水性与消毒副产物的生成势
陈 铭,徐 斌,王安琪,张 帆
(同济大学污染控制与资源化研究国家重点实验室,长江水环境教育部重点实验室,上海 200092)
巢湖是我国五大淡水湖之一,是安徽省第一大湖泊,也是巢湖市唯一的水源地。但随着环巢湖地区社会经济的蓬勃发展,内外源联合胁迫的污染负荷正严重威胁着巢湖地区的饮用水安全[1]。目前微污染巢湖原水存在的有机物和氨氮含量增高、水体富营养化、藻类繁生等问题日益受到广泛重视。
水源水中溶解性有机物(DOM)主要由天然有机物(NOM)和人工排放有机物所组成。NOMs主要指动物、植物和微生物的排泄物或分泌物及它们的尸体在降解过程中产生的腐殖质类物质,是水中有机污染物的重要来源[2-3];受工农业排放影响,人工排放有机物在微污染原水DOM中的占比也相当大。鉴于水中DOM与消毒剂反应生成的消毒副产物(DBPs)是饮用水产生致突变性的主要因素[4-5],因此长期以来水中的DOM及其涉及到的DBPs问题受到了研究人员广泛的关注。
由于不同水源的水质条件千差万别,水中有机物组成的差异性也较大,因此不同原水经过氯消毒后生成DBPs的数量和种类也有很大的不同。目前关于我国长江、黄河、珠江、黄浦江等重要水源中有机物的组成特性已有较多文献报道[6]。相关研究也发现微污染原水中的有机物主要以分子大小(MS)<5 kDa的小分子有机物和亲水性有机物为主,可生成DBPs的前体物主要是MS<10 kDa的有机物[7-9],小分子和含双键的有机物是DBPs的主要前体物[10-11],酚类和具羧基结构的DOM是导致三卤甲烷(THMs)生成的主要有机物种类[12-13]。
本文以微污染巢湖原水为研究对象,通过有机物的分子大小和亲疏水性分析,系统考察了巢湖原水有机物的分子组成规律,研究了不同分子大小区间有机物的DBPs生成潜能,以期为巢湖市饮用水处理工艺的提升提供技术支撑。
1 材料与方法
1.1 试验试剂和材料
试验使用的氯化钠硫酸、氢氧化钾、氢氧化钠(>98%)、磷酸二氢钾(>99%)、氯化铵、次氯酸钠(4.00%~4.99%)等试剂均为优级和分析纯试剂。试验所用溶液采用超纯水配制,超纯水来自Milli-Q超纯水机(Reference型,美国Millpore)。采用PHS-3G型pH计(上海雷磁)测定pH。采用754型紫外可见分光光度计(上海恒平)测定UV254。采用SD-1A总氮检测仪测定氨氮(上海海争)。
试验所用DBPs标准样品有三卤甲烷混标(包括三氯甲烷、三氯乙烷、三氯乙烯、四氯化碳、一氯二溴甲烷、1,2-二溴乙烷、二氯一溴甲烷、三溴甲烷、四氯乙烯和1,2-二溴-3-氯丙烷共10种物质)及其他含氮消毒副产物(N-DBPs)与含碳消毒副产物(C-DBPs)混标(主要含二氯乙腈、三氯乙腈、二溴乙腈、1,1-二氯丙酮、1-溴-1-氯乙腈、三氯硝基甲烷、1,1,1-三氯丙酮等),均采购自美国Sigma-Aldrich公司。
水样氯化DBPs生成潜能试验均需在25±1 ℃的严格控温条件下进行,恒温设备采用LRH系列生化培养箱(上海一恒)。THMs、卤乙腈及三氯硝基甲烷等挥发性DBPs均采用GC-ECD方法分析,使用仪器为GC2010(岛津),采用HP5毛细管柱(30 m×0.25 mm,0.25 μm,J&W)作为色谱分离柱。
试验考察巢湖原水的一般性化学指标包括pH、有机物指标(DOC和UV254)和其他一些常规指标(总硬度和氨氮),结果如表1所示。
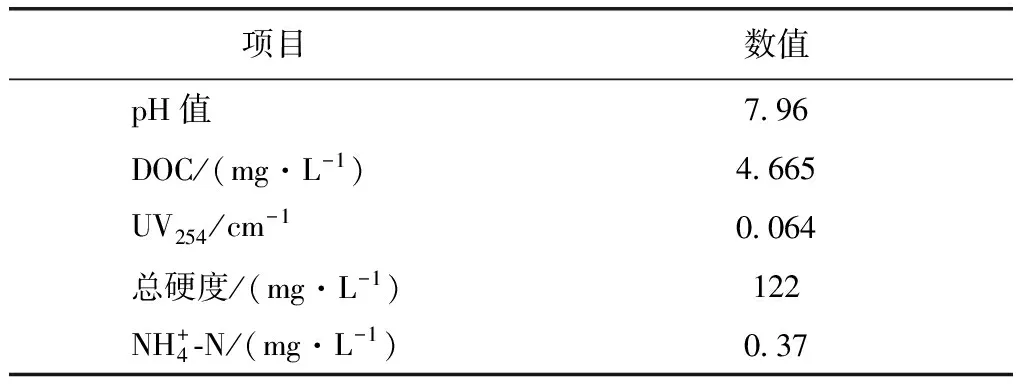
表1 巢湖原水的一般化学指标
1.2 试验方法
为对比和分析巢湖原水中DOM的分子大小分布,试验采用超滤膜法对原水中不同分子大小的DOM进行了分离。原水经0.45 μm的微滤膜过滤后,分别用截留MS为30、10、5、1 kDa的超滤膜(UF膜)将水样中不同分子大小的DOM分成5组测定,有效膜面积均为33.2 cm2,由高纯氮(99.999%)提供过膜压力,并将压力控制在0.15 MPa左右。
利用Amberlite DAX-8、XAD-4树脂(罗门哈斯)对原水中的有机物进行亲疏水性分离,具体方法参照Thurman等[14]。
取50 mL各分子大小区间的水样倒入洗净的烧杯,加氯前标定氯的浓度,加氯量根据各水样的DOC等水质参数值,按式(1)计算。调节溶液pH值为7±0.02,选用磷酸二氢钾-氢氧化钠缓冲溶液体系,使水样中缓冲溶液的浓度达到10 mol/L。将以上水样顶空装满45 mL的安培瓶,并使用带有聚四氟乙烯垫片的盖子拧紧,必须保证培养瓶无气泡。将水样置于黑暗环境的培养箱进行培养,温度控制为25±1 ℃。培养7 d后生成潜能反应试验结束,在培养液中加入过量的氯化铵将余氯进行淬灭。
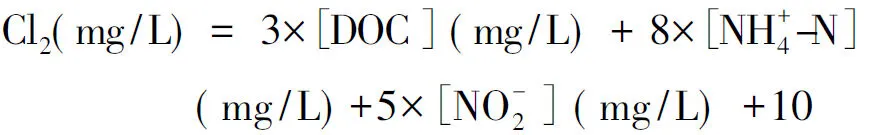
(1)
2 结果与讨论
2.1 巢湖原水中DOM的分子大小分布特性
水中有机物的分子大小及形态不但对水处理工艺流程的选择有着较大的影响,而且对DBPs的生成也起着极为重要的作用。因此,试验采用超滤膜法对巢湖原水中的DOM进行分子大小分离,DOM的分子大小分布情况如图1所示。

图1 巢湖原水中DOM的分子大小分布
由图1可知,MS<1 kDa的组分DOC所占的比例最高,达到总量的近一半。其他分子大小的组分DOC占比均未超过总量的15%。而MS<5 kDa组分的DOC含量约占总量的75%,这说明巢湖原水中DOM的存在形式以小分子有机物为主。在UV254含量方面,MS<1 kDa和5~10 kDaDOM的UV254占比均在35%左右,其他区间组分所占百分比较低。DOM的DOC分布和UV254分布并没有完全统一,这说明虽然小分子有机物是巢湖原水DOM的主要形式,但含共轭双键及苯环的有机物在MS<1 kDa和5~10 kDa均有大量分布[15]。
由以上分析可知,巢湖原水中小分子有机物所占比例最大,而小分子有机物不容易在混凝沉淀过程中去除,且极易被微生物直接利用,从而造成管道内微生物繁殖,使饮用水水质的生物安全性降低[16]。因此,在巢湖既有水厂的工艺改造以及新建水厂的工艺选择过程中,应该要特别关注原水中小分子有机物的去除问题。
2.2 巢湖原水中DOM的亲疏水性分布特性
水中DOM的亲疏水特性同样对饮用水中DBPs的生成有很大的影响。试验采用树脂分离法分析巢湖原水中DOM的亲疏水分布特性,三种亲疏水性有机物组分的DOC含量和UV254百分比如图2所示。

图2 巢湖原水中DOM的亲疏水性分布
用DOC含量表征各亲疏水性有机物组分的分布,强疏水组分的DOC含量所占比例最高,其DOC含量占比超过总量的一半。其次是亲水组分,其DOC含量占比接近总量的三分之一,弱疏水组分占比最少,仅为10%左右。强疏水、亲水和弱疏水组分的UV254占总量的百分比分别为43.48%、39.13%和17.39%。由此可见,巢湖原水各亲疏水性组分的UV254与DOC分布比较统一。
DOC和UV254都能较好地反应巢湖原水中DOM亲疏水性的分布。其中疏水性有机物的比例用DOC含量表征时接近70%,而用UV254表征时约为61%。有学者认为,当疏水性有机物占水中DOM的百分比为70%以上时,水源水质较好[17],而巢湖原水中亲水性组分占比超过30%,由此可判断巢湖原水属于微污染原水。其原因可能是巢湖第二水厂的原水取自巢湖东半湖,其受到人类活动的影响较大,导致原水中的亲水性有机物有一定程度的富集。由于疏水性DOM主要由腐植酸和富里酸等组成,而亲水性DOM则包含更多的脂肪族碳氮化合物,如氨基酸、糖类和碳水化合物等[18]。因此,巢湖原水中腐植酸和富里酸等有机物的含量相对较多。
2.3 不同分子大小组分的氯化THMs生成潜能
经过氯化潜能培养后,巢湖原水可生成全部四种THMs。由图3可知,各分子大小区间的组分都有一定量的THMs生成,但是各区间组分的THMs生成量不尽相同。
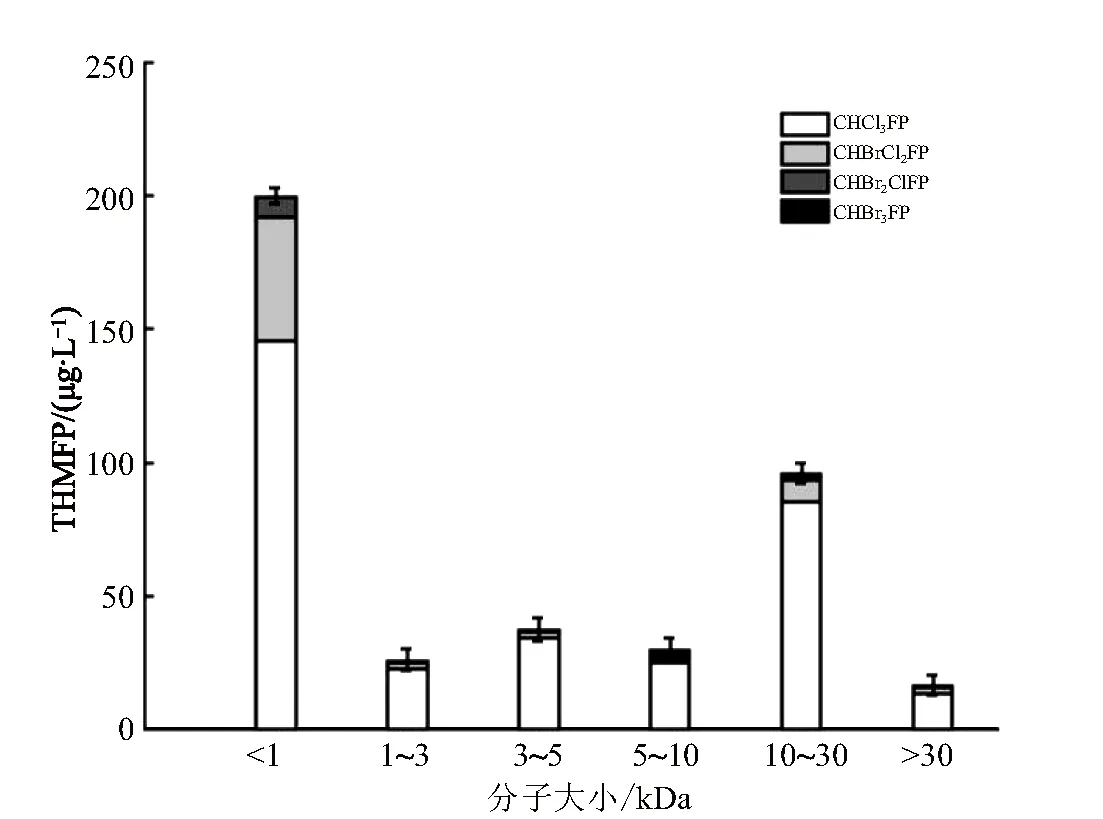
图3 不同分子大小DOM的氯化THMs生成潜能(THMFP)
其中,MS<1 kDa的组分具有最高的THMs生成潜能(THMFP),其浓度为143.66 μg/L,占总THMFP的44.84%。而值得注意的是,MS为10~30 kDa的有机物组分对THMs的生成也有不小的贡献。
在四种THMs中,各分子大小区间的组分生成氯仿(CF)的浓度最高,达到了320.37 μg/L;同时,溴代THMs的生成潜能按由高到低的顺序依次为一溴二氯甲烷(BDCM)>二溴一氯甲烷(DBCM)>溴仿(BF),且MS<1 kDa组分的生成潜能最大。
由上述分析可知,巢湖原水经氯化培养后可生成BF,这主要是因为原水中Br-的浓度较高,达到了230 μg/L。MS<1 kDa的有机物组分具有最高的THMFP,这一结果说明MS<1 kDa的组分是生成THMs的主要前体物,这与前人的研究结果一致[19-21]。一般而言,大分子DOM多是脂肪链物质,而小分子DOM多含有苯环和羧基[20]。后者更易生成THMs[10,20],因此巢湖原水中MS<1 kDa的有机物组分经氯化培养后生成THMs的量最大。
2.4 不同分子大小组分的氯化N-DBPs生成潜能
本次试验检测的N-DBPs主要包括两大类,分别是卤乙腈(HANs)和硝基甲烷(HNMs),其中HANs包括二氯乙腈(DCAN)、三卤乙腈(TCAN)、一氯一溴乙腈(BCAN)以及二溴乙腈(DBAN)。各分子大小区间组分的N-DBPs生成潜能(N-DBPFP)如图4所示。
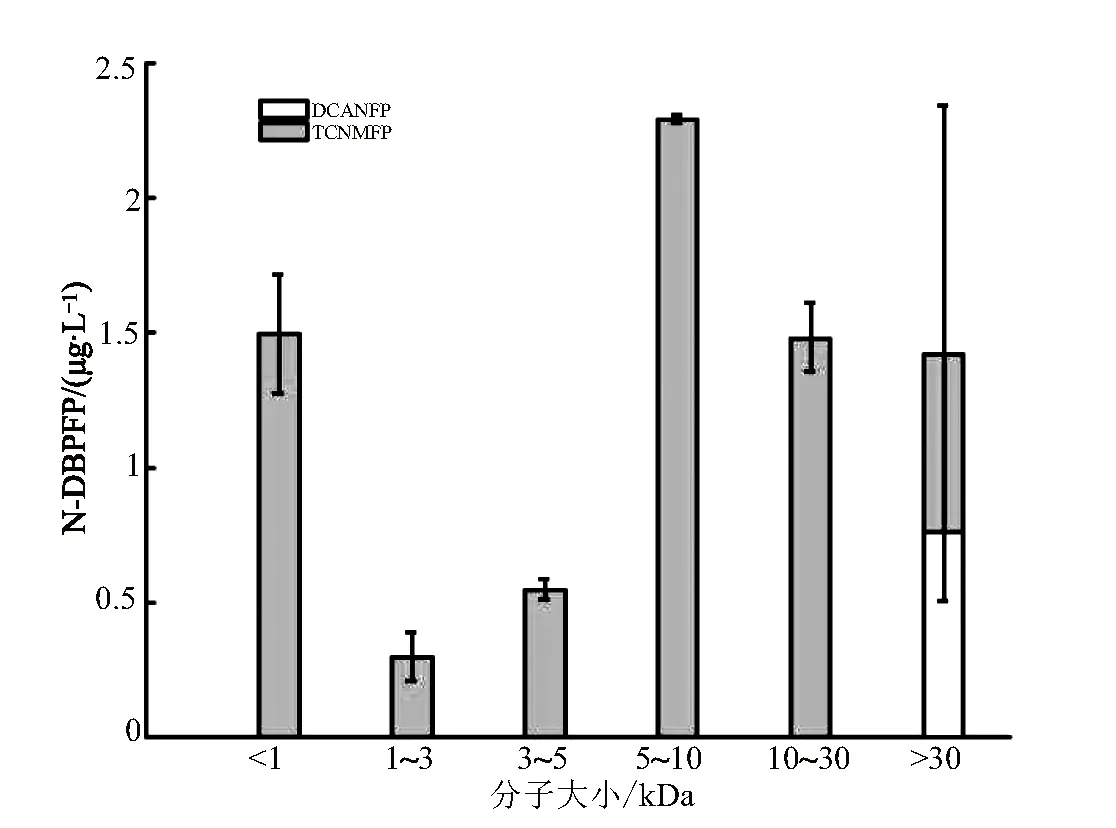
图4 不同分子大小DOM的氯化N-DBPs生成潜能(N-DPBFP)
巢湖原水中的DOM只能生成DCAN和三氯硝基甲烷(TCNM)这两种N-DBPs,且主要产物是TCNM。对比各分子大小区间组分的N-DBPFP可以发现,MS为5~10 kDa的组分具有最高的N-DBPFP,其浓度为2.3 μg/L;而其他分子大小区间组分生成的N-DBPs浓度都小于1.5 μg/L。只有MS>30 kDa的组分生成了DCAN,生成量为1.1 μg/L。有研究表明,TCNM的前体物是具有短链氨基酸结构的溶解性含氮有机物(DON),而苯环结构的小分子有机物都不是TCNM的主要前体物[22],所以相比小分子组分,MS为5~10 kDa组分TCNM的生成潜能更大。
2.5 不同分子大小组分的氯化卤代酮类DBPs生成潜能
巢湖原水在进行氯化培养时,主要生成的卤代酮类DBPs(HKs)有二氯丙酮(DCP)、三氯丙酮(TCP)等(图5)。其中仅有MS>30 kDa的DOM组分生成了0.95 μg/L的DCP。TCP主要由MS<1 kDa以及MS为10~30 kDa的组分生成,含量分别为2.86 μg/L和2.57 μg/L。MS分别为1~3 kDa、3~5 kDa和5~10 kDa的组分也有少量TCP生成。
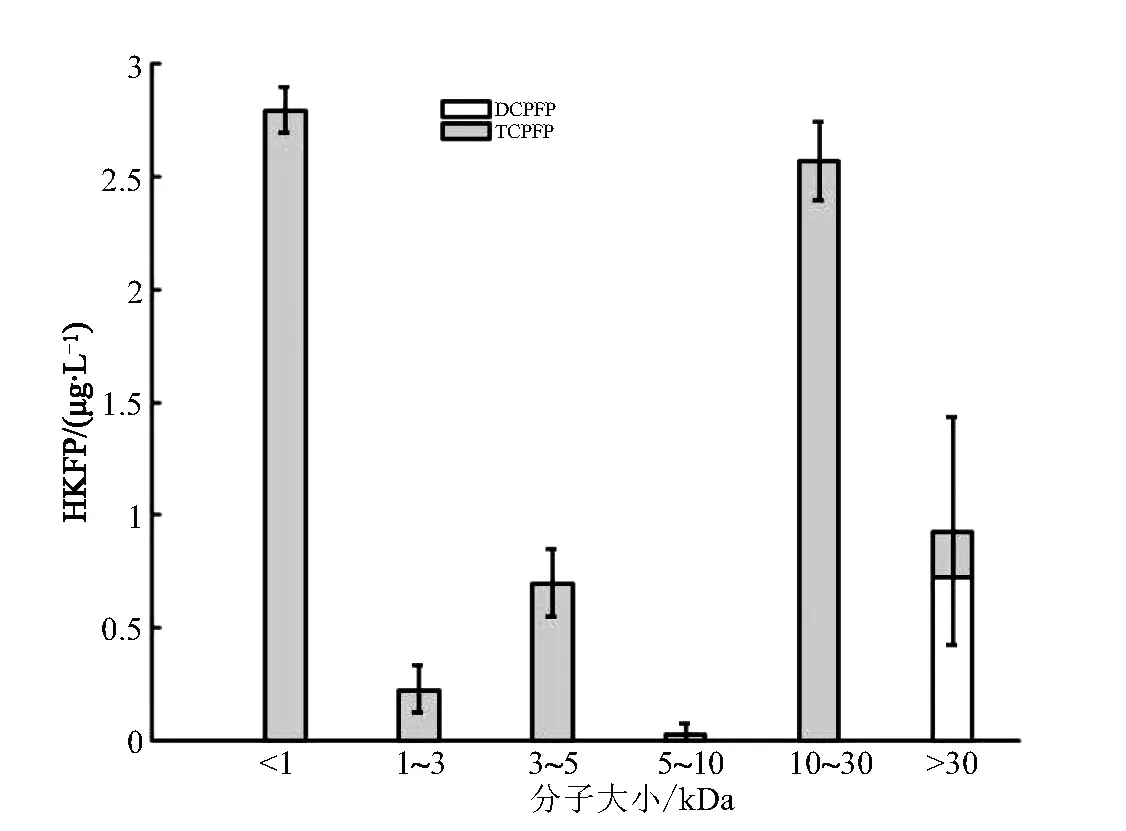
图5 不同分子大小DOM的氯化HKs生成潜能(HKFP)
DCP生成量少的原因可能是反应过程中其自身的碳碳双键被打断,使得羟基中的碳碳双键成为单键,进一步与氯反应生成了TCP所致[23]。而TCP可以继续发生该反应,并与次氯酸进一步反应生成THMs。所以从最终结果考虑,采用氯消毒并控制水中自由氯的浓度在一定水平,一定程度上可以抑制HKs的生成。
2.6 不同亲疏水性组分的氯化THMs生成潜能
水中DOM的亲疏水性与DBPs的生成特性有很大关联,不同亲疏水性的DOM组分在氯化DBPs的生成特性方面表现出巨大的差异。巢湖原水中各亲疏水性组分的THMFP结果如图6所示。

图6 不同亲疏水性DOM的氯化THMs生成潜能(THMFP)
分析可知,各亲疏水性组分按生成THMs的总量从大到小依次为:强疏水组分>亲水组分>弱疏水组分,各组分THMs的生成浓度分别为484.47、123.86、7.83 μg/L。其中,各组分的氯仿生成潜能(CFFP)大小顺序与上述THMs总量排序一致,但是强疏水组分的CFFP远大于其他两种组分,强疏水组分生成的CF含量占到总量的85.1%。而亲水组分和弱疏水组分的CFFP浓度分别为76.59 μg/L和2.35 μg/L,亲水组分的CF生成量同样远高于弱疏水组分。这一现象可以解释为,THMs的前体物主要是疏水性DOC[24-25],其中带有苯酚基团的疏水性物质比带有羧基亲水基团的弱疏水性物质更容易生成卤仿[24]。巢湖原水氯化培养后,亲水组分的二氯一溴甲烷生成潜能(BDCMFP)达到38.7 μg/L,大于强疏水组分的27.61 μg/L,而弱疏水组分仅为5.24 μg/L。
2.7 不同亲疏水性组分的氯化N-DBPs生成潜能
经过氯化培养,巢湖原水中不同亲疏水性组分的N-DBPFP分布如图7所示。试验结果显示,各组分的培养产物只有二氯乙腈(DCAN)和三氯硝基甲烷(TCNM),其中DCAN是主要产物,未检测出溴代含氮副产物生成。其中,强疏水组分具有最大的N-DBPFP,浓度达到了65.03 μg/L,约为总量的62.5%;弱疏水组分次之,亲水组分生成的含氮DBPs最少。根据之前的研究,DCAN的前体物主要有含氮杂环核酸和腐植酸中氨基酸结构[26],疏水性氨基酸如亮氨酸、色氨酸等比其他结构法的氨基酸能产生更多的DCAN[27]。由此可见,DOM的亲疏水性对N-DBPs的生成具有重要影响,结合本试验的结果可以推测,疏水性强的DOM具有更大的N-DBPFP。
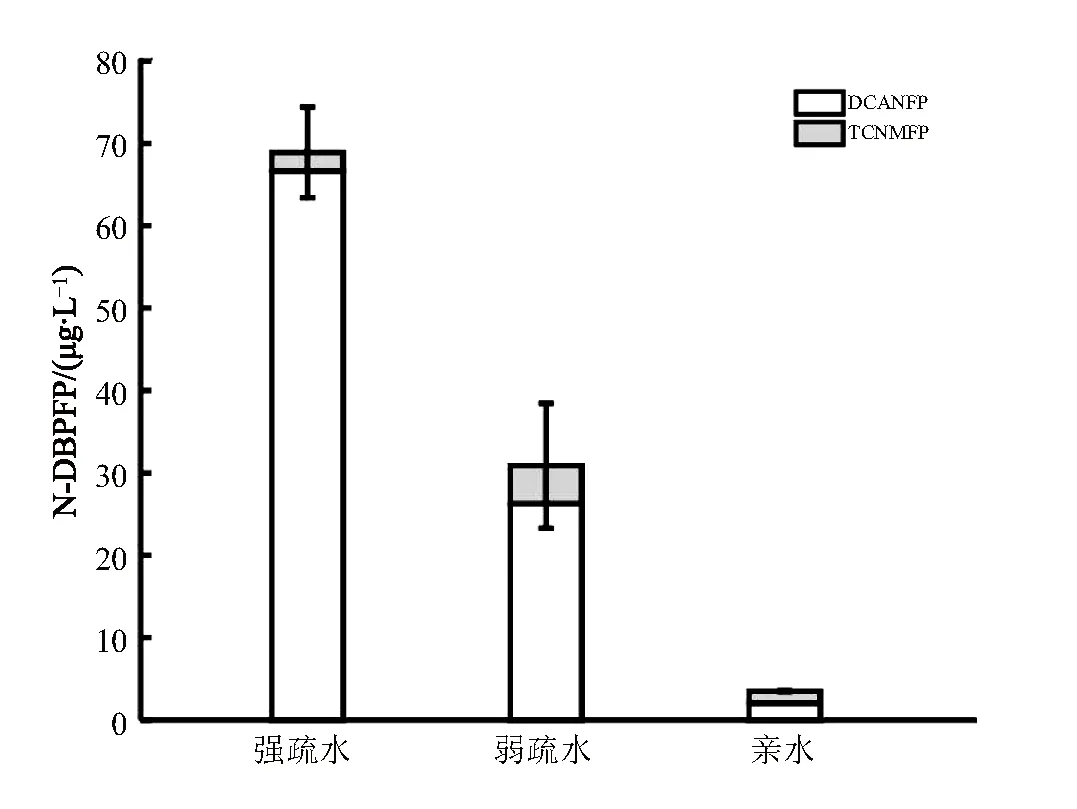
图7 不同亲疏水性DOM的氯化N-DBPs生成潜能(N-DPBFP)
2.8 不同亲疏水性组分的氯化卤代酮DBPs生成潜能
经过氯化培养,巢湖原水中不同亲疏水性组分的HKs生成潜能如图8所示。
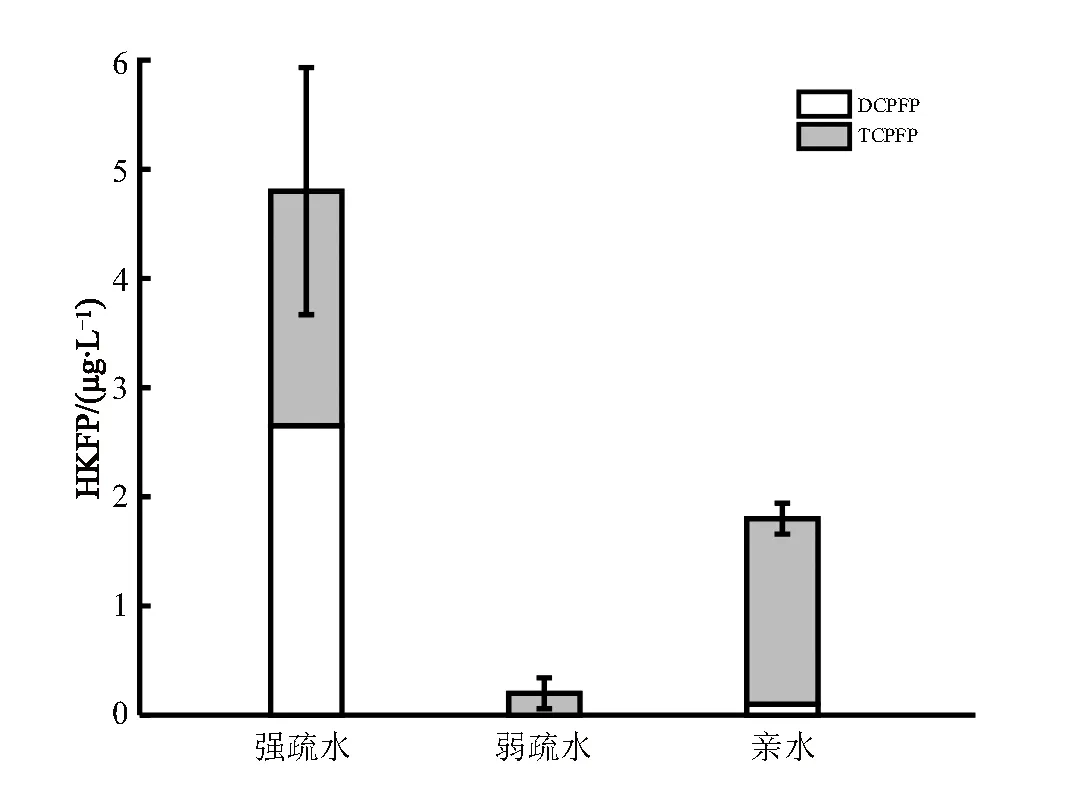
图8 不同亲疏水性DOM的氯化HKs生成潜能
由图8可知,氯化培养后巢湖原水中不同亲疏水性组分的HKFP大小依次为强疏水组分>亲水性组分>弱疏水组分,HKFP总量分别为4.8、1.74、0.27 μg/L。其中TCP的含量占据各组分HKs总生成量的一半以上,分别达到2.80、1.62、0.27 μg/L;而DCP基本上仅由强疏水组分生成。根据前人的研究,强疏水性DOM和亲水性DOM是生成HKs最主要的前体物,而弱疏水性DOM的HKFP最小[28],加之强疏水性DOM的含量最高,由此可以很好的解释这一结果。
3 结论
(1)微污染巢湖原水中MS<5 kDa的有机物组分占比超过70%,水中DOM主要以小分子形式存在。巢湖原水有DOM含量最多的是强疏水组分,其次分别是亲水组分和弱疏水组分。其中疏水组分接近70%,说明巢湖原水属于微污染源水。
(2)巢湖原水中MS<1 kDa的有机物组分具有最高的THMFP,其中三氯甲烷的生成潜能最高,二氯一溴甲烷其次;MS为5~10 kDa的组分具有最高的N-DBPFP,其浓度约为2.3 μg/L,其他分子大小区间组分的N-DBP生成量均小于1.5 μg/L;试验中生成的HKs主要是三氯丙酮,MS为<1 kDa和10~30 kDa的组分分别生成2.86 μg/L和2.33 μg/L。
(3)各亲疏水性组分按THMFP和HKFP从大到小依次为:强疏水组分>亲水组分>弱疏水组分。强疏水组分同样有最大的N-DBPFP,弱疏水组分的N-DBPFP接近强疏水组分的一半,亲水组分具有最小的N-DBPFP。总体来说,巢湖原水中的强疏水性DOM具有最大的DBPFP。
[1]聂隽,陈红枫.区划调整后巢湖水污染治理的机遇与挑战——基于排污权交易的巢湖水质管理研究[J].中国环境管理,2012(4):35-38.
[2]Evans C D,Monteith D T,Cooper D M.Long-term increases in surface water dissolved organic carbon:Observations,possible causes and environmental impacts[J].Environmental Pollution,2005,137(1):55-71.
[3]Rebhun M,Lurie M.Control of organic matter by coagulation and floc separation[J].Water Science and Technology,1993,27(11):1-20.
[4]Bond T,Goslan E H,Parsons S A,etal.Treatment of disinfection by-product precursors[J].Environmental Technology,2011,32(1):1-25.
[5]Bond T,Templeton M R,Graham N.Precursors of nitrogenous disinfection by-products in drinking water-A critical review and analysis[J].Journal of Hazardous Materials,2012(2):1-16.
[6]程拓,徐斌,朱贺振,等.南水北调丹江口水库原水有机物分子组成规律及其强化混凝处理的效能对比[J].环境科学,2015,36(3):898-904.
[7]Ates N,Yilmaz L,Kitis M,etal.Removal of disinfection by-product precursors by UF and NF membranes in low-SUVA waters[J].Journal of Membrane Science,2009,328(1-2):104-112.
[8]Croue J P,Korshin G V,Benjamin M M.Characterization of natural organic matter in drinking water[M].Denver,CO:AWWA Research Foundation,2000.
[9]Marhaba T F,Van D.The variation of mass and disinfection by-product formation potential of dissolved organic matter fractions along a conventional surface water treatment plant[J].Journal of Hazardous Materials,2000,74(3):133-147.
[10]Schnoor J L,Nitzschke J L,Lucas R D,etal.Trihalomethane yields as a function of precursor molecular weight[J].Environmental Science & Technology,1979,13(9):1134-1138.
[11]Wei Q,Wang D,Wei Q,etal.Size and resin fractionations of dissolved organic matter and trihalomethane precursors from four typical source waters in China[J].Environmental Monitoring and Assessment,2008,141(1-3):347-357.
[12]Leenheer J A.Comprehensive approach to preparative isolation and fractionation of dissolved organic carbon from natural waters and wastewaters[J].Environmental Science & Technology,1981,15(5):578-587.
[13]Lin C F,Liu S H,Hao O J.Effect of functional groups of humic substances on UF performance[J].Water Research,2001,35(10):2395-2402.
[14]Thurman E M,Malcolm R L.Preparative isolation of aquatic humic substances[J].Environmental Science & Technology,1981,15(4):463-466.
[15]蒋绍阶,刘宗源.UV254作为水处理中有机物控制指标的意义[J].重庆建筑大学学报,2002,24(2):61-65.
[16]Hua G,Reckhow D A.Characterization of disinfection byproduct precursors based on hydrophobicity and molecular size[J].Environmental Science & Technology,2007,41(9):3309-3315.
[17]Yan M,Wang D,You S,etal.Enhanced coagulation in a typical North-China water treatment plant[J].Water Research,2006,40(19):3621-3627.
[18]Malcolm R L,MacCarthy P.Quantitative evaluation of XAD-8 and XAD-4 resins used in tandem for removing organic solutes from water[J].Environment International,1992,18(6):597-607.
[19]Chiang P C,Chang E E,Liang C H.NOM characteristics and treatabilities of ozonation processes[J].Chemosphere,2002,46(6):929-936.
[20]Shin H S,Monsallier J M,Choppin G R.Spectroscopic and chemical characterizations of molecular size fractionated humic acid[J].Talanta,1999,50(3):641-647.
[21]Siddiqui M,Amy G,Ryan J,etal.Membranes for the control of natural organic matter from surface waters[J].Water Research,2000,34(13):3355-3370.
[22]宋芸,李咏梅.含氮消毒副产物及其前体物的控制研究进展[J].环境工程,2012(s2):440-445.
[23]徐倩,徐斌,夏圣骥,等.饮用水中消毒副产物-卤化酮的生成特性与控制研究进展[J].四川环境,2011,30(1):101-105.
[24]Kim H C,Yu M J.Characterization of natural organic matter in conventional water treatment processes for selection of treatment processes focused on DBPs control[J].Water Research,2005,39(19):4779-4789.
[25]Zhang H,Qu J,Liu H,etal.Characterization of isolated fractions of dissolved organic matter from sewage treatment plant and the related disinfection by-products formation potential[J].Journal of Hazardous Materials,2009,164(2-3):1433-1438.
[26]朱明秋,高乃云.饮用水中典型含氮消毒副产物卤乙腈的生成和控制研究进展[J].水处理技术,2013,39(8):1-4.
[27]Yang X,Shen Q,Guo W,etal.Precursors and nitrogen origins of trichloronitromethane and dichloroacetonitrile during chlorination/chloramination[J].Chemosphere,2012,88(1):25-32.
[28]江瑞,黄璜,吴乾元,等.再生水氯消毒过程中三氯丙酮生成特性及其前体物组成[J].给水排水,2013(s1):171-176.

