促红细胞生成素对大鼠肝缺血再灌注损伤的保护作用及基质金属蛋白酶-9和半胱天冬酶-1表达的影响❋
肖 莉 钟坪杉 吴鹏俐 阳德飞 陈晓琴 杨 拯 李 健△
(成都医学院, 1 人体解剖学教研室, 2 2013级临床医学专业, 3 2014级麻醉学专业, 4 2014级临床医学专业, 5 2015级医学影像学专业, 6实验技术教研室, 成都 610500)
肝缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI)是肝及创伤外科手术常见的病理生理过程[1]。HIRI是一个级联炎症反应过程,涉及肝微血管紊乱、Kupffer细胞激活、炎性细胞因子等多种因素的参与[2-3]。基质金属蛋白酶-9(matrix metalloproteinase 9,MMP-9)属于基质金属蛋白酶家族成员之一,活化的MMP-9通过降解血管内皮细胞及肝窦细胞外基质(extracellular matrix,ECM),促进中性粒细胞跨越内皮细胞间隙及肝窦ECM向缺血再灌注组织迁移、浸润[4-5]。半胱天冬酶-1(cysteinyl aspartate specific proteinase-1,caspase-1)是与机体炎症反应密切相关的一种蛋白酶,可促进白细胞介素(interleukin,IL)-1β、IL-18和IL-33等细胞因子成熟,而IL-1β、IL-18 在肝缺血再灌注损伤中起重要作用。促红细胞生成素(erythropoietin,EPO)是肾在低氧环境下产生的一种能够刺激红细胞生成和分化的细胞因子。有研究表明EPO对HIRI具有保护作用[6-7],但是否通过抑制MMP-9、caspase-1介导的过度炎症反应仍未明确。本研究通过建立肝缺血再灌注模型,观察EPO对HIRI相关因子MMP-9、caspase-1表达及病理形态学的影响,探讨EPO对HIRI的保护作用及机制。
1 材料和方法
1.1 动物分组
选用四川省人民医院实验动物研究所提供的健康SPF级的SD大鼠50只,雄性,体质量(200±20)g。采用随机数字表法,将实验大鼠分为5组,每组10只,缺血再灌注损伤组(I/R组),促红细胞生成素低剂量组(L组)、中剂量组(M组)、高剂量组(H组)、假手术组。
1.2 药品及试剂
EPO(商品名:重组人促红素注射液,沈阳三生制药有限责任公司);MMP-9抗体、caspase-1抗体、SABC免疫组织化学试剂盒购于武汉博士得生物工程有限公司;谷丙转氨酶测量试剂盒、谷草转氨酶测量试剂盒丙二醛测量试剂盒购于南京建成生物工程研究所;GAPDH抗体,山羊抗兔IgG购于上海碧云天生物技术有限公司。
1.3 模型的制备和取材
大鼠在实验前禁食12 h,自由饮水。缺血前1 h, 低、中、高剂量组分别给予腹腔注射EPO 1 000、3 000、5 000 U/kg,I/R组及假手术组腹腔注射生理盐水。10%水合氯醛麻醉,上腹正中切开进腹,用小号无损伤动脉夹阻断肝左中叶的门静脉和肝动脉。1 h后,松开动脉夹恢复阻断区血供,建立肝部分I/R模型。假手术组于仅暴露肝门,但不阻断血管。再灌注3 h后即可开始取材,右心房抽取静脉血4~5 ml,用于血清肝酶学检测。取肝左中叶部分组织用4%的多聚甲醛固定用于H-E染色及免疫组织化学检测MMP-9、caspase-1的表达,另一部分采用免疫印迹法检测MMP-9、caspase-1的表达。
1.4 H-E染色
将制作好的石蜡切片放入65℃烘箱烤片2 h,常规脱蜡至水。苏木精5 min,蒸馏水洗涤,1%盐酸乙醇分化数秒,蒸馏水洗涤,伊红1~2 min,蒸馏水洗涤,脱水、透明、封片。
1.5 免疫组织化学测定MMP-9、caspase-1的含量
石蜡切片常规脱蜡至水,3% H2O2灭活内源性过氧化物酶活性5~10 min,PBS冲洗5 min×3次,热修复抗原。将切片浸于0.01 mol/L枸橼酸缓冲液,微波炉加热8 min,反复2次。冷却后PBS洗涤3次。滴加5%的BSA封闭液,37℃孵育30 min,甩干。滴加一抗MMP-9和caspase-1稀释100倍,4℃过夜,PBS冲洗5 min×3次。滴加生物素标记兔抗大鼠IgG,37℃孵育30 min;PBS冲洗5 min×3次。滴加SABC,37℃孵育30 min,PBS冲洗5 min×3次,DAB显色。苏木精复染75 s,脱水、透明、中性树胶封片。
1.6 免疫印迹测定MMP-9、caspase-1的表达
将肝组织剪碎,将组织和裂解液按照1∶9的比例混合,置于冰上,用玻璃棒将组织打成匀浆,以12 000 r/min,4℃,离心取上清。蛋白定量分装成200 μl/管,按照4∶1的比例加入Loading Buffer,混匀。进行SDS-聚丙烯酰胺凝胶电泳,转膜,TBST洗5 min×4次。5%脱脂奶粉封闭1 h,TBST洗5 min×4次,分别加入一抗MMP-9和caspase-1稀释1 000倍,GAPDH稀释5 000倍。4℃摇床孵育过夜,加入二抗(山羊抗兔IgG,稀释1 000倍),TBST洗5 min×4次,压片曝光。
1.7 酶学指标检测
比色法检测丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)。严格按照说明书要求操作,试剂混匀后在室温放置15 min,510 nm波长,酶标仪测各孔OD值。绝对OD值=测定管OD值-对照管OD值,根据相应的标准曲线,得出对应ALT及AST活力单位。
1.8 统计学处理
2 结果
2.1 组织病理学观察
肝组织切片显示:I/R组肝小叶结构明显破坏,肝细胞索排列紊乱;肝细胞出现变性、肿胀,气球样变,大量片状坏死;坏死区域可见大量炎性细胞浸润。不同浓度EPO预处理组中肝细胞索排列较好,肝小叶破坏不明显,肝细胞水肿、坏死及炎性细胞浸润情况较I/R组均有明显的改善。EPO预处理各组比较,中剂量组肝小叶大致正常,肝细胞轻度肿胀,其病变程度与低、高剂量组相比明显减轻(图1)。
2.2 MMP-9免疫组织化学显色及阳性细胞计数
肝组织MMP-9免疫组织化学显色阳性反应物主要表达于中央静脉内皮细胞及血管旁的肝细胞胞质,以中央静脉内皮细胞表达量最高,呈棕黄色。其中I/R组表达范围与EPO预处理各组相比较范围更广且表达量也明显增加,大血管内皮细胞及周边的肝细胞胞质内均有MMP-9的表达。EPO预处理各组比较,中剂量组MMP-9的表达范围及表达量较其余2组明显减少(图2 A-E)。在相同的光源,随机选择5个互不相交叉的视野在400倍光镜下计数阳性细胞数,结果显示I/R组大鼠的MMP-9阳性细胞数最高(5.4±0.67),EPO预处理组MMP-9阳性细胞数明显低于 I/R 组(P<0.05)。EPO预处理各组比较,中剂量组的MMP-9阳性细胞数表达率最低(3.2±0.85),显著低于低剂量组(4.1±0.78)和高剂量组(4.4±0.52)(P<0.05)。假手术组的MMP-9基本无阳性细胞表达(1.8±0.87)。
2.3 Caspase-1免疫组化及阳性细胞计数
免疫组织化学结果显示:caspase-1主要表达于血管内皮细胞及血管旁的肝细胞胞质,呈棕黄色(图2 F~J)。将染好的切片在10×40倍视野下随机选择5个互不相交叉的视野,统计caspase-1阳性细胞数目,结果显示I/R组的caspase-1阳性细胞(5.2±0.79)表达最高;EPO预处理组caspase-1的阳性表达明显低于I/R组(P<0.05),其中中剂量组(3.2±0.63)较低剂量组(4.0±0.70)及高剂量组(4.3±0.82)MMP-9的阳性细胞表达最低(P<0.05)。假手术组基本无caspase-1阳性表达(1.7±1.01)。
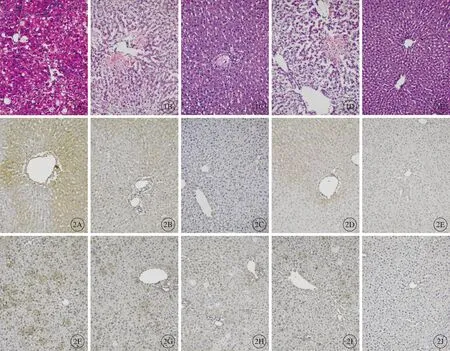
图1 各组大鼠肝组织病理形态学改变(H-E染色,×200)。A:I/R组;B:低剂量组;C:中剂量组;D:高剂量组;E:假手术组.
2.4 免疫印迹检测MMP-9、caspase-1的表达
对应的条带位置出现目的蛋白,MMP-9在92 kD处,caspase-1在45 kD处,GAPDH在36 kD处。MMP-9检测结果显示,与假手术组(0.34±0.04)相比,I/R组MMP-9的表达显著升高(1.64±0.11,P<0.05)。EPO预处理后,MMP-9的表达均得到了不同程度的抑制,高、中、低剂量组分别为0.94±0.19、0.80±0.05、1.05±0.07。中剂量组对MMP-9的表达抑制作用最明显, 与I/R组相比具有统计学意义(P<0.05),与其他不同浓度组对MMP-9的表达差异也具有统计学意义(P<0.05)。
Caspase-1检测结果显示:经缺血再灌注损伤后,与假手术组(0.75±0.04)相比,I/R组caspase-1的表达显著升高(1.19±0.11,P<0.05)。EPO预处理组,capase-1的表达得到了不同程度的抑制,高、中、低剂量组分别为0.92±0.11、0.86±0.08、1.08±0.08。其中中剂量组对caspase-1表达的抑制作用最明显,与I/R组相比具有统计学意义(P<0.05),与其他不同浓度组对capase-1的表达差异也具有统计学意义(P<0.05)。
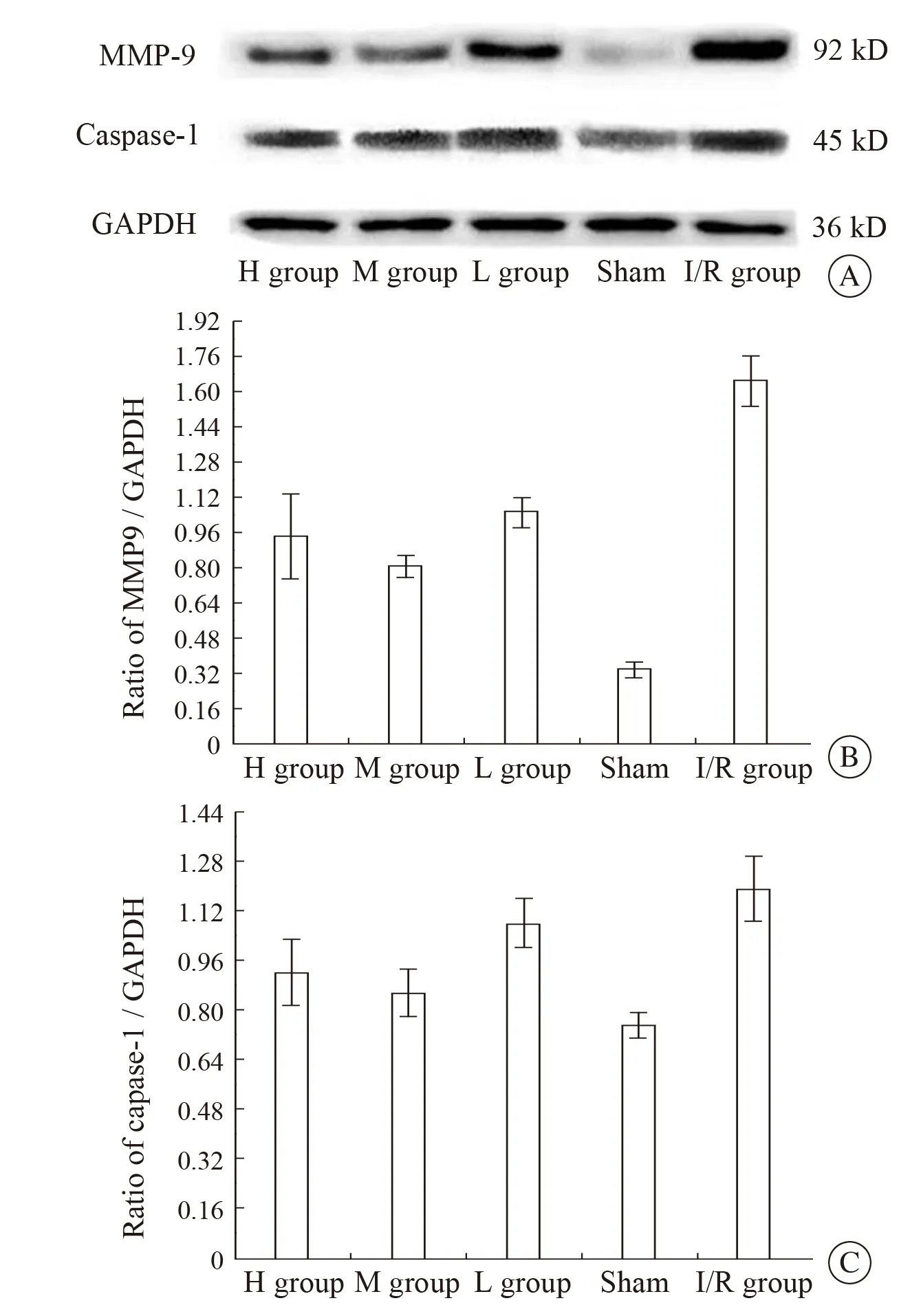
图3 各组肝组织MMP-9、caspase-1的蛋白表达Fig 3 Expression of MMP-9 and caspase-1 protein in liver tissues
2.5 转氨酶水平测定
血清转氨酶升高,在一定程度上反映了肝细胞损害和坏死的程度。表1显示,I/R组血清ALT、AST水平最高; 中剂量组血清ALT、AST水平显著低于低剂量组和高剂量组;假手术组血清ALT、AST水平最低。各组间比较差异均具有统计学意义。
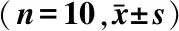
表1 血清转氨酶水平的测定Tab 1 The level of serum transaminase l in each group of rats
3 讨论
3.1 MMP-9、caspase-1在HIRI中的作用
HIRI是肝胆外科手术中常见的病理生理现象,其发生机制十分复杂,可能涉及钙超载、氧化应激、炎症反应及凋亡等。但具体的发生机制、所涉及的信号通路及相关细胞因子尚不清楚[8]。大量研究表明,炎症反应是HIRI的主要机制之一,抑制缺血再灌注损伤过程中的炎症反应可以减轻HIRI[9-10],但目前针对具体的炎症细胞因子的实验研究较少。MMP-9主要由中性粒细胞、巨噬细胞和单核细胞产生,在炎症反应中能加速白细胞的募集、细胞因子释放以及促进基质降解改建。Andrej 等[11]的研究表明MMP-9介导中性粒细胞的浸润在肝缺血再灌损伤过程中起着非常关键的作用。缺血再灌注后中性粒细胞激活内皮细胞,上调并活化MMP-9,而MMP-9作为一种蛋白水解酶能够降解内皮细胞基底膜及肝细胞外基质,介导黏附于内皮细胞的中性粒细胞跨越内皮细胞间隙及细胞外基质向肝缺血再灌注区域浸润;同时激活的中性粒细胞在迁移的过程中还不断产生促炎因子TNF-α、IL-1β及ROS诱导Kupffer细胞及肝星状细胞等细胞上调MMP-9的表达与活化,加强肝细胞外基质的降解;而被激活的MMP-9又能反作用于中性粒细胞,上调TNF-α、IL-1β等促炎因子的表达,并诱导中性粒细胞的趋化迁移。在MMP-9及中性粒细胞的相互作用下,最终介导大量中性粒细胞迁移至缺血再灌注区域,并通过多种机制参与肝损伤[12-13]。Caspase-1又称为IL-1β转化酶,可见于包括巨噬细胞等在内的多种细胞,亦可表达于Kupffer细胞。活化的caspase-1的功能是可剪切pro-IL-1β、pro-IL-18,从而产生成熟的IL-1β、IL-18,从而诱导级联炎症反应介导缺血再灌注损伤[14-15]。
3.2 EPO预处理对HIRI的保护作用
EPO是一种刺激骨髓造血的糖蛋白类激素。其基本作用是促进红细胞生成,并可以通过在多种非红系组织细胞中,如中枢神经系统、内皮细胞、子宫等器官表达的促红细胞生成素受体(erythropoietin receptor,EPOR)结合,形成EPO-EPOR信号转导系统,参与多种非造血生物活动[16-18]。越来越多的研究表明EPO具有细胞和组织器官的保护作用,对心、脑、肾等发生缺血再灌注时具有保护作用。国内外研究证实,EPO具有极强的抗炎活性和促红细胞生长作用和抗凋亡作用。陈茂松等[19]的研究表明,EPO能抑制炎症因子的表达,进而减轻肝缺血再灌注过程中的炎症反应。Li等[20]研究表明EPO对caspase-1有抑制作用,能够减轻炎症反应。但是否能通过抑制MMP-9及caspase-1的表达从而减轻HIRI尚未见报道。
本实验的研究结果显示,I/R组肝小叶结构明显破坏,肝细胞索排列紊乱,肝细胞出现变性、肿胀,气球样变,大量片状坏死,坏死区域可见大量炎性细胞浸润。此外,血清肝酶学指标显示I/R组的血清ALT、AST水平均较假手术组显著升高,提示缺血再灌注对肝组织造成了明显的损伤。EPO预处理组显示肝细胞索排列较好,肝小叶破坏不明显,肝细胞水肿,坏死及炎性细胞浸润情况较I/R组均有明显的改善且血清ALT、AST水平同I/R组比较均显著降低,说明在肝缺血再灌注前使用EPO能够显著改善肝的病理损伤及降低血清中相关的酶学指标,对肝功能的保护有益,可以减轻肝缺血再灌注损伤。病理学及肝酶学结果均证实中剂量组即3 000 U/kg的EPO预处理组对大鼠肝缺血再灌注损伤的保护作用优于高和低剂量组。因此EPO预处理对HIRI具有保护作用,3 000 U/kg的EPO治疗可能是治疗大鼠HIRI的最适剂量。此外,MMP-9及caspase-1在各组的表达情况也不相同,I/R组MMP-9的表达增强,大血管内皮细胞及周边的肝细胞均有MMP-9的表达,EPO可显著抑制MMP-9的表达。EPO预处理能明显缓解大鼠肝缺血再灌注损伤可能与其抑制MMP-9的表达,从而减少中性粒细胞的迁移浸润及降低其炎症介质的释放以及抑制了细胞外基质的降解有关。缺血再灌注后,caspase-1的表达也显著升高,免疫组织化学显色及免疫印迹检测结果显示EPO预处理可以显著抑制caspase-1的表达。说明EPO可能是通过抑制caspase-1的表达和活化,抑制其下游炎性因子IL-1β和IL-18的成熟及分泌,从而减轻肝缺血再灌注损伤。EPO的这种保护机制可能与EPO能减弱caspase-1活化,导致IL-1β分泌减少,进而下调MMP-9的表达,抑制炎症反应有关。EPO预处理各组MMP-9及caspase-1的表达量在中剂量组即3 000 U/kg组中表达量最少。
综上所述,EPO处理对大鼠HIRI具有保护作用,其作用机制可能是通过抑制炎症反应及caspase-1和MMP-9的表达来减轻肝缺血再灌注损伤,并且3 000 U/kg的EPO预处理组的抗炎作用效果最佳。