胃癌组织DNA拓扑异构酶2α等8种分子的蛋白表达与脉管侵犯的关系
戴东方,陈德玉,李小琴,顾汉刚,王德强
(江苏大学附属医院肿瘤科,江苏镇江212001)
我国每年新发胃癌病例近70万,位居世界首位[1-2]。根治性手术仍然是胃癌最主要的治愈性手段,但患者术后仍然普遍面临复发转移风险。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)的胃癌临床实践指南将低分化、脉管侵犯、神经侵犯、年龄<50岁及非D2根治术均列为术后复发转移的高危因素[3]。其中,脉管侵犯与胃癌临床病理特征及预后的密切关系已有报道[4-6],但伴脉管侵犯胃癌的分子特征尚不清楚。因此,本研究回顾性比较了有和无脉管侵犯胃癌患者之间常见的8种免疫组化分子标志物表达的差异。
1 对象与方法
1.1 病例
收集2012年1月1日至2014年1月1日在江苏大学附属医院手术治疗的胃癌患者242例,其中男179例,女63例;年龄35~75岁,中位年龄60岁。纳入标准:①年龄18~75岁;② 病理学确诊为胃腺癌;③术前未行放化疗及生物靶向治疗。
1.2 主要试剂
微管蛋白 β3、胸苷酸合酶(thymidylate synthase,TS)、非转移蛋白 23(nonmetastatic protein 23,NM23)、P糖蛋白、增殖标记Ki-67、DNA拓扑异构酶2α(topoisomerase 2-alpha,TOP2A)、切除修复交叉互补酶1(excision repair cross-complementation group 1,ERCC1)及人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的抗体,免疫组织化学染色试剂盒及二氨基联苯胺显色试剂盒等均购自珠海泉晖公司。
1.3 HE染色判断脉管侵犯
石蜡包埋的组织样本切片厚度为5μm,行HE染色。脉管侵犯的定义为肿瘤细胞对血管或淋巴管管壁的侵犯或者在内皮细胞衬里的空间中发现瘤栓[7]。血管或淋巴管管腔的识别[5]:① 内皮细胞衬里;②有平滑肌或弹性组织支撑;③有淋巴液或红细胞填充。
1.4 免疫组织化学染色检测
免疫组织化学染色采用SP法,操作步骤严格按试剂盒的说明书进行,空白对照为PBS液,阳性对照为各受检分子的阳性切片。结果判读标准:HER2的结果判读标准依据美国病理学会和临床肿瘤学会的专项指南[8]。其他分子标志物的结果判读采用半定量法,即染色阳性细胞数比例与染色强度等级之积[9],具体为① 计算每张切片中阳性细胞的百分比:选择10个高倍视野(×400),每个视野计数100个细胞中的阳性细胞数,阳性细胞少于10%为0级,10%~25%为1级,26%~50%为2级,51%~75%以上为3级,76%~100%为4级;②判读染色强度:无着色为0级,浅棕色为1级,棕色为2级,深棕色为3级;③ 根据二者之乘积,≥6为高表达,<6为低表达。
1.5 统计学分析
应用SPSS 17.0统计软件进行分析。计数资料采用双侧χ2检验。双侧P<0.05为差异有统计学意义。
2 结果
2.1 有和无脉管侵犯胃癌患者临床病理特征的比较
242例患者中有脉管侵犯81例(33.5%)。在有脉管侵犯胃癌患者中,女性、肿瘤最大径≥5cm、伴神经侵犯及TNM分期Ⅲ-Ⅳ期的比例均显著高于无脉管侵犯胃癌患者(P<0.05或 P<0.001)。见表1。
2.2 有和无脉管侵犯胃癌患者8种分子的蛋白表达
如图1所示,棕褐(黑)色颗粒为染色阳性,染色阳性的 Ki-67、TOP2A及ERCC1主要见于细胞核,而微管蛋白 β3、TS、NM23、P糖蛋白及 HER2在胞核胞质均可见阳性染色。有脉管侵犯胃癌患者的TOP2A高表达率为89.3%,显著高于无脉管侵犯者的72.9%(P<0.05),而微管蛋白 β3、TS、NM23、P糖蛋白、Ki-67、ERCC1及HER2的高表达率在两组间无显著差异(P>0.05)。见表2。

表1 有和无脉管侵犯胃癌患者临床病理特征的比较

图1 各分子标志物的阳性染色(免疫组织化学染色×200)

表2 有和无脉管侵犯胃癌患者8种分子的表达差异

续表
2.3 有和无脉管侵犯胃癌患者TOP2A表达的亚组比较
有和无脉管侵犯胃癌患者之间TOP2A高表达率的差异主要出现于女性(100%vs 72.2%,P=0.045)和组织学分级Ⅲ级的亚组中(89.3%vs 67.6%,P=0.040)。在其他临床病理特征的亚组中均未发现TOP2A高表达率在两组间存在显著差异。见表3。
3 讨论
脉管侵犯是肿瘤细胞对血管或淋巴管的侵犯,在各种肿瘤中均较为常见。在胃癌中,伴脉管侵犯者的比例报道不一。在一项中国南方人群的研究中,采用HE染色法从1 148例胃癌患者中发现伴脉管侵犯者比例为 35.2%(404例)[5]。此前,del Casar等[10]采用HE染色与CD34免疫组化检测相结合的方法在胃癌中辨别脉管侵犯,报道的比例为31.9%。以上均与本组人群33.5%的脉管侵犯比例相近。但是,Kim等[11]完全采用D2-40及CD34免疫组化法在胃癌中检测得到的结果为44.3%,表明不同方法对结果有影响。HE染色法是目前应用最广泛且简单易行的判定脉管侵犯的方法,并且该方法所得结果与肿瘤患者临床结局之间具有显著相关性,表明了该方法的可靠性[12-14]。
脉管侵犯是肿瘤局部扩散的重要途径。研究显示,脉管侵犯与肿瘤侵袭能力及淋巴结转移显著相关,同时提示脉管侵犯与肿瘤预后的相关性[12-15]。在胃癌中,早期的数项小样本研究均发现脉管侵犯者的生存期较无脉管侵犯者短[10-11,16]。而 Li等[5]包括了1 148例胃癌患者的研究进一步发现脉管侵犯是预后的独立预测因子。最近,Zhao等[4]在1 019例中国西部胃癌患者中的结果也证实了脉管侵犯独立的预后预测作用,且与淋巴结计数和肿瘤大小联合可以进一步提高预后预测的准确性。
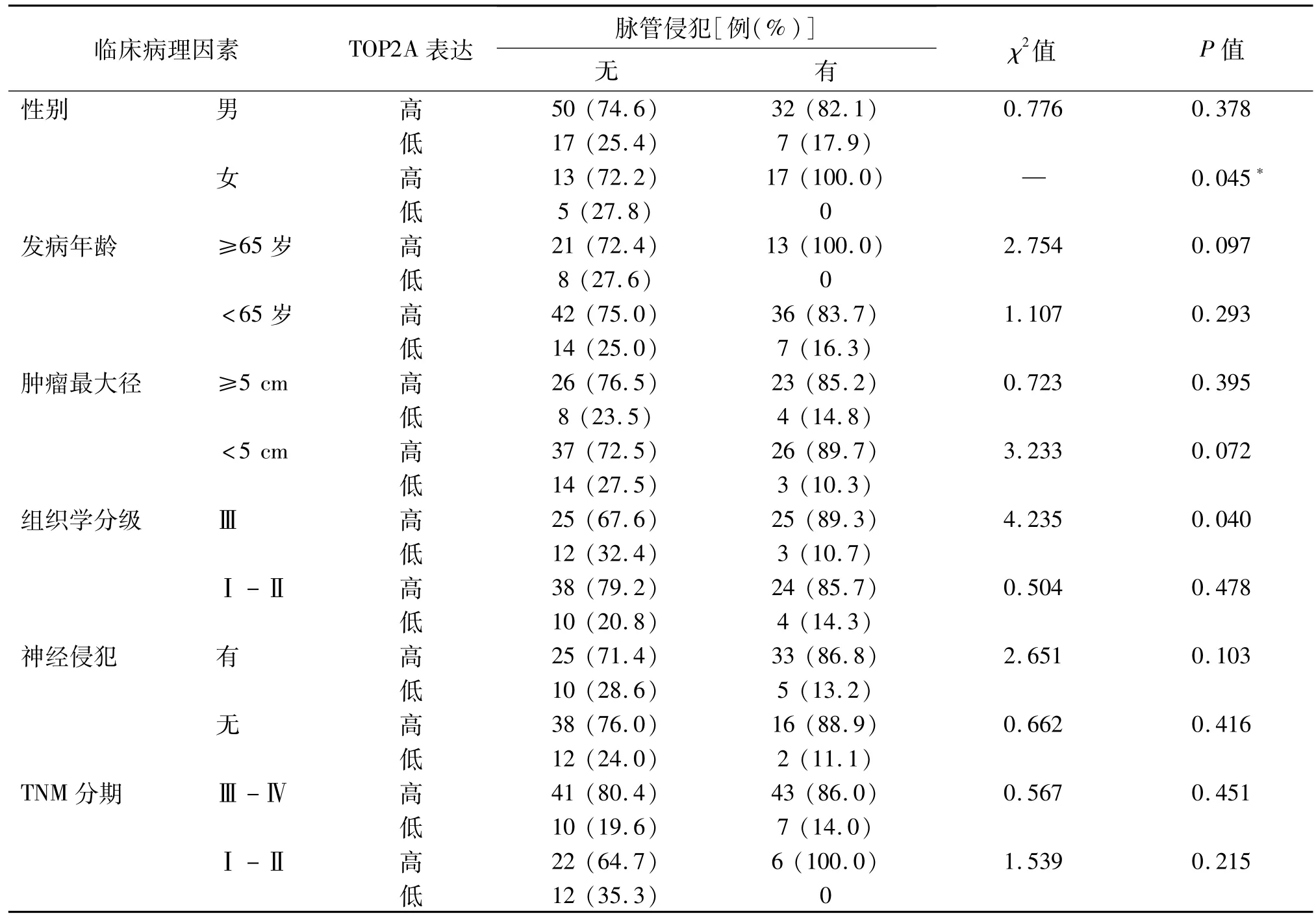
表3 有和无脉管侵犯胃癌患者TOP2A表达的亚组比较
脉管侵犯与胃癌临床病理特征关系的报道较为一致,例如与肿瘤大小、分化、神经侵犯及分期等显著相关[4-6,10-11,16],本研究的结果亦与之相符。本研究结果表明,有脉管侵犯者的TOP2A高表达率显著高于无脉管侵犯者,且这种差异在女性及组织学分级Ⅲ级的患者中尤为明显,提示伴脉管侵犯者尤其是某些亚组有独特的分子特征。
TOP2A基因编码DNA拓扑异构酶2α,通过对DNA拓扑结构的控制,在DNA转录和复制过程中起着关键作用[17]。最近,一项转录组测序研究和一项基因芯片研究均提示TOP2A是胃癌发生过程中的关键性基因[18-19]。更为重要的是,Terashima等[20]发现TOP2A基因mRNA表达水平与胃癌复发有关,是胃癌复发的独立风险因素。因此,本研究关于脉管侵犯者TOP2A高表达率较高的结果,可能提示了脉管侵犯及其预后差的一种分子机制。
TOP2A是蒽环类化疗药的直接靶标。最近的一项纳入了2 012例早期乳腺癌患者的3期临床试验发现,TOP2A与蒽环类药物辅助化疗的疗效有关[21]。蒽环类也是胃癌的有效治疗药物,3期临床试验证实了含表柔比星化疗方案在胃癌术后辅助化疗 中 的 疗 效[22-24]。此 外,Terashima等[20]发 现TOP2A高表达胃癌患者在替吉奥辅助化疗后的无复发生存时间显著劣于低表达者,提示TOP2A与氟尿嘧啶类药物疗效有关。因此,本研究关于脉管侵犯者TOP2A高表达率较高的结果,可能也提示此类患者对上述药物的抗性,值得进一步研究。
综上所述,伴脉管侵犯胃癌患者的TOP2A蛋白表达升高,特别是在女性和组织学分级Ⅲ级患者中更为明显。结合 TOP2A现有的临床意义,提示TOP2A在伴脉管侵犯胃癌患者中的临床相关性,可以作为未来的研究方向之一。
[参考文献]
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer JClin,2016,66(2):115-132.
[2]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer JClin,2015,65(2):87-108.
[3]Ajani JA,D′Amico TA,Almhanna K,et al.Gastric Cancer,Version 3.2016, NCCN Clinical Practice Guidelines in Oncology[J].JNatl Compr Canc Netw,2016,14(10):1286-1312.
[4]Zhao LY,Chen XL,Wang YG,et al.A new predictive model combined of tumor size,lymph nodes count and lymphovascular invasion for survival prognosis in patients with lymph node-negative gastric cancer[J].Oncotarget,2016,7(44):72300-72310.
[5]Li P,He HQ,Zhu CM,et al.The prognostic significance of lymphovascular invasion in patientswith resectable gastric cancer:a large retrospective study from Southern China[J].BMC Cancer,2015,15:370.
[6]Lee JH,Kim MG,Jung MS,et al.Prognostic significance of lymphovascular invasion in node-negative gastric cancer[J].World JSurg,2015,39(3):732-739.
[7]Mete O,Asa SL.Pathological definition and clinical significance of vascular invasion in thyroid carcinomas of follicular epithelial derivation[J].Mod Pathol,2011,24(12):1545-1552.
[8]Bartley AN,Washington MK,Colasacco C,et al.HER2 testing and clinical decision making in gastroesophageal adenocarcinoma:Guideline from the College of American Pathologists,American Society for Clinical Pathology,and the American Society of Clinical Oncology[J].JClin Oncol,2017,35(4):446-464.
[9]Li JC,Yang XR,Sun HX,et al.Up-regulation of Kr ppel-like factor 8 promotes tumor invasion and indicates poor prognosis for hepatocellular carcinoma[J].Gastroenterology,2010,139(6):2146-2157.
[10]del Casar JM,Corte MD,Alvarez A,et al.Lymphatic and/or blood vessel invasion in gastric cancer:relationship with clinicopathological parameters,biological factors and prognostic significance[J].JCancer Res Clin Oncol,2008,134(2):153-161.
[11]Kim JH,Park SS,Park SH,et al.Clinical significance of immunohistochemically-identified lymphatic and/or blood vessel tumor invasion in gastric cancer[J].JSurg Res,2010,162(2):177-183.
[12]Zhang S,Zhang D,Gong M,etal.High lymphatic vessel density and presence of lymphovascular invasion both predict poor prognosis in breast cancer[J].BMC Cancer,2017,17(1):335.
[13]Yuan H,Dong Q,Zheng B,et al.Lymphovascular invasion is a high risk factor for stageⅠ/Ⅱ colorectal cancer:a systematic review and meta-analysis[J].Oncotarget,2017,8(28):46565-46579.
[14]Kinoshita T,Ohtsuka T,Yotsukura M,etal.Prognostic impact of preoperative tumormarker levels and lymphovascular invasion in pathological stageⅠadenocarcinoma and squamous cell carcinoma of the lung[J].JThorac Oncol,2015,10(4):619-628.
[15]Gresta LT,Rodrigues-Junior IA,de Castro LP,et al.Assessment of vascular invasion in gastric cancer:a comparative study[J].World JGastroenterol,2013,19(24):3761-3769.
[16]Du CY,Chen JG,Zhou Y,et al.Impact of lymphatic and/or blood vessel invasion in stageⅡ gastric cancer[J].World J Gastroenterol,2012,18(27):3610-3616.
[17]Baxter J,Sen N,Martínez VL,etal.Positive supercoiling ofmitotic DNA drives decatenation by topoisomeraseⅡin eukaryotes[J].Science,2011,331(6022):1328-1332.
[18]Li X,DongW,Qu X,etal.Molecular dysexpression in gastric cancer revealed by integrated analysis of transcriptome data[J].Oncol Lett,2017,13(5):3177-3185.
[19]Wang Y.Transcriptional regulatory network analysis for gastric cancer based on mRNA microarray[J].Pathol Oncol Res,2017,23(4):785-791.
[20]Terashima M,Ichikawa W,Ochiai A,et al.TOP2A,GGH,and PECAM1 are associated with hematogenous,lymph node,and peritoneal recurrence in stageⅡ/Ⅲgastric cancer patients enrolled in the ACTS-GC study[J].Oncotarget,2017,8(34):57574-57582.
[21]Ejlertsen B,Tuxen MK,Jakobsen EH,et al.Adjuvant cyclophosphamide and docetaxelwith or without epirubicin for early TOP2A-normal breast cancer:DBCG 07-READ,an open-label,phaseⅢ,randomized trial[J].JClin Oncol,2017,35(23):2639-2646.
[22]Cunningham D,Allum WH,Stenning SP,etal.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J].N Engl JMed,2006,355(1):11-20.
[23]Sumpter K,Harper-Wynne C,Cunningham D,et al.Report of two protocol planned interim analyses in a randomised multicentre phaseⅢstudy comparing capecitabine with fluorouracil and oxaliplatin with cisplatin in patients with advanced oesophagogastric cancer receiving ECF[J].Br JCancer,2005,92(11):1976-1983.
[24]Cunningham D,Starling N,Rao S,et al.Capecitabine and oxaliplatin for advanced esophagogastric cancer[J].N Engl JMed,2008,358(1):36-46.

