液相色谱-串联质谱快速检测干血点样品中尿酸
李广林,韩吉春,王小臣,赵雅君,骆亦奇
(杭州量康医学检验所,浙江 杭州 310052)
尿酸(uric acid, UA)是人体内嘌呤代谢的最终产物,主要经肾脏排出。血液UA水平是临床诊断痛风、肾结石和肾衰竭的重要指标之一。研究表明[1-10],高尿酸血症是脑白质病变、糖尿病、高血压、冠心病及代谢综合征的风险因子之一,低尿酸血症则可能增加心血管、骨损伤及胆囊疾病的风险。因此,准确、快速地检测血液UA水平可以为某些疾病的预防、诊断及治疗提供依据。
目前, UA的检测方法包括磷钨酸还原法、酶法[11]、高效液相色谱法(HPLC)[12-13]、气相色谱-质谱联用法(GC/MS)[14]、高效液相色谱-串联质谱法(HPLC-MS/MS)[15-16]以及同位素稀释质谱法(IDMS)[17]等。临床上最常用的是酶法,该方法操作简便,但仅适用于血清样品;HPLC法受生物基质影响较大,特异性较差;GC/MS法在一定程度上解决了特异性问题,但样品需衍生化,前处理较繁琐。LC-MS/MS法具有样品适用性广、特异性好、灵敏度高、检测速度快等特点,但样品的前处理过程复杂、耗时较长,且人工操作引入的误差容易导致检测方法不稳定。而样品前处理的自动化能够较好地解决人为因素造成的误差,同时可以进行批量处理,提高工作效率。
干血点(dried blood spot, DBS)是将抗凝全血收集在特定的滤纸卡片上,晾干后通过一定处理即可进行检测的一种血液样品形态。早在20世纪60年代,DBS样品就已被用于苯丙酮尿症的新生儿筛查中[18]。随着色谱、质谱技术及健康产业的蓬勃发展,DBS样品在各类疾病的诊断及筛查中的应用价值日益凸显。与传统的临床液体血样相比,DBS样品具有如下优势:首先,样品采集简单方便、成本低,用户个人可自助完成采样,无需具有采血资质的专业人士操作,无需离心机等专业设备;其次,采样不受地域限制,自助采完血样并晾干,然后通过邮寄等方式送至实验室即可进行检测,适合慢性疾病的长期监控;再次,DBS样品稳定性好,可承受较长时间的运输和储存,且运输过程不需要特殊的冷链设施;最后,DBS样品交叉感染风险小,基本无生物危害性,在运输、保存和检测操作中,安全性强。
本研究拟建立一种基于LC-MS/MS与高通量自动移液平台联用检测DBS中UA的方法,使样品前处理过程实现自动化,并采用LC-MS/MS多反应监测(MRM)模式检测分析。希望为人体内血液UA水平的大规模筛查提供方法参考。
1 实验部分
1.1 仪器和材料
Agilent 1290-6495液相色谱-串联质谱仪,Bravo自动液体操作平台,在线过滤器:美国Agilent公司产品;色谱柱:Luna CN 柱(100 mm×2 mm×3 μm),美国Phenomenex公司产品;Hitachi7180全自动生化仪:日本Hitachi公司产品;分析天平:德国Sartorius公司产品;3 mm打孔器及打孔垫:美国Ted Pella公司产品;超纯水仪:德国EDM Millipore公司产品;96孔透明深孔板,8道深孔板:美国Axygen公司产品;96孔PCR进样板:美国Bio-Rad公司产品;Whatman 903 CF12滤纸:美国GE公司产品。
UA标准品:纯度≥98%,上海安谱公司产品;UA稳定同位素内标UA-1,3-15N2:纯度≥98%,美国CIL公司产品;Tris-HCl晶体:美国Sigma-Aldrich公司产品;乙腈,甲酸:均为质谱级,上海安谱公司产品;盐酸:质谱级,西班牙Scharlau公司产品;抗凝全血样品及血清样品:由江山人民医院提供。
1.2 标准溶液的配制
用40.0 mmol/L NaOH溶液溶解,配制25.0 mmol/L UA母液。用0.2 mol/L Tris缓冲溶液溶解,配制5.0 mmol/L UA-1,3-15N2内标母液,并分装。将内标母液用0.2 mol/L Tris溶液稀释为100.0 μmol/L内标工作液,并分装。将配制的母液与内标标准溶液于-80 ℃保存,使用时配制所需浓度的标准溶液。
1.3 实验条件
1.3.1色谱条件色谱柱: CN柱(100 mm×2 mm×3 μm),前端配有在线过滤器;流动相:0.1%甲酸的水溶液-0.1%甲酸的乙腈溶液(95∶5,V/V),等度洗脱,流速0.3 mL/min;进样体积1.0 μL;柱温25 ℃。
1.3.2质谱条件采用电喷雾离子源正离子检测模式;多反应监测模式;干燥气温度150 ℃,流速16 L/min;鞘气温度350 ℃,流速11 L/min;毛细管电压3 000 V;喷嘴电压500 V;离子漏斗高、低射频电压分别为150和100 V。UA和UA-1,3-15N2准分子离子峰分别为m/z169.0和m/z171.1,通过进一步二级质谱碎裂,最终确定UA的特征离子对分别为m/z169.0>141.1和m/z169.0>126.1,其中m/z169.0>141.1为定量离子对,相应UA内标UA-1,3-15N2的定量离子对为m/z171.1>143.0。UA和UA-1,3-15N2主要质谱采集参数列于表1。
1.4 DBS样品的制备及前处理
将20.0 μL抗凝全血滴于滤纸片上,室温下晾2 h后,于-80 ℃保存,待测。用打孔器取2片制备的直径3.0 mm的DBS样品于96孔深孔板中,加入40.0 μL 100 μmol/L UA-1, 3-15N2内标工作液,室温下振荡5 min,然后加入400 μL沉淀剂(含体积分数为0.1%甲酸、0.05%三氟乙酸的乙腈溶液),振荡5 min,以3 500 r/min离心10 min,吸取70.0 μL上清液至96孔PCR进样板中,进行LC-MS/MS分析。整个前处理过程中,除打孔外,其余步骤均在Bravo自动液体操作平台上进行。

表1 UA和UA-1,3-15N2质谱采集参数Table 1 Mass parameters of UA and UA-1,3-15N2
2 结果与讨论
2.1 方法学验证

图1 UA定量检测标准曲线Fig.1 Standard curve of UA quantitation
2.1.1标准曲线为准确检测DBS样品中UA含量,采用基质添加方法制备标准曲线。取9等份抗凝全血,分别添加不同浓度的UA标准品至终浓度为0.0、7.8、15.6、31.3、62.5、125、250、500和1 000 μmol/L。然后按照1.4节方法制备DBS,并进行前处理,各浓度重复测定6次。以扣除本底抗凝全血中UA和UA-1,3-15N2峰面积比值为y,以添加的UA标准品浓度为x(μmol/L),绘制标准曲线,权重取1/x,示于图1。结果表明,UA检测结果与UA添加浓度在7.8~1 000 μmol/L范围内的线性关系良好,线性方程为y=0.001 36x+0.000 25,线性相关系数R2=0.999。人血清中UA浓度参考范围为90~420 μmol/L[19],该线性范围可以满足DBS中UA的检测。
2.1.2检出限与定量限抗凝全血中含有内源性UA,因此本研究以UA稳定同位素内标UA-1,3-15N2评估检出限(LOD)和定量限(LOQ)。在抗凝全血中添加不同浓度的UA-1,3-15N2,混匀后按照1.4节方法制备DBS样品。前处理过程在1.4节基础上有所改变,将原来添加的40.0 μL内标工作液改为40.0 μL 0.2 mol/L Tris溶液。前处理完成后,按1.3节方法分析。结果表明,DBS样品中UA检出限为3.1 μmol/L(S/N=3),定量限为12.5 μmol/L(S/N=10)。在浓度分别为3.1、12.5、200 μmol/L时,UA-1,3-15N2的MRM图示于图2。
2.1.3精密度与回收率取抗凝全血,添加不同浓度的UA标准品至终浓度分别为低(50.0 μmol/L)、中(300 μmol/L)、高(700 μmol/L),按照1.4节方法进行DBS样品制备和前处理,按照1.3节方法分析样品。日内精密度实验中,各添加水平样品重复测定10次。日间精密度实验中,各添加水平样品连续测定5天,每天重复测定5次。将日间精密度实验中每日的实验结果取平均值,得到当天的UA检测值,再将5天的UA检测值取平均值,得到平均UA检测值和平均回收率。其中,添加样品UA检测值为实测UA数值减去本底UA数值。各添加水平样品在5天实验中的平均回收率为95%~101%。结果表明,该方法的精密度与准确度良好,具体结果列于表2。
2.1.4样品稳定性DBS样品在不同温度下随时间变化的稳定性:取3份抗凝全血,添加不同浓度的标准品至终浓度分别为低(50.0 μmol/L)、中(300 μmol/L)、高(700 μmol/L),按照1.4节方法制备DBS,将3种浓度样品均分3份并分3组,每组包含低、中、高样品。将3组样品分别储存于37 ℃、室温、-20 ℃环境下,于放置的第1、2、3、4、5、7、10、15、20、30天进行样品前处理并检测。结果表明,在-20 ℃环境下,30天内的RSD为5.0%~9.0%,样品稳定性良好;在37 ℃和室温环境下,样品在7天内的检测结果总体RSD小于15%。

图2 浓度为3.1(a),12.5(b)和200 μmol/L(c)时,UA-1,3-15N2的MRM图Fig.2 MRM chromatograms of UA-1,3-15N2 with 3.1 (a), 12.5 (b) and 200 μmol/L (c)
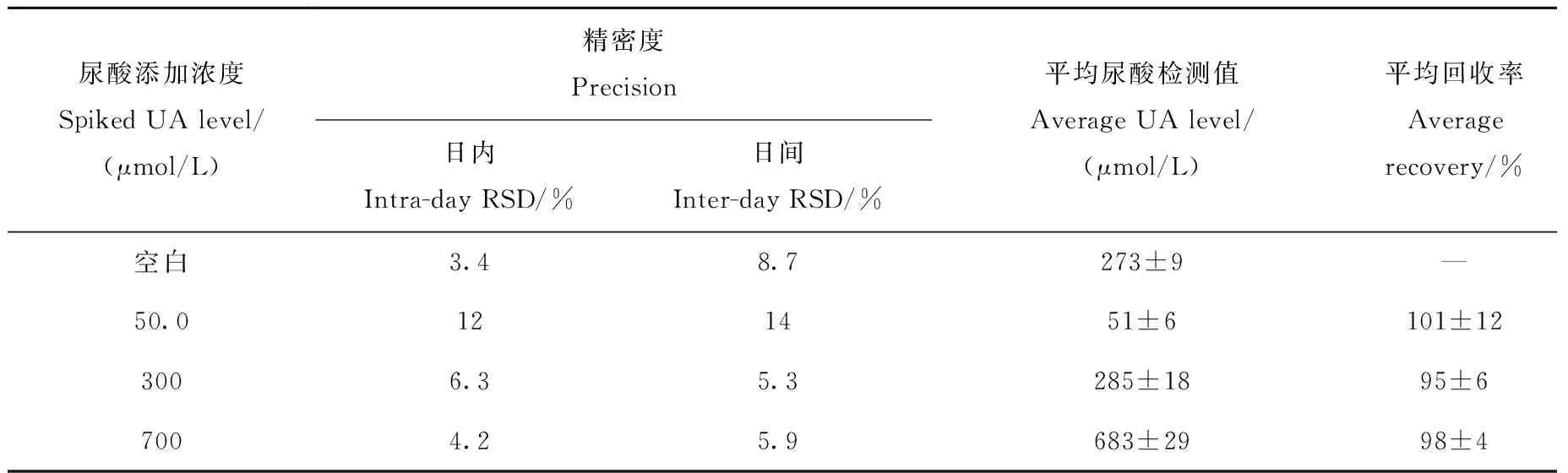
尿酸添加浓度SpikedUAlevel/(μmol/L)精密度Precision日内Intra-dayRSD/%日间Inter-dayRSD/%平均尿酸检测值AverageUAlevel/(μmol/L)平均回收率Averagerecovery/%空白3.48.7273±9—50.0121451±6101±123006.35.3285±1895±67004.25.9683±2998±4
DBS样品反复冻融稳定性:按上述方法对样品分组,并进行冻融稳定性实验。样品于-20 ℃放置22 h,室温下放置2 h为一个冻融循环,连续进行5次。结果表明,低、中、高浓度样品反复冻融的RSD分别为5.9%、9.2%、2.0%,冻融稳定性良好。
2.2 实际样品检测
采集204个抗凝全血样品,按1.4节方法制备DBS,LC-MS/MS检测分析UA。同时,采用传统临床诊断中常用的Hitachi 7180全自动生化仪检测204个临床血清样品中的UA。以传统生化法检测血清中UA浓度为x(μmol/L),以本实验方法检测UA浓度为y(μmol/L),绘制曲线,示于图3。得到拟合曲线方程y=0.909x+3.345,线性相关系数R2=0.946,说明本实验方法与传统生化法检测UA的相关性良好。
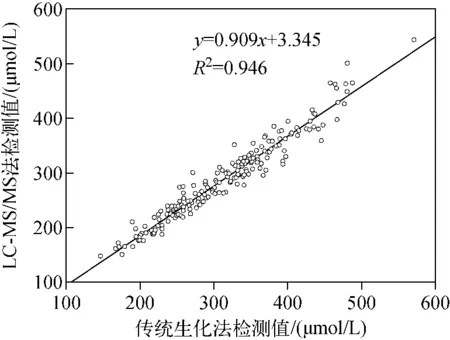
图3 LC-MS/MS检测DBS中UA与传统生化法检测血浆中UA浓度的比较(n=204) Fig.3 Comparison of UA concentrations in the DBS samples determined by LC-MS/MS and in the plasma samples by conventional biochemistry assay (n=204)
3 结论
本研究建立了一种基于液相色谱-串联质谱检测DBS样品中UA的方法,该方法简单方便、生物稳定性好、方便储存和运输。前处理过程使用Bravo自动化液体处理平台及高通量的96孔板,降低了人为误差,提高了方法精密度。使用同位素内标避免了基质效应。该方法与传统生化方法的相关性好,适用于有限采血条件下UA的检测及相关疾病的大规模筛查。
参考文献:
[1]KUTZING M K, FIRESTEIN B L. Altered uric acid levels and disease states[J]. Journal of Pharmacology and Experimental Therapeutics, 2008, 324(1): 1-7.
[2]de OLIVEIRA E P, BURINI R C. High plasma uric acid concentration: causes and consequences[J]. Diabetology and Metabolic Syndrome, 2012, 4(1): 1-7.
[3]SUN M J, LI B H, LONG C Y, et al. Association between serum uric acid levels and cerebral white matter lesions in Chinese individuals[J]. International Journal of Neuroscience, 2016, 126(12): 1 103-1 111.
[4]DEHGHAN A, van HOEK M, SIJBRANDS E J, et al. High serum uric acid as a novel risk factor for type 2 diabetes[J]. Diabetes Care, 2008, 31(2): 361-362.
[5]BORGHI C, VERARDI F M, PAREO I, et al. Hyperuricemia and cardiovascular disease risk[J]. Expert Review of Cardiovascular Therapy, 2014, 12(10): 1 219-1 225.
[6]DING X H, WANG X N, CAO R H, et al. GW27-e0533 A higher baseline plasma uric acid level is an independent predictor of arterial stiffness: a community-based prospective study[J]. Journal of the American College of Cardiology, 2016, 68(16): C79-C79.
[7]DENOBLE A E, HUFFMAN K M, STABLER T V, et al. Uric acid is a danger signal of increasing risk for osteoarthritis through inflammasome activation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(5): 2 088-2 093.
[8]MENDE C. Management of chronic kidney disease: the relationship between serum uric acid and development of nephropathy[J]. Advances in Therapy, 2015, 32(12): 1 177-1 191.
[9]WANG J Y, CHEN Y L, HSU C H, et al. Predictive value of serum uric acid levels for the diagnosis of metabolic syndrome in adolescents[J]. Journal of Pediatrics, 2012, 161(4): 753-756.
[10] 安映红,翁余海,陈友谊,等. 浙江舟山群岛居民高尿酸血症人群分布及发病率分析[J]. 现代检验医学杂志,2016,31(3):102-104.
AN Yinghong, WENG Yuhai, CHEN Youyi, et al. Population distribution and incidence analyses of hyperuricemia in zhoushan island[J]. Journal of Modern Laboratory Medicine, 2016, 31(3): 102-104(in Chinese).
[11] 张江涛,张传宝,曾洁,等. 血清尿酸13种常规检验系统正确度的评价[J]. 中华检验医学杂志,2015,38(9):609-612.
ZHANG Jiangtao, ZHANG Chuanbao, ZENG Jie, et al. Trueness evaluation of 13 routine measurements for serum uric acid[J]. Chinese Journal of Laboratory Medicine, 2015, 38(9): 609-612(in Chinese).
[12] LI X L, SHI Q, JIN W L, et al. Uric acid quantification in fingernail of gout patients and healthy volunteers using HPLC-UV[J]. Biomedical Chromatography, 2016, 30(8): 1 338-1 342.
[13] 马玉花,黄冬群,张瑞,等. 高效液相色谱法同时测定尿液中4种非蛋白氮的含量[J]. 色谱,2013,31(11):1 102-1 105.
MA Yuhua, HUANG Dongqun, ZHANG Rui, et al. Simultaneous determination of four common nonprotein nitrogen substances in urine by high performance liquid chromatography[J]. Chinese Journal of Chromatography, 2013, 31(11): 1 102-1 105(in Chinese).
[14] SUN Y P, CHEN J, QI H Y. Graphitic carbon nitrides modified hollow fiber solid phase microextraction for extraction and determination of uric acid in urine and serum coupled with gas chromatography-mass spectrometry[J]. Journal of Chromatography B, 2015, (1 004): 53-59.
[15] LUO X, CAI N F, CHENG Z N. Determination of uric acid in plasma by LC-MS/MS and its application to an efficacy evaluation of recombinant urate oxidase[J]. Analytical Sciences, 2013, 29(7): 709-713.
[16] KWON K, KIM J Y, SUH S, et al. Simultaneous determination of creatinine and uric acid in urine by liquid chromatography-tandem mass spectrometry with polarity switching electrospray ionization[J]. Forensic Science International, 2012, 221(11 213): 57-64.
[17] DAI X H, FANG X, ZHANG C M, et al. Determination of serum uric acid using high-performance liquid chromatography (HPLC)/isotope dilution mass spectrometry (ID-MS) as a candidate reference method[J]. Journal of Chromatography B, 2007, 857(2): 287-295.
[18] 韩吉春,李广林,王小臣,等. 液相色谱-串联质谱法检测干血点中的同型半胱氨酸[J]. 色谱,2016,34(6):567-571.
HAN Jichun, LI Guanglin, WANG Xiaochen, et al. Determination of homocysteine in dried blood spots using liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2016, 34(6): 567-571(in Chinese).
[19] 从玉隆,王金良,李晓军,等. 实用检验医学[M]. 北京:人民卫生出版社,2013:576-577.
[20] NAGENDRA S, YOGARAJE G C V, KARSHINATH R T. A comparative study of plasma uric acid, erythrocyte uric acid and urine uric acid levels in type 2 diabetic subjects[J]. Merit Research Journal of Medicine and Medical Sciences, 2015, 3(12): 571-574.

