厄贝沙坦通过诱导自噬减轻db/db小鼠肝脏脂肪变*
钟 娟,青 姚,吴曙粤,龚望球,龙海波△
(1南宁市第一人民医院,广西 南宁 530022; 2南方医科大学珠江医院,广东 广州 510280)
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是以肝细胞脂肪变性和脂质贮积为特征的病理综合征。随着人们生活水平的提高,NAFLD在我国有显著增多的趋势,且日趋年轻化,近年来已超过病毒性肝炎而成为肝脏疾病的第1位[1]。其发病率高,后果严重,严重威胁我国人民健康。但目前NAFLD的机制仍未阐明,且无特异性药物治疗。近来大量的研究报道,厄贝沙坦(irbesartan)是独特的血管紧张素受体阻滞剂(angiotensin receptor blockers,ARB)类降压药,除降压之外,尚具有抗炎、抗氧化及调节糖、脂代谢的作用,能显著改善代谢综合征患者胰岛素的抵抗,降低肝脏脂质沉积,减缓肝脂肪变性的发生[2-4],但其具体作用机理尚需进一步明确。
自噬是一种进化保守的溶酶体依赖的自身降解途径,是细胞在遇到应激反应等刺激时,将细胞质内多余的蛋白质或损伤的细胞器等物质包绕至自噬体中并与溶酶体结合将其降解的过程,其在真核细胞中广泛存在。在人体饥饿状态下,自噬可以通过增加肝脏的脂肪消耗,降低肝脏脂肪堆积,改善肝脂代谢紊乱,维持能量平衡。而当肝脏中的脂质聚积时,自噬作用受到抑制,其降解脂质的作用降低,导致脂质沉积进一步加重,诱发NAFLD。因此,自噬在NAFLD的发生、发展中具有重要病理生理意义。研究发现有几个信号通路与自噬的调节相关[5-6],其中以Ⅰ类磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路最为典型。PI3K能够磷酸化Akt,而磷酸化Akt可推动mTOR活化,进而导致自噬抑制;相反,Akt的磷酸化受到抑制则能够诱发高水平的自噬,这表明PI3K/Akt/mTOR能反向调节自噬。
因此,本研究采用先天瘦素受体基因缺失的db/db小鼠NAFLD动物模型,探讨厄贝沙坦是否通过自噬调节改善db/db小鼠肝脏脂肪变以及PI3K/Akt/mTOR信号通路在其调节自噬中的影响,进而为NAFLD的防治提供进一步的理论和实验依据。
材 料 和 方 法
1 实验动物、药物、试剂和仪器
雄性10周龄C57BL/KSJ-Lepdb (db/db)小鼠24只,同龄雄性C57BKSdb/m小鼠12只,均购自南京大学模式动物研究所,动物合格证号为 SCXK(苏)2015-0001,饲养于南方医科大学SPF级实验动物中心层流架内。所有小鼠置于空气流通、温度22~25 ℃、湿度40%~70%的环境中,给予12 h光照,普通饲料喂养、自由饮水,遵循《南方医科大学实验动物伦理和使用指南》进行实验操作。
厄贝沙坦片购自杭州赛诺菲制药有限公司(国药准字J20080061,生产批号 5A173);抗PI3K、p-PI3K、Akt、p-Akt、mTOR、p-mTOR、自噬相关基因(autophage-related gene,Atg)-7、beclin-1、微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)B、β-actin抗体购自CST,均为兔源单克隆抗体;BCA法蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;PVDF膜购自上海优宁维生物科技有限公司;ECL发光液购自Santa Cruz。Mini-Protein电泳槽购自Bio-Rad;Kodak Image Station 2000MM成像系统购自KODAK;光学显微镜为Nikon产品。
2 方法
2.1动物分组与治疗将db/db小鼠随机分为模型(model)组和厄贝沙坦(irbesartan)组,另选取db/m小鼠作正常对照(normal)组,每组12只。厄贝沙坦组予厄贝沙坦50 mg·kg-1·d-1经口灌服治疗(相当于等倍人临床用量),模型组和正常对照组同时灌服等量生理盐水,每天1次,共给药16周。
2.2体重、肝指数、血脂及肝功能检测在小鼠最后1次给药后,禁食12 h,称重,以0.3%戊巴比妥钠按35 mg/kg的剂量腹腔注射麻醉,腹主动脉取血,采用HITACHI 7180全自动生化仪检测血甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、丙氨酸转氨酶(alanine aminotransferase,ALT)和天冬氨酸转氨酶(aspartate aminotransferase,AST)水平。取血后立即剥离肝组织,生理盐水冲洗,滤纸吸干表面水分后称重,计算肝指数:肝指数(%)=肝湿重/体重×100%。
2.3肝脏病理检查各组肝组织标本部分采用10%中性甲醛固定、梯度乙醇脱水、二甲苯透明、浸蜡、包埋、切片,HE染色,光镜下观察。每组随机选取6张切片采用NAS半定量评分系统对肝脏脂肪变程度进行评定[7-8]:肝脏脂肪变<5%为0分;5%≤脂肪变<33%为1分;33%≤脂肪变<66%为2分;脂肪变≥66%为3分。部分肝组织冰冻切片后进行油红“O”染色,采用Image-Pro Plus 6.0(IPP)软件对每张切片脂质沉积进行定量分析。
2.4Western blot检测PI3K/Akt/mTOR信号通路及自噬相关蛋白的表达按照组织蛋白提取试剂盒说明书提取总蛋白。BCA蛋白定量法测各组蛋白浓度,以保证各组样品上样量相同。待测蛋白与5×上样缓冲液按4∶1混合,98 ℃变性5 min。每组取蛋白80 μg,行SDS-PAGE分离,然后电转移至PVDF膜上,再用含5%脱脂奶粉的1×TBST缓冲液室温摇床上封闭1 h,TBST缓冲液漂洗后,各 I 抗(1∶1 000)4 ℃孵育过夜,TBST洗涤PVDF膜3次,每次10 min,封闭液稀释相应的 II 抗(1∶2 000)后,常温下孵育1 h。TBST洗涤PVDF膜3次,每次10 min,ECL发光试剂盒在曝光仪中进行曝光,以β-actin为内参照,实验重复3次。采用Image Station 2000R图像工作站采集图像,进行灰度分析。
2.5免疫组化检测自噬标志蛋白LC3B的表达各组肝组织标本采用10%中性甲醛固定,倒去固定液后流水冲洗5 min,各级乙醇梯度脱水,二甲苯透明,浸蜡、包埋,切片机切成2 μm石蜡切片。新配3%H2O2孵育15 min,以消除内源性过氧化物酶活性,蒸馏水冲洗,封闭血清孵育 20 min。取LC3B 的I抗(1∶200)湿盒中4 ℃孵育过夜,PBS洗3次,每次5 min;滴加 II 抗,室温孵育30 min,PBS洗3次,每次5 min;配制DBA显色剂,孵育约10 min,自来水洗5 min,苏木素复染10 min,自来水洗5 min。中性树胶封片,光镜下观察、采集图像。
2.6电镜下观察自噬小体取肝组织块大小约1 mm×1 mm×1 mm,置于pH 7.4的2.5%冷戊二醛溶液中预固定,4 ℃保存。1周后用pH 7.4的1%四氧化锇作后固定,固定24 h;之后梯度丙酮脱水,环氧树脂包埋组织块,修块、切片,将超薄切片裱在小铜网上,用醋酸铀和枸橼酸铅双染色,HITACHI H-7650透射电镜观察组织细胞中的自噬小体,照相并记录随机视野内个数。
3 统计学处理
采用SPSS 13.0统计软件进行统计学处理,数据用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 厄贝沙坦对db/db小鼠体重、肝指数、血脂及肝功能的影响
结果显示,与正常对照组db/m小鼠相比,模型组db/db小鼠体重、肝指数、血TG和TC以及ALT和AST均显著升高(P<0.05);经厄贝沙坦治疗16周后,db/db小鼠体重、肝指数、TG、TC、ALT和AST均有不同程度的降低,与模型组比较有统计学差异(P<0.05),见表1。

表1 厄贝沙坦对db/db小鼠体重、肝指数、血脂及肝功能的影响Table 1.The effect of irbesartan on body weight,liver index,serum lipid and liver function in db/db mice (Mean±SD.n=12)
*P<0.05vsnormal group;#P<0.05vsmodel group.
2 厄贝沙坦对db/db小鼠肝脏病理的影响
肝组织经HE染色后光镜下可见正常对照组肝细胞排列整齐;模型组出现明显的肝细胞脂肪变性,以大量肝细胞空泡性变、细胞脱落为特征,模型组NAS定量评分明显高于正常对照组;经厄贝沙坦干预后,db/db小鼠肝脏脂肪变性明显减轻,NAS定量评分显著降低,与模型组相比差异有统计学意义(P<0.05)。肝组织油红“O”染色可见模型组肝细胞内大量脂质沉积,经IPP软件定量分析显示模型组油红“O”染色平均阳性面积达70%以上,明显高于正常对照组(P<0.05);经厄贝沙坦治疗后,可见db/db小鼠肝脏脂质沉积明显减少,油红“O”染色平均阳性面积低于40%,见图1。
3 Western blot检测厄贝沙坦对自噬相关蛋白Atg-7、beclin-1和LC3B表达的影响
与正常对照组相比,模型组db/db小鼠肝组织自噬相关蛋白Atg-7、beclin-1和LC3B-Ⅱ表达明显减少(P<0.05);经厄贝沙坦干预后,db/db小鼠肝组织自噬相关蛋白Atg-7、beclin-1和LC3B-Ⅱ表达明显增加,与模型组相比有显著差异(P<0.05),见图2。表明厄贝沙坦可以通过增加自噬相关蛋白的表达,从而促进肝脏自噬的发生,但其调节自噬上述蛋白表达的具体机制仍有待明确。因此,我们进一步采用Western blot检测PI3K/Akt/mTOR信号通路相关蛋白的表达。
4 Western blot检测厄贝沙坦对PI3K/Akt/mTOR信号通路的影响
模型组db/db小鼠肝组织p-PI3K、p-Akt和p-mTOR的表达较正常对照组小鼠显著增加(P<0.05);然而经厄贝沙坦干预后,db/db小鼠肝组织p-PI3K、p-Akt和p-mTOR表达显著减少,与模型组相比差异有统计学意义(P<0.05)。进一步研究表明厄贝沙坦上调自噬相关蛋白Atg-7、beclin-1和LC3B-Ⅱ的表达可能与其抑制PI3K/Akt/mTOR信号通路有关,见图3。

Figure 1.The pathological changes of hepatic tissues in the mice of each group.Mean±SD.n=6.*P<0.05vsnormal group;#P<0.05vsmodel group.
图1各组小鼠肝组织病理变化

Figure 2.Irbesartan induced autophagy in the livers ofdb/dbmice.Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsmodel group.
图2厄贝沙坦对自噬相关蛋白表达的影响
5 免疫组化检测厄贝沙坦对自噬标志蛋白LC3B表达的影响
LC3B为自噬标志蛋白,模型组db/db小鼠肝组织LC3B较正常对照组db/m小鼠显著减少(P<0.05);然而经厄贝沙坦干预后,db/db小鼠肝组织LC3B表达显著增多,与模型组相比差异有统计学意义(P<0.05),见图4。
6 厄贝沙坦对db/db小鼠肝脏自噬小体表达的影响
自噬小体是由单层膜或典型双层膜将一小部分细胞质包围而成,通过透射电镜观察,发现模型组db/db小鼠肝细胞自噬小体数量较正常对照组相比有减少趋势,但经厄贝沙坦治疗后,db/db小鼠肝细胞自噬小体数量较模型组显著增多,差异有统计学意义(P<0.05),见图5。

Figure 3.Irbesartan inhibited the PI3K/Akt/mTOR signaling pathway in the livers ofdb/dbmice.Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsmodel group.
图3厄贝沙坦对PI3K/Akt/mTOR信号通路的影响
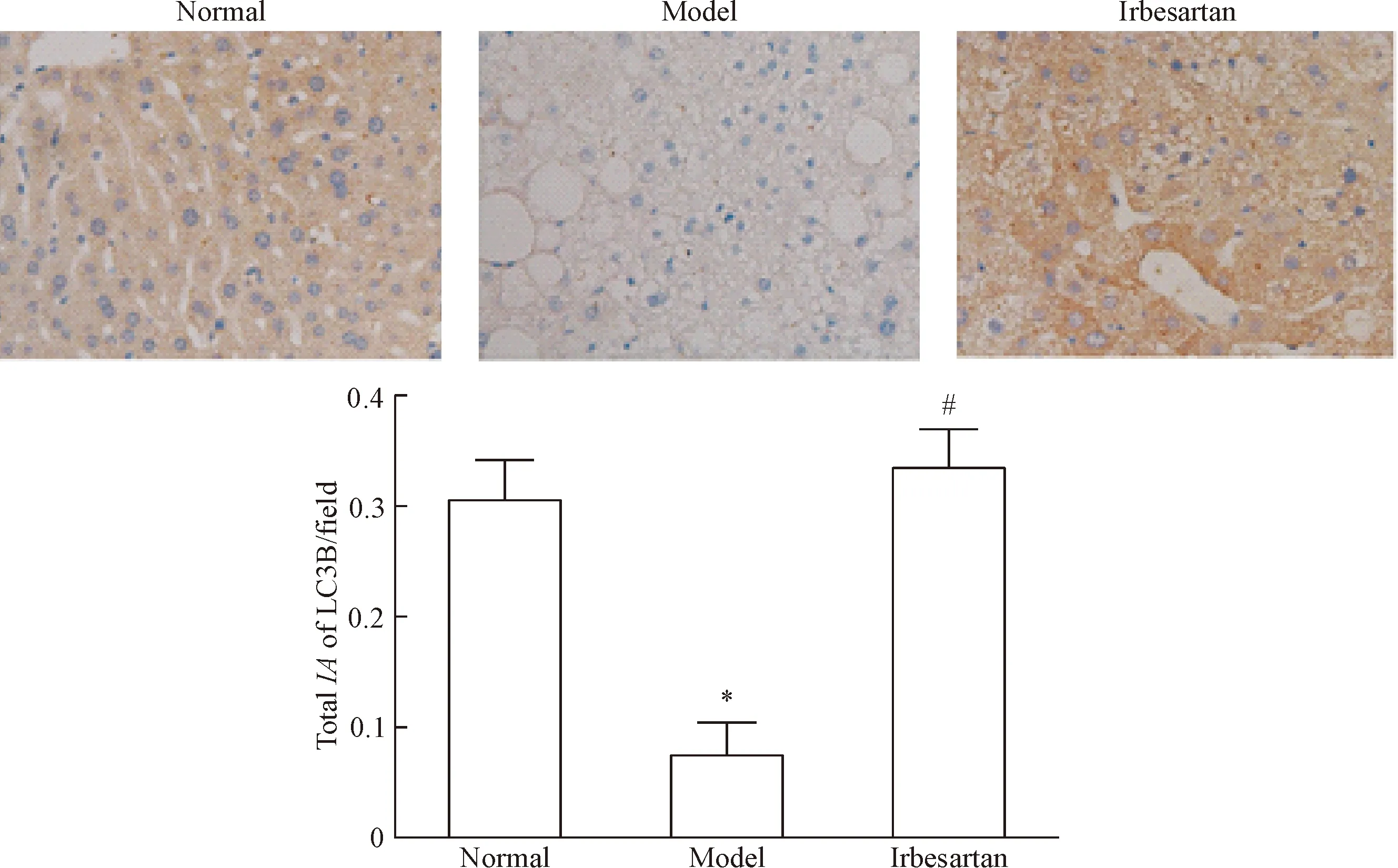
Figure 4.Immunohistochemical staining of LC3B in the livers of the mice (×200).Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsmodel group.
图4免疫组化检测厄贝沙坦对LC3B表达的影响
讨 论
NAFLD是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝脏损伤。 NAFLD 经历 “二次打击”后可激发非酒精性脂肪性肝炎,由此将进展为肝硬化、终末期肝病甚至肝癌,而危及生命[4]。Wong等[9]进行的一项基于人群的前瞻性队列研究显示,3~5年内13.5%的成人(年龄≥18岁,无NAFLD)会发生NAFLD。目前NAFLD发病率正在以惊人的速度增长,且将近50%的NAFLD患者有高血压[10]。但是,NAFLD至今尚无特效治疗方法,以往期求于降脂/调脂药物并不能达到治疗的目的,且长期服用又易引起肝肾功能损害。因此,探索机制明确、治疗有效的药物是当今研究的重点。
NAFLD的发病机制尚不清楚,一般认为脂质摄取过多和胰岛素抵抗是引起脂类在肝脏细胞中聚集的首要环节,线粒体的氧化应激以及各种细胞因子的综合作用最终导致了肝细胞的脂肪变性。新近有研究报道肝细胞自噬的活性影响肝脏脂质沉积,肝脏自噬增加能有效地减轻肝脏脂肪性变和肝损伤。Kim等[11]在肥胖患者和脂肪肝大鼠中发现,肝脏内自噬抑制物的过度激活可减少肝脏细胞的自噬总量。同时,肝脏细胞自噬的减少会促进内质网应激,进而导致胰岛素抵抗。体外研究也显示,通过基因敲除、沉默或者药物抑制自噬后,高脂诱导的肝细胞由于自噬的抑制而使细胞脂肪酸β氧化减少,致使脂滴中蓄积过量的甘油三酯和胆固醇,并且自噬与脂代谢之间的相互作用会陷入恶性循环,细胞自噬减少导致肝脏脂质存积,而脂质大量存积将进一步抑制细胞自噬功能,从而进一步加重脂质滞留[12]。因此,促进细胞自噬可调节脂代谢,减少肝脏脂质沉积,改善胰岛素抵抗,减轻肝脏脂肪性变和肝损伤。
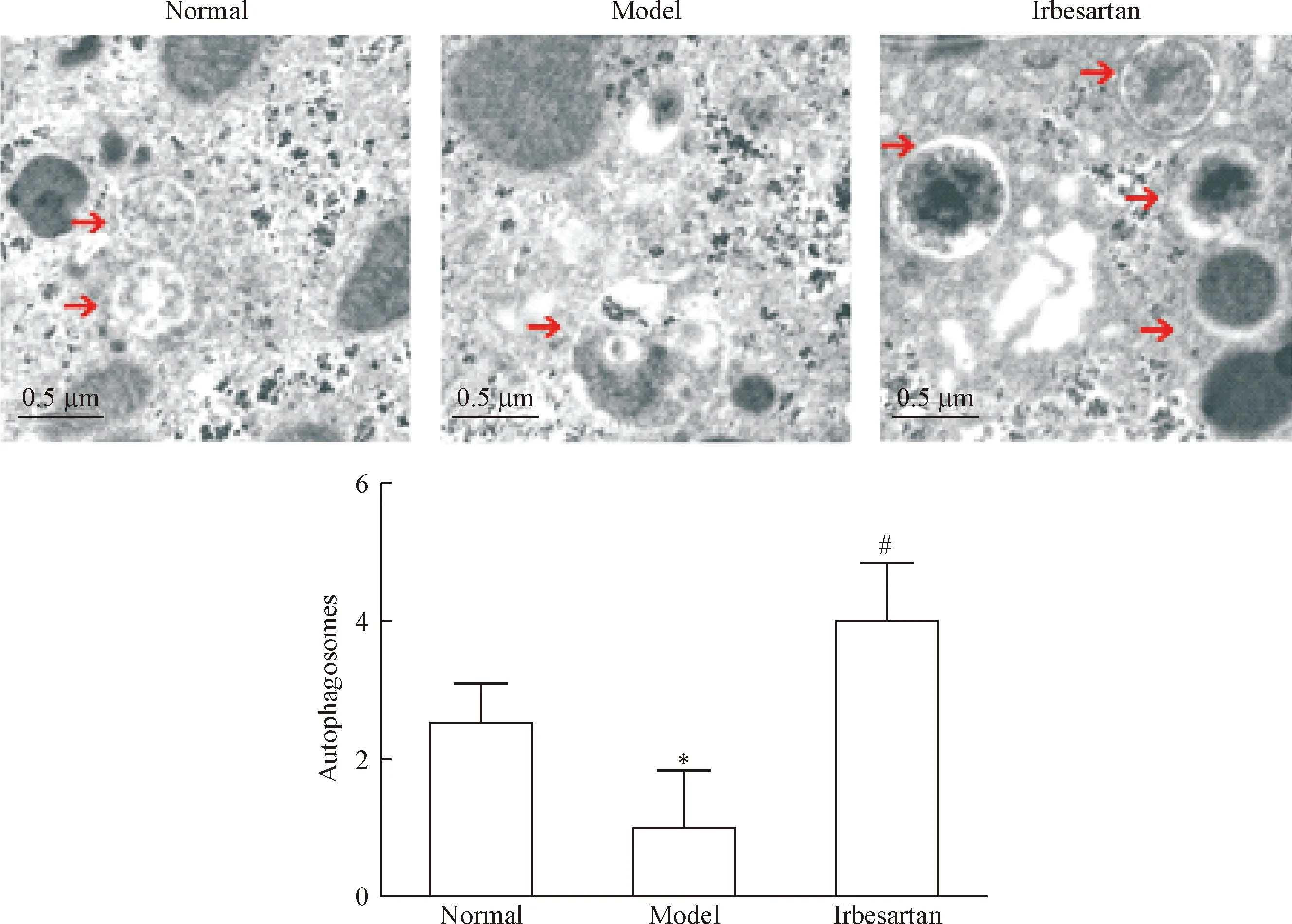
Figure 5.The effect of irbesartan on the formation of autophagosomes in the hepatocytes observed by transmission electron microscopy.The arrows indicated autophagosomes.Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsmodel group.
图5厄贝沙坦对db/db小鼠肝脏形成自噬小体的影响
厄贝沙坦为血管紧张素Ⅱ受体阻滞剂,在临床上主要用于降血压治疗,并可能通过肾素-血管紧张素-醛固酮统起到肝脏保护的作用。近来大量的临床及实验研究已证实,厄贝沙坦尚具有抗炎、抗氧化、保护血管内皮以及调节糖、脂代谢的作用,可用于NAFLD、代谢综合征、动脉粥样硬化等疾病的治疗[2-4,8]。研究报道厄贝沙坦通过改善胰岛素抵抗、降低固醇调节元件结合蛋白-1c (sterol regulatory element binding protein -1c,SREBP1c)表达、调节炎症反应,从而减轻高脂饲养的SD大鼠、FLS-ob/ob小鼠以及肥胖Zucker大鼠肝脏的脂肪性变[3-4,13]。此外,也有研究证实厄贝沙坦可以通过激活过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPAR-γ),上调PPAR-γ/HGF和AMPK/Akt/mTOR信号通路,减轻高脂饲养ApoEKO小鼠和2型糖尿病db/db小鼠肝脏脂肪性变[2,8]。另外,Rong等[14]研究发现,厄贝沙坦亦可激活PPAR-α,促进肥胖Koletsky大鼠肝脏PPAR-α及其相关基因的表达,从而减少游离脂肪酸的含量、改善高甘油三酯血症。然而,目前随着自噬在肝脏疾病中的深入研究,自噬水平的变化对肝脏生理功能和疾病发生的影响及如何通过调控自噬治疗肝脏疾病、是否厄贝沙坦亦可通过调节自噬改善NAFLD及其相关机制仍有待进一步研究。
本实验通过采用先天瘦素受体基因缺失db/db小鼠NAFLD动物模型,观察厄贝沙坦对db/db小鼠肝脏脂肪变的影响及作用机制。实验结果显示,经厄贝沙坦干预后,db/db小鼠体重、肝指数、血脂、肝功能及肝脏脂肪变性均显著改善,与模型组相比有统计学意义。而且,经厄贝沙坦治疗后,db/db小鼠肝组织自噬相关蛋白Atg-7、beclin-1和LC3B表达均明显增加,与模型组比较亦有统计学意义。LC3B为自噬形成标志蛋白,包括LC3B-Ⅰ和LC3B-Ⅱ,而LC3B-Ⅰ需在Atg-7等蛋白的作用下转变为LC3B-Ⅱ,最终形成自噬小体。本实验通过Western blot和免疫组化2种方法均发现厄贝沙坦治疗后db/db小鼠肝组织LC3B-Ⅱ表达明显增加,而且通过透射电镜进一步观察,亦发现厄贝沙坦治疗后db/db小鼠肝细胞自噬小体也明显增多,提示厄贝沙坦可能通过促进肝细胞自噬从而减轻db/db小鼠肝脏脂肪变。此外,本实验亦通过Western blot方法检测各组肝组织PI3K/Akt/mTOR信号通路蛋白的表达。结果显示,模型组肝组织p-PI3K、p-Akt、p-mTOR的表达显著增加,而经厄贝沙坦干预后,肝组织p-PI3K、p-Akt、p-mTOR表达显著减少,进一步研究表明厄贝沙坦上调自噬相关蛋白Atg-7、beclin-1和LC3B-Ⅱ的表达可能与其抑制PI3K/Akt/mTOR信号通路有关。
综上所述,厄贝沙坦具有有效防治脂肪肝的作用,其机制可能与其抑制PI3K/Akt/mTOR信号通路,上调自噬相关蛋白Atg-7、beclin-1和LC3B-Ⅱ的表达,从而促进肝细胞自噬有关。
[参考文献]
[1]胡巢凤,孙丽萍,周晗,等.活血降脂方对小鼠脂肪肝的防治作用[J].中国病理生理杂志,2015,31(6):1087-1092.
[2]Chatterjee A,Kusunoki H,Taniyama Y,et al.Improvement of metabolic syndrome by irbesartan via the PPARγ/HGF pathway in apolipoprotein E knockout mice[J].Biomed Rep,2013,1(1):65-70.
[3]Kato J,Koda M,Kishina M,et al.Therapeutic effects of angiotensin II type 1 receptor blocker,irbesartan on non-alcoholic steatohepatitis using FLS-ob/obmale mice[J].Int J Mol Med,2012,30(1):107-113.
[4]陈靖,江家骥,郑琦,等.厄贝沙坦对高脂饲养脂肪肝大鼠 PPARγ表达及胰岛素抵抗的影响[J].安徽医科大学学报,2013,48(12):1429-1433.
[5]Murrow L,Debnath J.Autophagy as a stress-response and quality-control mechanism:implications for cell injury and human desease[J].Annu Rev Pathol,2013,8:105-137.
[6]Kwanten WJ,Martinet W,Michielsen PP,et al.Role of autophagy in the pathophysiology of nonalcoholic fatty liver desease:a controversial issue[J].World J Gastroenterol,2014,20(23):7325-7338.
[7]Xiao J,Ching YP,Liong EC,et al.Garlic-derivedS-allylmercaptocysteine is a hepato-protective agent in non-alcoholic fatty liver diseaseinvivoanimal model[J].Eur J Nutr,2013,52:179-191.
[8]Zhong J,Gong WQ,Lu L,et al.Irbesartan ameliorates hyperlipidemia and liver steatosis in type 2 diabeticdb/dbmice via stimulating PPAR-γ,AMPK/Akt/mTOR signaling and autophagy[J].Int Immunopharmacol,2017,42:176-184.
[9]Wong VW,Wong GL,Yeung DK,et al.Incidence of non-alcoholic fatty liver disease in Hong Kong:a population study with paired protonmagnetic resonancespectroscopy[J].J Hepatol,2015,62(1):182-189.
[10] 段晓燕,范建高.2014年脂肪性肝病临床研究进展[J].中华肝脏病杂志,2015,23(1):5-8.
[11] Kim KH,Lee MS.Autophagy as a crosstalk mediator of metabolic organs in regulation of energy metabolism[J].Rev Endocr Metab Disord,2014,15(1):11-20.
[12] Singh R,Kaushik S,Wang Y,et al.Autophagy regulates lipid metabolism[J].Nature,2009,458(7242):1131-1135.
[13] Toblli JE,Munoz MC,Cao G,et al.ACE inhibition and AT1 receptor blockade prevent fatty liver and fibrosis in obese Zucker rats[J].Obesity,2008,16(4):770-776.
[14] Rong X,Li Y,Ebihara K,et al.Irbesartan treatment up-regulates hepatic expression of PPARα and its target genes in obese Koletsky (fak/fak) rats:a link to amelioration of hypertriglyceridaemia[J].Br J Pharmacol,2010,160(7):1796-1807.

