甾体3-氰基-2-氨基吡啶5g对EC109细胞增殖、凋亡的影响
石晓丽,秦甜甜,刘卫华,徐晓微,张秀娟,周凯瑞,霍金玲,杨腾蛟,王 淙
郑州大学药物研究院 郑州 450001
食管肿瘤在全世界范围内的癌症死亡人数中排名第六[1]。有研究[2]报道,2012年新发食管癌45万例,同期死亡40万人左右,而大多数食管癌患者在临床晚期才被确诊[3]。放射治疗和化疗副作用明显且易使肿瘤细胞耐药,为临床治愈增加了难度[4],因此需要开发高效的新型食管癌抗癌剂。甾族化合物在人体生理过程中起着关键作用,在母核甾体结构中引入杂原子,杂环常常导致其生物学性质的改变,这些化合物可用于治疗剂的开发。近年来甾族化合物在抗肿瘤方面的作用成为研究热点,如用阿比特龙治疗前列腺癌患者的肿瘤转移[5]。本实验旨在探讨新型甾族化合物对食管癌EC109细胞增殖的影响及其相关机制。
1 材料与方法
1.1细胞和主要试剂3-氰基-2-氨基吡啶5g(以下简称S3C2A-5g)合成方法、碳谱、氢谱及质谱分析见参考文献[6]。S3C2A-5g溶于二甲基亚砜(DMSO)中。食管癌EC109细胞株由郑州大学药物研究院保存。RPMI 1640培养基、胰蛋白酶消化液(北京索莱宝公司),标准胎牛血清(以色列BI公司),Cleaved Caspase-3抗体(美国CST公司),凋亡检测试剂盒(南京凯基生物科技发展有限公司),活性氧检测试剂盒(上海碧云天生物技术有限公司)。
1.2细胞培养EC109细胞在37 ℃、体积分数5% CO2、饱和湿度环境下于RPMI 1640培养基中培养,每500 mL培养基补加50 mL胎牛血清。所有细胞2~3 d传代1次,隔天更换培养基,细胞生长至对数期后用于实验。
1.3不同浓度S3C2A-5g对EC109细胞增殖的影响收集对数生长期的EC109细胞,用培养基稀释后均匀加至96孔板中。细胞加入含S3C2A-5g(0.40、0.80、1.60、3.20、6.25、12.50、25.00、50.00、100.00 μmol/L)的培养基(过夜)作为实验组,另设置阴性对照组(细胞不加药处理)和空白对照组(只有培养基,无EC109细胞)。48或72 h后,每孔加入500 mg/L的MTT 20 μL,37 ℃孵育4 h。小心吸去上层培养基,每孔加150 μL DMSO,置于摇床10 min,570 nm处测定吸光度。细胞增殖抑制率=(阴性对照吸光度值-实验组吸光度值)/(阴性对照吸光度值-空白对照吸光度值)×100%。
1.4不同浓度S3C2A-5g对EC109细胞凋亡的影响EC109细胞接种到6孔板中,过夜后每孔细胞分别加入含0、2.5、5.0、10.0 μmol/L S3C2A-5g的培养基。24 h后,使用不含EDTA的胰蛋白酶收集细胞,每孔细胞加入500 μL Binding buffer缓冲液, 5 μL Annexin V和5 μL PI避光染色15 min。使用BD LSRFortessaTM流式细胞仪在1 h内上机检测和分析结果。实验重复3次。
1.5不同浓度S3C2A-5g对EC109细胞内活性氧聚集的影响按照活性氧检测试剂盒说明书操作,每孔4×103个EC109细胞均匀接种到96孔板中,过夜后加入0、2.5、5.0或10.0 μmol/L的 S3C2A-5g培养6 h,6 h后按照11 000的比例用无血清培养基稀释DCHF-DA,避光孵育20 min,无血清培养基洗涤细胞。使用高通量筛选系统成像进行检测,根据荧光强度分析细胞内活性氧的水平。实验重复3次。
1.6不同浓度S3C2A-5g对EC109细胞中Caspase-3表达的影响采用Hoechst染色和免疫荧光法进行检测。细胞用S3C2A-5g(0、2.5、5.0、10.0 μmol/L)处理24 h,40 g/L多聚甲醛固定细胞后使用含体积分数为5%胎牛血清的PBS封闭1 h。 加入稀释的Caspase-3(1400)一抗,在4 ℃下孵育过夜。 洗涤后,将细胞与FITC缀合的二抗于室温封闭2 h。 细胞核使用10 mg/L Hoechst 33342避光染色20 min。 通过激光共焦显微成像系统拍照并分析。实验重复3次。
1.7不同浓度S3C2A-5g对EC109细胞克隆形成的影响EC109细胞接种到6孔板中,每孔1×103个细胞。由于长时间考察S3C2A-5g对细胞的增殖抑制作用,过夜后每孔细胞分别加入0、2、3、5 μmol/L的S3C2A-5g,持续培养7 d,每3 d更换1次含S3C2A-5g的培养基。7 d后终止培养,加入1 mL甲醇固定细胞30 min。PBS洗去固定液,每孔加入1 mL结晶紫染色30 min,纯净水洗至无背景后室温风干。使用Image J软件计数。每个浓度均设3个复孔。
1.8统计学处理使用SPSS 17.0进行分析。应用析因设计的方差分析比较不同浓度S3C2A-5g对各组细胞增殖抑制率的影响,应用单因素方差分析和LSD-t检验比较不同浓度S3C2A-5g对EC109细胞细胞克隆、细胞凋亡、活性氧及细胞中Caspase-3蛋白表达的影响,检验水准α=0.05。
2 结果
2.1S3C2A-5g对EC109细胞增殖的影响见表1。S3C2A-5g能抑制EC109细胞的增殖,且随着作用浓度和时间的增加,增殖作用增强。

表1 S3C2A-5g对EC109细胞增殖的影响(n=3) %
2.2不同浓度S3C2A-5g对EC109细胞凋亡、细胞内活性氧水平和Caspase-3表达的影响结果见图1、2和表2。实验结果显示随着S3C2A-5g浓度的增加,EC109细胞内相对绿色荧光强度(绿色荧光强度与细胞内活性氧的水平成正比,胞内绿色荧光增强代表细胞氧化损伤程度)也随之增强(图1),提示S3C2A-5g可引起细胞内活性氧积聚,导致细胞发生氧化损伤。随着S3C2A-5g浓度增加,EC109细胞的细胞核呈现不规则扭曲、皱缩,绿色荧光强度也随之增加(图2,蓝色荧光代表细胞核),提示S3C2A-5g能激活Cleaved Caspase凋亡通路,诱导细胞凋亡。

A:0 μmol/L S3C2A-5g组;B:2.5 μmol/L S3C2A-5g组;C:5.0 μmol/L S3C2A-5g组;D:10.0 μmol/L S3C2A-5g组图1 不同浓度S3C2A-5g对细胞内活性氧的影响
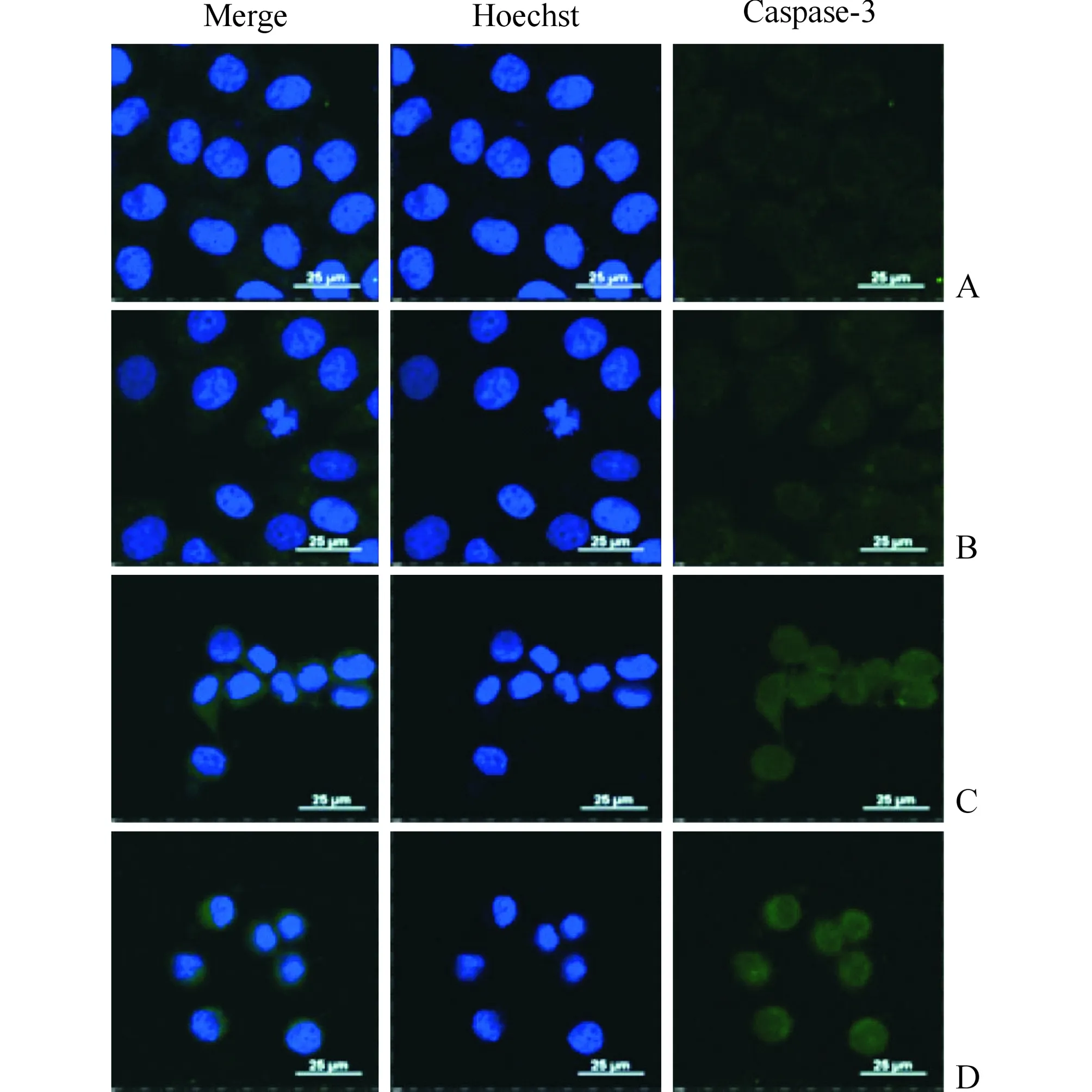
A:0 μmol/L S3C2A-5g组;B:2.5 μmol/L S3C2A-5g组;C:5.0 μmol/L S3C2A-5g组;D:10.0 μmol/L S3C2A-5g组图2 4组细胞核形态及Cleaved Caspase-3的表达

表2 不同浓度S3C2A-5g对EC109细胞凋亡、细胞内活性氧水平和Caspase-3表达的影响
2.3不同浓度S3C2A-5g对EC109细胞克隆形成影响结果见图3。用含2、3、5 μmol/L的S3C2A-5g的培养基培养EC109细胞7 d后细胞的克隆形成率为分别为(73.23±2.64)%、(20.15±3.73)%和(5.80±2.09)%,与0 mol/L S3C2A-5g组(100.00±0.01)%相比差异有统计学意义(F=621.164,P<0.001)。

A:0 μmol/LS3C2A-5g组;B:2 μmol/L S3C2A-5g组;C:3 μmol/L S3C2A-5g组;D:5 μmol/L S3C2A-5g组图3 不同浓度S3C2A-5g对EC109细胞克隆形成的影响
3 讨论
由于食管癌早期发现的检测方法有限,且该病病因复杂,放化疗易造成细胞耐药,使治疗难度增加。因此,开发高效的抗肿瘤化合物势在必行。MTT实验结果证实:S3C2A-5g作为新型甾体类抗肿瘤化合物,在低剂量下对食管癌EC109细胞有明显的抑制增殖作用,并且有剂量和时间依赖性。
活性氧自由基ROS是细胞凋亡的常见介质之一[7]。在各种药物诱导的细胞凋亡中经常观察到ROS的急性增加或瞬时爆发[8]。因此许多诱导细胞凋亡的试剂是氧化剂或细胞氧化代谢的刺激剂[9]。相反,许多凋亡抑制剂具有抗氧化活性或增强细胞抗氧化防御作用。由氧化应激引起的损伤导致细胞相关凋亡基因(应激反应转录因子)的活化。 ROS的增加也与氧化还原敏感的JNK/SAPK信号通路的激活有关,其通常参与基因转录激活和凋亡必需的蛋白翻译后修饰[10]。本实验结果证实了S3C2A-5g可以使EC109细胞内活性氧水平上升,进而造成细胞氧化损伤。
细胞凋亡是通过Cleaved Caspase家族的活化而介导的程序性细胞死亡,其中Cleaved Caspase-3作为细胞凋亡过程的执行者之一参与DNA的片段化过程[11]。此外,有研究证实,过表达的Cleaved Caspase-3蛋白可以诱导细胞耐药并促进肿瘤生长[12]。本实验结果显示S3C2A-5g能使Caspase家族中Cleaved Caspase-3表达升高,引起细胞凋亡。表明S3C2A-5g诱导EC109细胞凋亡与激活Caspase家族凋亡程序有关。
综上所述,S3C2A-5g可以在低剂量抑制食管癌EC109细胞的增殖、抑制克隆形成。进一步实验结果证实,诱导细胞凋亡的途径与细胞内活性氧含量增高和Caspase家族激活有关。因此,新型甾体2-氨基吡啶S3C2A-5g可能是用于治疗人类食管鳞状癌的潜在药物。
[1] 李丹.食管癌研究进展[J].吉林中医药,2012,32(9):970
[2] ARNOLD M,SOERJOMATARAM I,FERLAY J,et al.Global incidence of oesophageal cancer by histological subtype in 2012[J].Gut,2015,64(3):381
[3] ALSOP BR,SHARMA P.Esophageal Cancer[J].Gastroenterol Clin North Am,2016,45(3):399
[4] 张宏鑫,张颖.食管癌多药耐药机制的研究进展[J].现代药物与临床,2015,30(6):742
[5] RYAN CJ,SMITH MR,DE BONO JS,et al.Abiraterone in metastatic prostate cancer without previous chemotherapy[J].N Engl J Med,2013,368(2):138
[6] ZHANG YL,LI YF,SHI XL,et al.Solvent-free synthesis of novel steroidal 2-aminopyridines[J].Steroids,2016,115:147
[7] COOLEY-ANDRADE O,CHEUNG K,CHEW AN,et al.Detergent sclerosants at sub-lytic concentrations induce endothelial cell apoptosis through a caspase dependent pathway[J].Apoptosis,2016,21(7):836
[8] JANAKIRAMAN H,HOUSE RP,TALWAR S,et al.Repression of caspase-3 and RNA-binding protein HuR cleavage by cyclooxygenase-2 promotes drug resistance in oral squamous cell carcinoma[J].Oncogene,2017,36(22):3137
[9] 翟海杰,孟哲,陶海龙,等. 姜黄素对内毒素诱导的血管平滑肌细胞Toll样受体4/NADPH氧化酶/活性氧信号通路及炎症因子释放的影响[J]. 西安交通大学学报(医学版),2015, 36(4): 543
[10]HADDAD JJ.Redox and oxidant-mediated regulation of apoptosis signaling pathways: immuno-pharmaco-redox conception of oxidative siege versus cell death commitment[J].Int Immunopharmacol,2004,4(4):475
[11] 何光耀,谢貌,唐安洲等. 苦参碱对人鼻咽癌CNE2细胞裸鼠移植瘤生长及凋亡相关基因表达的影响[J].郑州大学学报(医学版),2014, 49(2):169
[12]CARMODY RJ,COTTER TG.Signalling apoptosis:a radical approach[J].Redox Rep,2001,6(2):77