影响急性肺损伤与急性呼吸窘迫综合征患者生存率的因素分析
侯磊 周洪顺
急性肺损伤(Acute lung injury,ALI)/急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)是由心源性以外各类肺内、外致病因素引发的严重急性进行性缺氧性呼吸衰竭,临床救治中死亡率高达45.8%~52.0%[1-2]。肺直接损伤、肺外间接损伤、脓毒症 、 吸入毒性气体 、急性胰腺炎、胸部以外的多发性创伤、烧伤等均可导致, 在创伤、烧伤等可能发生脏器功能不全患者中,ALI/ARDS的发病率最高且发生最早,严重威胁着患者生存[3]。因此,近年来临床一直致力于ALI/ARDS患者病情及预后评估参考指标的探索,但至今尚无统一结论[4]。此次研究就其生存率及影响因素进行了回顾性分析。
1 对象与方法
1.1 研究对象
回顾2013年3月至2017年5月ALI/ARDS患者资料,排除入院后24 h内病死者,ALI(氧合指数≥200 mmHg)39例,ARDS(氧合指数<200 mmHg)98例。137例研究对象均符合中华医学会呼吸病学分会制定的ALI/ARDS诊断标准[5],年龄≥18岁,机械通气治疗时长≥48 h,未合并急性左心衰竭、心源性肺水肿。
1.2 研究方法
以入院后30 d为终点事件记录时点,计算患者生存率并按照预后转归,将生存患者纳入生存组,将病死患者纳入病死组,比较两组患者基线临床资料,将存在统计学差异的因素纳入Logistic多因素回归分析,据此总结影响ALI合并ARDS患者生存率的相关危险因素。其中,基线临床资料包括年龄、急性生理与慢性健康(APACHE Ⅱ)评分、机械通气治疗时间、氧合指数、血液pH值、尿素氮、病因、肺外衰竭脏器数量、糖皮质激素使用情况、胃内容物误吸情况、脓毒血症发生情况等。
1.3 统计学方法
对本临床研究的所有数据采用SPSS 22.0进行分析,性别、年龄等单因素分析计数资料均以(n/%)表示,并采用χ2检验,影响ALI/ARDS患者生存率的相关因素采用Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 生存率分析
137例患者中,52例病死,生存率为62.04%,其中39例ALI患者生存率为89.74%(35/39),98例ARDS患者生存率为51.02%(50/98),ARDS患者生存率低于ALI患者,差异有统计学意义(P<0.05)。
2.2 单因素分析
生存组、病死组基线资料见表1,组间性别、激素治疗指标差异无统计学意义;年龄、APACHE Ⅱ评分、接受通气治疗时间、氧合指数、血液pH值、病因、肺外衰竭脏器数量以及胃内容物误吸、脓毒血症发生情况比较,差异有统计学意义(P<0.05)。
表1 生存组与病死组患者基线临床资料比较(±s)
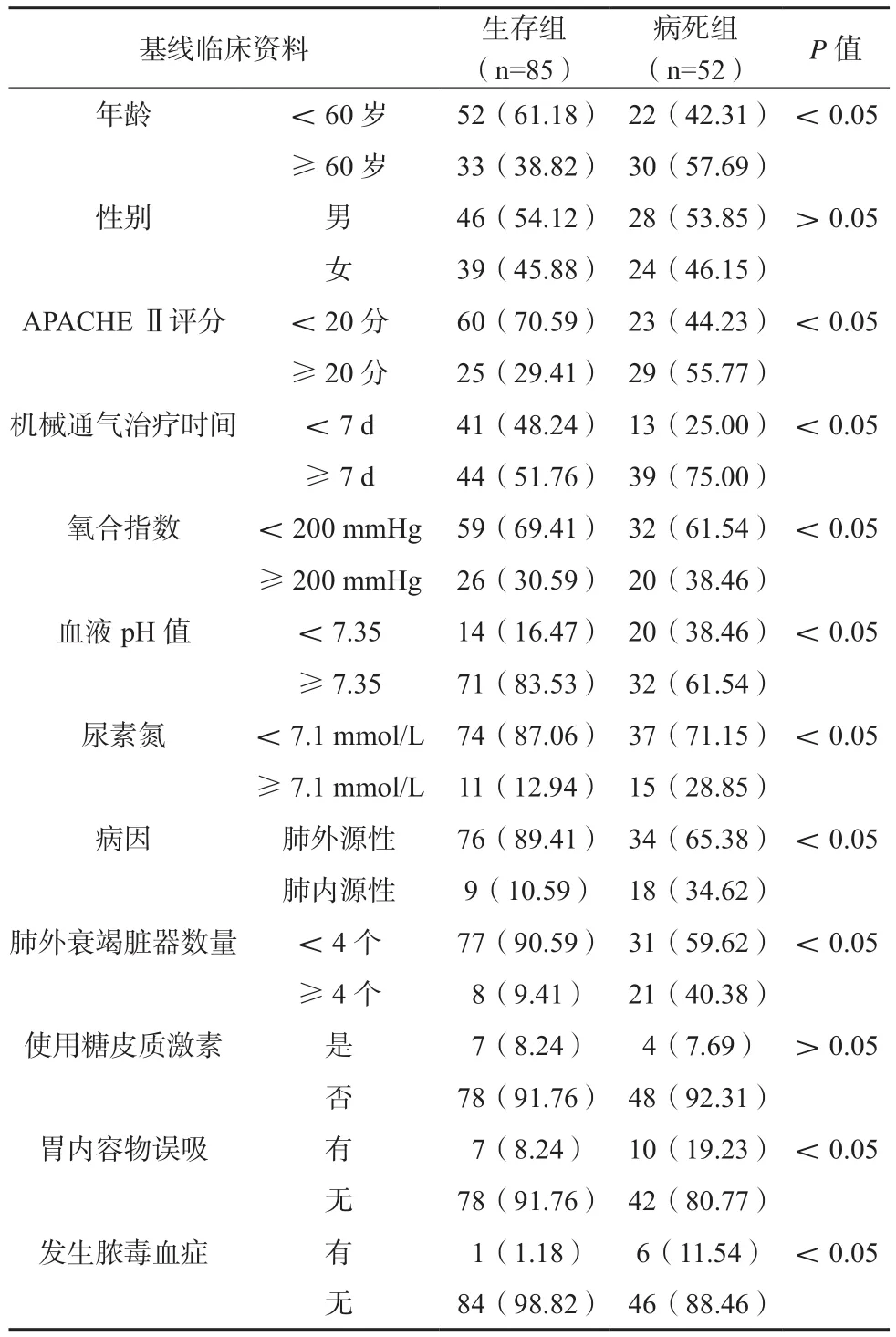
表1 生存组与病死组患者基线临床资料比较(±s)
基线临床资料 生存组(n=85)病死组(n=52) P值年龄 <60岁 52(61.18) 22(42.31) <0.05≥60岁 33(38.82) 30(57.69)性别 男 46(54.12) 28(53.85) >0.05女 39(45.88) 24(46.15)APACHE Ⅱ评分 <20分 60(70.59) 23(44.23) <0.05≥20分 25(29.41) 29(55.77)机械通气治疗时间 <7 d 41(48.24) 13(25.00) <0.05≥7 d 44(51.76) 39(75.00)氧合指数 <200 mmHg 59(69.41) 32(61.54) <0.05≥200 mmHg 26(30.59) 20(38.46)血液pH值 <7.35 14(16.47) 20(38.46) <0.05≥7.35 71(83.53) 32(61.54)尿素氮 <7.1 mmol/L 74(87.06) 37(71.15) <0.05≥7.1 mmol/L 11(12.94) 15(28.85)病因 肺外源性 76(89.41) 34(65.38) <0.05肺内源性 9(10.59) 18(34.62)肺外衰竭脏器数量 <4个 77(90.59) 31(59.62) <0.05≥4个 8(9.41) 21(40.38)使用糖皮质激素 是 7(8.24) 4(7.69) >0.05否 78(91.76) 48(92.31)胃内容物误吸 有 7(8.24) 10(19.23) <0.05无 78(91.76) 42(80.77)发生脓毒血症 有 1(1.18) 6(11.54) <0.05无 84(98.82) 46(88.46)
2.3 多因素分析
将有统计学差异的指标进行Logistic多因素回归分析,结果见表2,APACHE Ⅱ评分≥20分、机械通气治疗时间≥7 d、氧合指数<200 mmHg、尿素氮≥7.1 mmol/L、肺内源性病因及发生脓毒血症均为影响ALI/ARDS患者生存率的独立危险因素(P<0.05)。其中发生脓毒血症患者的危险因素是未发生脓毒血症者的3.3倍。
表2 影响ALI/ARDS患者生存率的相关因素分析(±s)
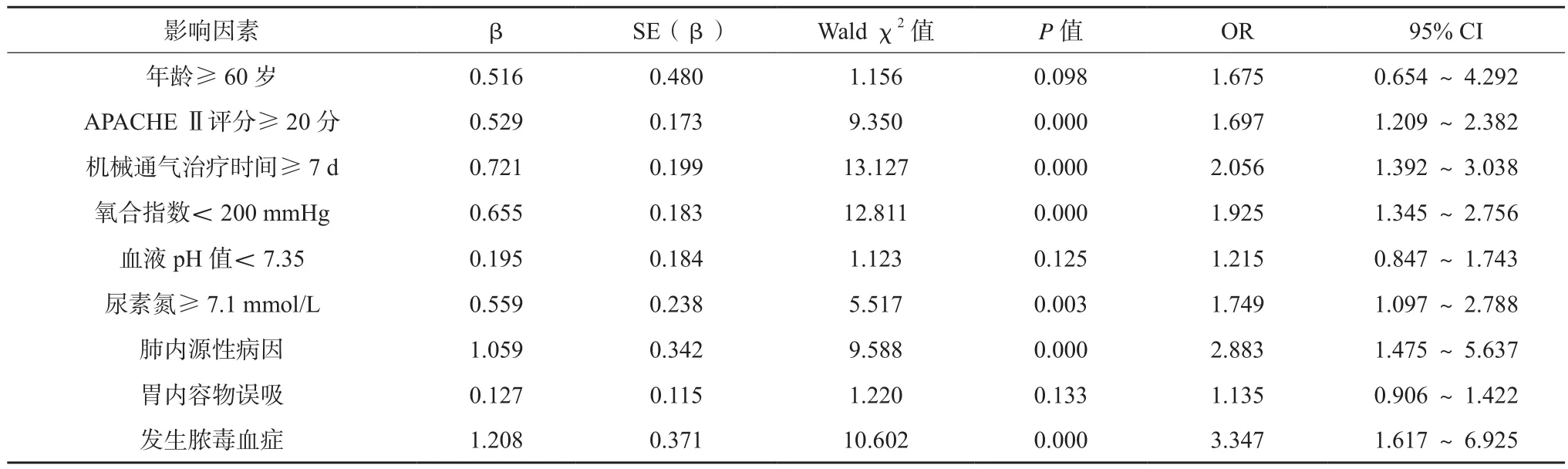
表2 影响ALI/ARDS患者生存率的相关因素分析(±s)
影响因素 β SE(β) Wald χ2值 P值 OR 95% CI年龄≥60岁 0.516 0.480 1.156 0.098 1.675 0.654~4.292 APACHE Ⅱ评分≥20分 0.529 0.173 9.350 0.000 1.697 1.209~2.382机械通气治疗时间≥7 d 0.721 0.199 13.127 0.000 2.056 1.392~3.038氧合指数<200 mmHg 0.655 0.183 12.811 0.000 1.925 1.345~2.756血液pH值<7.35 0.195 0.184 1.123 0.125 1.215 0.847~1.743尿素氮≥7.1 mmol/L 0.559 0.238 5.517 0.003 1.749 1.097~2.788肺内源性病因 1.059 0.342 9.588 0.000 2.883 1.475~5.637胃内容物误吸 0.127 0.115 1.220 0.133 1.135 0.906~1.422发生脓毒血症 1.208 0.371 10.602 0.000 3.347 1.617~6.925
3 讨论
目前国内外文献关于ALI/ARDS病死率的报道存在较大差异,有报道的患者病死率仅为22.20%,也有报道ALI/ARDS患者病死率可达72.30%[6-7]。本组病死率为37.96%,略低于临床平均水平,考虑与ALI患者占比较高、近年来ALI/ARDS的救治备受重视有关。
由于ALI/ARDS致病因素复杂,当前临床尚无单一指标能够满足ALI/ARDS病情及预后评估的要求[8-9]。此次研究借助Logistic回归分析,尽量排除混杂因素的影响,全面认识影响ALI/ARDS患者生存率危险因素的强度及相互关系。分析结果中APACHE Ⅱ评分、机械通气治疗时间、氧合指数、尿素氮等指标变化均可对患者生存率产生明显影响,OR值在1.135~3.347。APACHE Ⅱ评分包括生理参数、年龄、慢性健康状况等多方面内容,可基本反映患者全身各系统急慢性生理变化,患者评分不低于20分意味着其年龄较高、慢性健康状况较差或生理参数明显异常,故病死风险较高[10]。有学者在临床病死率推断公式中,赋予APACHE Ⅱ评分的权重达到0.146[11],亦有研究指出,APACHE Ⅱ评分与ALI/ARDS患者病死率呈正相关,即APACHE Ⅱ评分的进行性升高伴随着患者病死率的显著上升[12],这些都说明APACHE Ⅱ评分在ALI/ARDS患者预后评估中的重要参考意义。
机械通气治疗时间≥7 d、氧合指数<200 mmHg意味着患者肺损伤严重、机械通气纠正困难,这一过程多由效应细胞所致肺泡-毛细血管炎症导致,而严重肺损伤可进一步诱发炎症介质、代谢产物大量释放,进而加剧肺泡毛细血管、肺泡上皮细胞损伤,形成恶性循环并增加多脏器功能障碍综合征(MODS)发生风险,最终导致患者生存率下降[13-14]。ALI/ARDS所致肾脏长期低灌注、失控性炎症反应对肾小球滤过率功能的影响以及继发性感染持续释放毒素均可导致肾功能受损[15],尿素氮≥7.1 mmol/L提示患者已发生肾功能损伤,若肾功能损伤未得到及时控制,患者可在短期内发生内环境调节机制紊乱、肾衰竭甚至MODS,死亡率增加。
ALI/ARDS的发生原因包括肺内源性、肺外源性两种,前者早期病理生理改变以肺泡损伤为主,患者肺组织弹性阻力增加程度较肺外源性更为明显,而肺外源性病因所致ALI/ARDS以肺间质水肿为主,经肺复张、俯卧位通气等保护性通气治疗后,其通气力学、肺泡复张、气体交换指标往往可得到更为明显的改善,生存率也得以相应提高[16-17]。ALI/ARDS的发病基础为全身炎症反应综合征(SIRS),一旦启动,即便原发性因素得到控制,SIRS也可循自身规律不断进展,并缩短MODS形成时间[18],而发生脓毒血症意味着患者继发感染或感染未得到有效控制,此时SIRS效应更强,对患者生存质量的影响也更为严重,因此脓毒血症患者死亡率明显上升。
临床救治中综合上述因素评估患者病死风险并及时调整治疗策略,有助于改善患者预后质量、提高ALI/ARDS生存率。
[1] THABET F C, BOUGMIZA I M, CHEHAB M S, et al.Incidence, risk factors, and prognosis of intra-abdominal hypertension in critically ill children: a prospective epidemiological study[J]. J Intensive Care Med, 2016, 31(6):403-408.
[2] LAN H, ZHOU L, CHI D, et al. Preoperative platelet to lymphocyte and neutrophil to lymphocyte ratios are independent prognostic factors for patients undergoing lung cancer radical surgery: A single institutional cohort study[J]. Oncotarget, 2017,8(21): 35301.
[3] 伍冬冬, 潘频华, 覃庆武. 急性肺损伤/急性呼吸窘迫综合征发病机制研究进展[J]. 中华结核和呼吸杂志, 2015, 38(7): 524-527.
[4] CHEN W, WARE L B. Prognostic factors in the acute respiratory distress syndrome[J]. Clin Transl Med, 2015, 4(1): 23.
[5] ANTONELLI M, CONTI G, GRISTINA G R. Noninvasive Versus Invasive Ventilation in Patients with Hematological Malignancies[M]//Noninvasive Mechanical Ventilation.Springer International Publishing, 2016: 547-553.
[6] 孙红双, 吕菁君, 魏捷. 急性肺损伤发病机制及治疗的未来研究趋势[J]. 医学研究杂志, 2016, 45(1): 181-183.
[7] BUTT Y, KURDOWSKA A, ALLEN T C. Acute lung injury:a clinical and molecular review[J]. Arch Pathol Lab Med, 2016,140(4): 345-350.
[8] XUE M, SUN Z, SHAO M, et al. Diagnostic and prognostic utility of tissue factor for severe sepsis and sepsis-induced acute lung injury[J]. J Transl Med, 2015, 13(1): 172.
[9] MAHROUS A A, HASSANIEN A A, ATTA M S. Predictive value of C-reactive protein in critically ill patients who develop acute lung injury[J]. Egypt J Chest Dis Tuberc, 2015, 64(1): 225-236.
[10] AL-BILTAGI M A, ABO-ELEZZ A A A E B, ABU-ELA K T, et al. The prognostic value of soluble intercellular adhesion molecule 1 plasma level in children with acute lung injury[J]. J Intensive Care Med, 2017, 32(5): 320-325.
[11] 曾皋, 郭树彬. 急性肺损伤/急性呼吸窘迫综合征的生物标志物[J]. 中华急诊医学杂志, 2015, 24(4): 450-454.
[12] GACOUIN A, LOCUFIER M, UHEL F, et al. Liver cirrhosis is independently associated with 90-day mortality in ARDS patients[J]. Shock, 2016, 45(1): 16-21.
[13] HASHEMIAN S M R, SADR M, DABBAGH A, et al. Cells and Biomarkers in ARDS[J]. J Cell Mol Med, 2015, 1(1): 43-44.
[14] 李一粟, 马建珍, 仲京,等. 肺保护性机械通气治疗心脏直视术后急性肺损伤[J]. 空军医学杂志, 2003, 19(2):101-102.
[15] KANGELARIS K N, CALFEE C S, MAY A K, et al. Is there still a role for the lung injury score in the era of the Berlin definition ARDS?[J]. Ann Intensive Care, 2014, 4(1): 4.
[16] WANG T, ZHANG L, LUO K, ET al. Noninvasive versus invasive mechanical ventilation for immunocompromised patients with acute respiratory failure: a systematic review and meta-analysis[J]. BMC Pulm Med, 2016, 16(1): 129.
[17] KAO K C, HU H C, HSIEH M J, et al. Comparison of community-acquired, hospital-acquired, and intensive care unitacquired acute respiratory distress syndrome: a prospective observational cohort study[J]. Crit Care, 2015, 19(1): 384.
[18] TAGAMI T, NAKAMURA T, KUSHIMOTO S, et al. Earlyphase changes of extravascular lung water index as a prognostic indicator in acute respiratory distress syndrome patients[J]. Ann Intensive Care, 2014, 4(1): 27.

