孕期和哺乳期PM2.5气管暴露对子代小鼠主要脏器发育的影响及槲皮素的干预效果研究
刘伟 张敏佳 周雅琳 李雍 许雅君
LIU Wei, ZHANG Minjia , ZHOU Yalin , LI Yong, XU Yajun.
高浓度的细颗粒物(空气动力学直径小于或等于2.5μm 的颗粒物,简称PM2.5) 是大气环境中危害最大的污染物之一[1]。Cohen等[2]于2015年在《Lancet》发表研究报告指出,PM2.5长期暴露造成420万死亡和1.031亿伤残调整寿命年(DALYs),分别占全球死亡和DALYs的7.6%和4.2%。有研究表明孕期暴露于PM2.5会导致新生儿低出生体重[3-4],并可能导致线粒体损伤进而导致子代心脏毒性[5]。诸多研究表明,PM2.5发挥毒性作用的机制与氧化损伤和炎症反应有着密切的联系[6-7]。
本文就膳食中天然存在的成分槲皮素能否拮抗PM2.5造成的健康损害进行探索,以期降低空气污染所致的疾病负担发生的风险。槲皮素(quercetin)是植物界分布最广的黄酮类化合物,广泛存在于水果、蔬菜以及一些中草药中[8],是人类饮食中最主要的生物类黄酮,具有抗炎、抗纤维化、调节免疫功能、抗肿瘤、抗氧化等多种生物学功能,且槲皮素在孕期使用相对安全无毒。1982年,Willhite[9]就曾报道大鼠整个孕期服用2~2 000 mg/kg槲皮素对胎鼠均没有明确的致畸作用,提示其用于孕期的安全性。
基于上述研究背景,对小鼠孕期及哺乳期进行PM2.5染毒,同时进行槲皮素干预,并在产后3天、10天、21天及5周测定仔鼠4个时间的脏器重量和脏器系数(包括心、肝、脾、肺、肾),并测量仔鼠小肠长度和大肠长度,旨在探索PM2.5对子代小鼠发育的影响及槲皮素对该影响的干预效果。
材料与方法
一、材料
2.设备和仪器:电子天平(SPN3001F,奥豪斯,上海)、电子天平(BS2000S,赛多利斯,德国)、小动物麻醉机(VMR,Matrx,美国)、冷冻干燥机(ERV085, Millrock,美国)。
3.实验动物:健康成年SPF级ICR孕鼠60只,由北京大学医学部实验动物科学部提供,许可证号SCXK(京)2016-0010。动物饲养在屏障环境,温度(22±2) ℃,相对湿度50%~60%,昼夜照明时间为12 h:12 h。
二、方法
1. PM2.5采集和制备:于2016年11月15日到2017年4月30日在北京市海淀区学院路某高层建筑的六层平台采集PM2.5样本,采用TH-150C型号智能中流量(TSP)采样器(天虹智能仪器表厂,武汉)将PM2.5样品收集在石英滤膜上。用干净消毒的手术剪将膜剪成3~4 ×0.5 cm大小后放入洁净烧杯中,加入90 ml的消毒去离子水,并用保鲜膜封口。水浴超声提取20 min,加冰保持水温在20 ℃以下,重复三次,将提取液冷冻用六层灭菌纱布过滤,收集洗脱液,使用冷冻干燥机(ERV085, Millrock, USA)进行干燥24 h后,刮取,称重。用无菌 PBS 配制成浓度为15 mg/kg的溶液,-20℃避光保存。
2.实验操作:各组母鼠于孕期第3、6、9、12、15天和产后第3、6、9、12、15、18天,在3%异氟烷短效气体麻醉下进行气管滴注。除空白对照组外,其余各组滴注PM2.5溶液(15 mg/kg),空白组给予相应剂量的干净滤膜洗脱液;各组孕鼠于孕期和哺乳期每天灌胃,空白对照组和PM2.5模型组给予0.15%羧甲基纤维素钠灌胃,槲皮素三个干预组分别予以50 mg/kg、100 mg/kg、200 mg/kg的槲皮素羧甲基纤维素钠混悬液灌胃。记录母鼠孕期体重变化,所有母鼠自然分娩,观察记录自然分娩的时间、生产的只数及性别。分娩后各窝仔鼠均母乳喂养,记录母鼠哺乳期体重变化,生后3天将每窝仔鼠按性别分别称重并编号,根据仔鼠体重,利用随机数表随机留取雌雄仔鼠各3只,其余仔鼠处死。各组留取的仔鼠于生后21天后断乳,处死母鼠,称取每只母鼠主要脏器(心、肝、脾、肺、肾)重量。仔鼠饲喂市售生长期饲料直至5周龄。于生后3天、10天、21天、5周每窝取雌雄仔鼠各1只称重后脱颈处死,称取脏器(心、肝、脾、肺、肾)重量并测量小肠、大肠长度。
3.统计学处理:脏器系数计算公式为脏器系数(mg/g)=脏器重量(mg)/仔鼠体重(g)。数据均应用 SPSS 20.0软件进行分析,采用单因素方差分析( one-way ANOVA),方差齐时利用LSD法进行两两比较,方差不齐时采用Tamhane’s T2法进行两两比较。P<0.05表示差异有统计学意义。
结 果
一、仔鼠基本情况
各组仔鼠活产只数、性别比和平均出生体重见表1。各组活产仔鼠总只数及仔鼠平均出生体重差异无统计学意义,每只孕鼠约产12~13只活胎。

表1 活产仔鼠基本情况
二、母鼠体重变化及脏器系数
如图1-(a)所示,孕0天至孕9天各组体重无显著差异。从孕12天开始,PM2.5模型组母鼠体重逐渐高于空白组(P<0.05),差异具有统计学意义。从孕15天开始槲皮素中剂量组母鼠体重显著低于PM2.5模型组并持续至孕18天(P<0.05)。从孕12天开始槲皮素高剂量组母鼠体重显著低于PM2.5模型组并持续至孕18天(P<0.05)。至孕18天时,槲皮素中剂量组和高剂量组母鼠体重已经达到空白对照组水平。
如图1-(b)所示,PM2.5模型组哺乳期体重从产后0天至11天呈现出高于空白对照组的趋势。从产后14天开始,PM2.5模型组母鼠体重显著高于空白组(P<0.05),差异具有统计学意义。产后21天槲皮素中剂量组母鼠体重显著低于PM2.5模型组(P<0.05),且达到了空白对照组水平(P>0.05)。槲皮素高剂量组母鼠体重从产后当天开始便显著低于PM2.5模型组(P<0.05),并一直持续到产后21天。21天时槲皮素高剂量组母鼠体重已经达到空白对照组水平。
产后21天PM2.5模型组、槲皮素低剂量组母鼠的肝重量、肝系数高于空白组(P<0.05),槲皮素高剂量组母鼠的肝重量低于PM2.5模型组(P<0.05)。槲皮素中剂量组母鼠的肝重量与空白对照组无显著差异,且槲皮素中、高剂量组肝系数与空白对照组无显著差异。PM2.5模型组、槲皮素低剂量组母鼠的脾重量、脾系数高于空白组(P<0.05)。PM2.5模型组母鼠的肾系数低于空白组(P<0.05),槲皮素低、中、高剂量组母鼠的肾系数高于PM2.5模型组(P<0.05)。见表2。
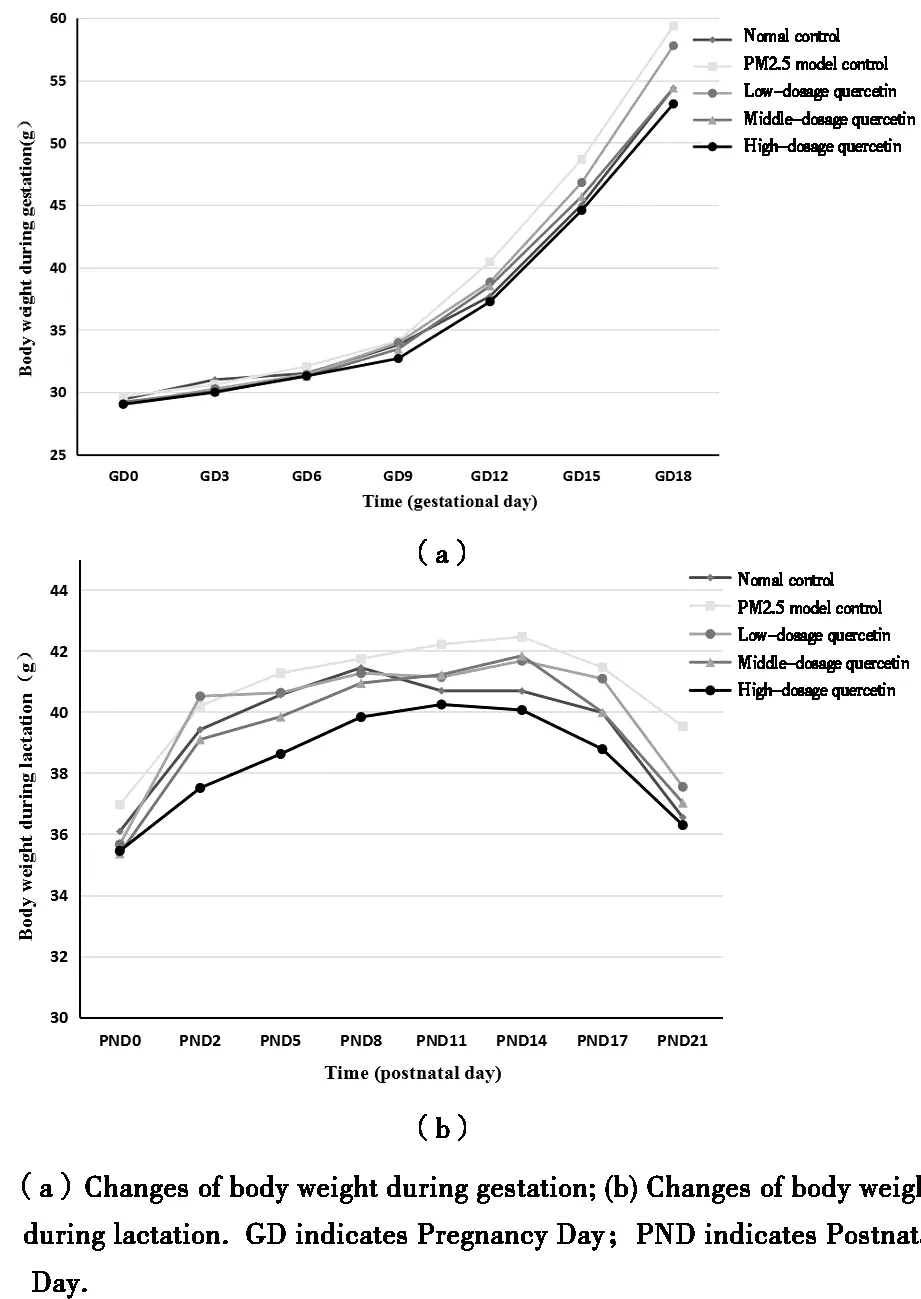
图1 孕期及哺乳期体重变化Figure 1 Changes of body weight during pregnancy and lactation
三、仔鼠体重、脏器重量和脏器系数
1.仔鼠体重变化:产后10天槲皮素高剂量组雄性仔鼠的体重显著低于空白对照组;产后21天PM2.5模型组、槲皮素中、高剂量组雄性仔鼠的体重显著低于空白对照组(P<0.05)。雌性仔鼠体重各组间差异无统计学意义。见表3。
2.生后3天仔鼠主要脏器重量和脏器系数: PM2.5模型组生后3天雄性仔鼠的脾重量低于空白对照组,脾系数亦小于空白对照组;槲皮素低、中剂量组的脾系数高于PM2.5模型组,差异均具有统计学意义(P<0.05)。PM2.5模型组3天雄性仔鼠的肾重量轻于空白对照组,肾系数也小于空白对照组;槲皮素中剂量组的肾系数高于PM2.5模型组(P<0.05)。如表所示,槲皮素低剂量组3天雌性仔鼠的脾重量低于空白对照组,PM2.5模型组、槲皮素低剂量组的脾系数小于空白对照组(P<0.05);槲皮素高剂量组脾系数大于PM2.5模型组(P<0.05)。见表4。
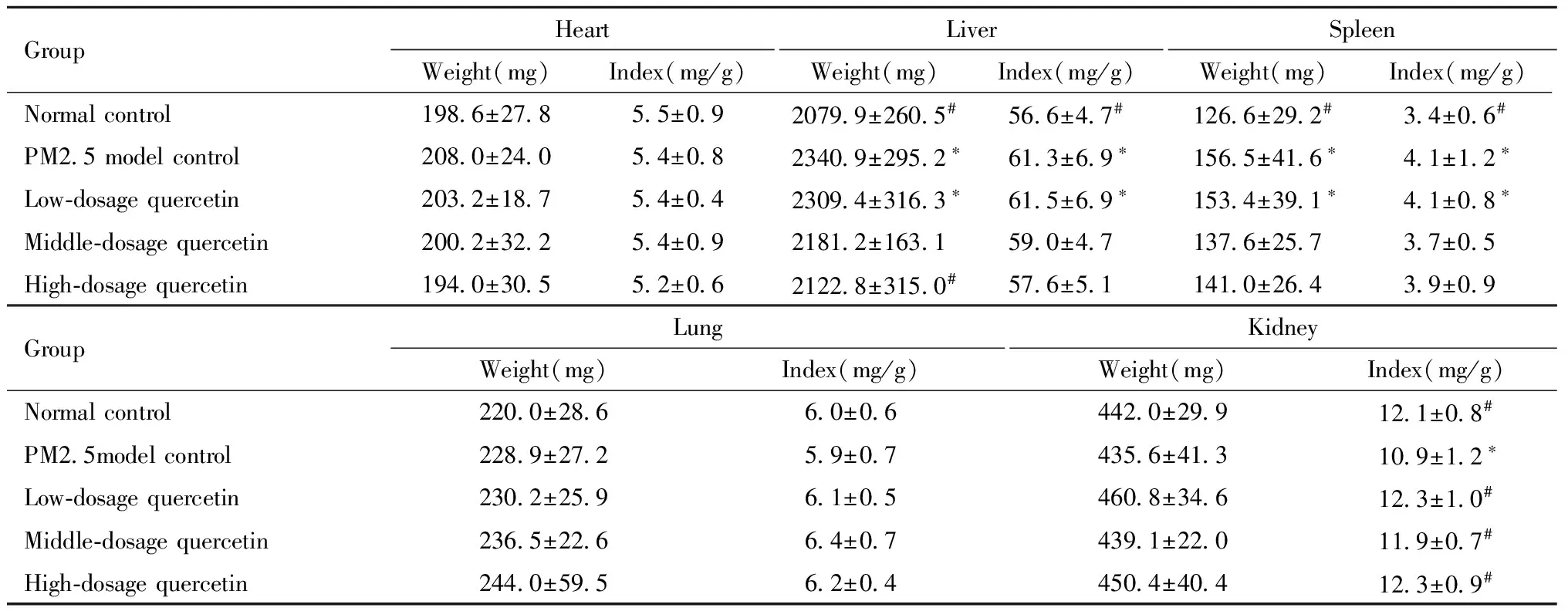
表2 母鼠产后21天心、肝、脾、肺和肾等脏器重量及脏器系数
Note: compared with control group ,*P<0.05; compared with PM2.5 model group,#P<0.05.

表3 仔鼠体重变化
Note: compared with control group ,*P<0.05; compared with PM 2.5 model group,#P<0.05.

表4 生后3天仔鼠心、肝、脾、肺和肾等脏器重量和脏器系数
Note: compared with control group ,*P<0.05; compared with PM2.5 model group,#P<0.05.
3.生后10天仔鼠主要脏器重量和脏器系数: PM2.5模型组、槲皮素中剂量组的雄性仔鼠的心脏重量、心脏系数均大于空白对照组,同时,槲皮素高剂量组的心脏系数大于空白对照组(P<0.05)。PM2.5模型组10天雄性仔鼠的脾重量、脾系数低于空白对照组,槲皮素低剂量组的脾重量、脾系数大于PM2.5模型组(P<0.05)。槲皮素低剂量组雄性仔鼠肺系数大于空白对照组(P<0.05)。如表所示,槲皮素中剂量组雌性仔鼠的心脏系数大于空白对照组(P<0.05)。见表5。
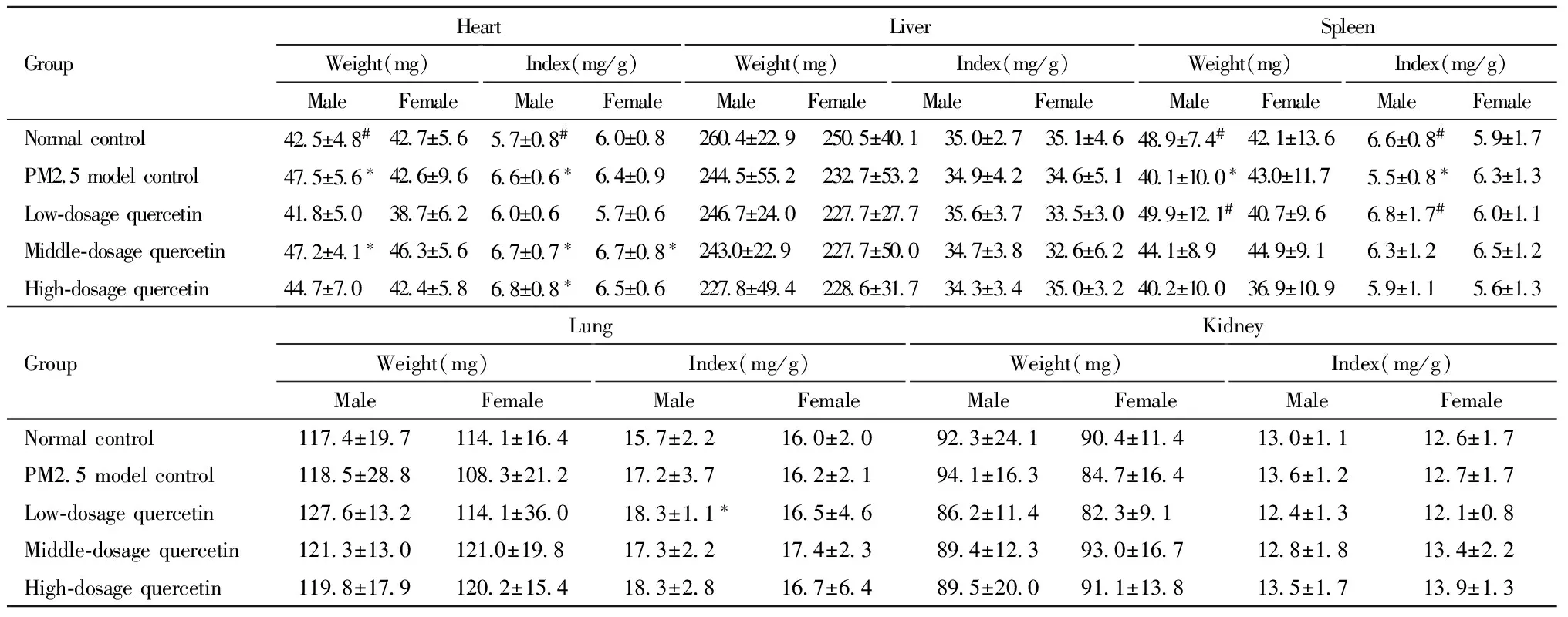
表5 生后10天仔鼠心、肝、脾、肺和肾等脏器重量和脏器系数Table 5 The weight and indexes of heart, liver, spleen, lung and kidney among offspring mice of postnatal day of 10
Note: compared with control group ,*P<0.05; compared with PM2.5 model group,#P<0.05.
4.生后21天仔鼠主要脏器重量和脏器系数: PM2.5模型组、槲皮素高剂量组雄性仔鼠的心脏重量低于空白对照组,同时,槲皮素中剂量组的心脏重量、心脏系数均大于PM2.5模型组(P<0.05)。PM2.5模型组、槲皮素中、高剂量组21天雄性仔鼠的脾重量低于空白对照组,PM2.5模型组、槲皮素高剂量组脾系数低于空白对照组。PM2.5模型组雄性仔鼠的肾脏重量小于空白对照组(P<0.05)。如表所示,PM2.5模型组雌性仔鼠的心脏系数大于空白对照组(P<0.05)。PM2.5模型组、槲皮素中剂量组雌性仔鼠的肺系数大于空白对照组(P<0.05)。见表6。

表6 生后21天仔鼠心、肝、脾、肺和肾等脏器重量和脏器系数Table 6 The weight and indexes of heart, liver, spleen, lung and kidney among offspring mice of postnatal day of 21
Note: compared with control group ,*P<0.05; compared with PM2.5 model group,#P<0.05.
5.生后35天仔鼠主要脏器重量和脏器系数: PM2.5模型组、槲皮素低、中剂量组的雄性仔鼠的心脏重量、心脏系数均大于空白对照组(P<0.05)。槲皮素高剂量组心脏系数亦大于空白对照组(P<0.05)。如表所示,PM2.5模型组、槲皮素中剂量组雌性仔鼠的肝脏重量、肝脏系数均小于空白对照组(P<0.05)。PM2.5模型组雌性仔鼠的肾脏重量、肾脏系数均小于空白对照组(P<0.05)。见表7。
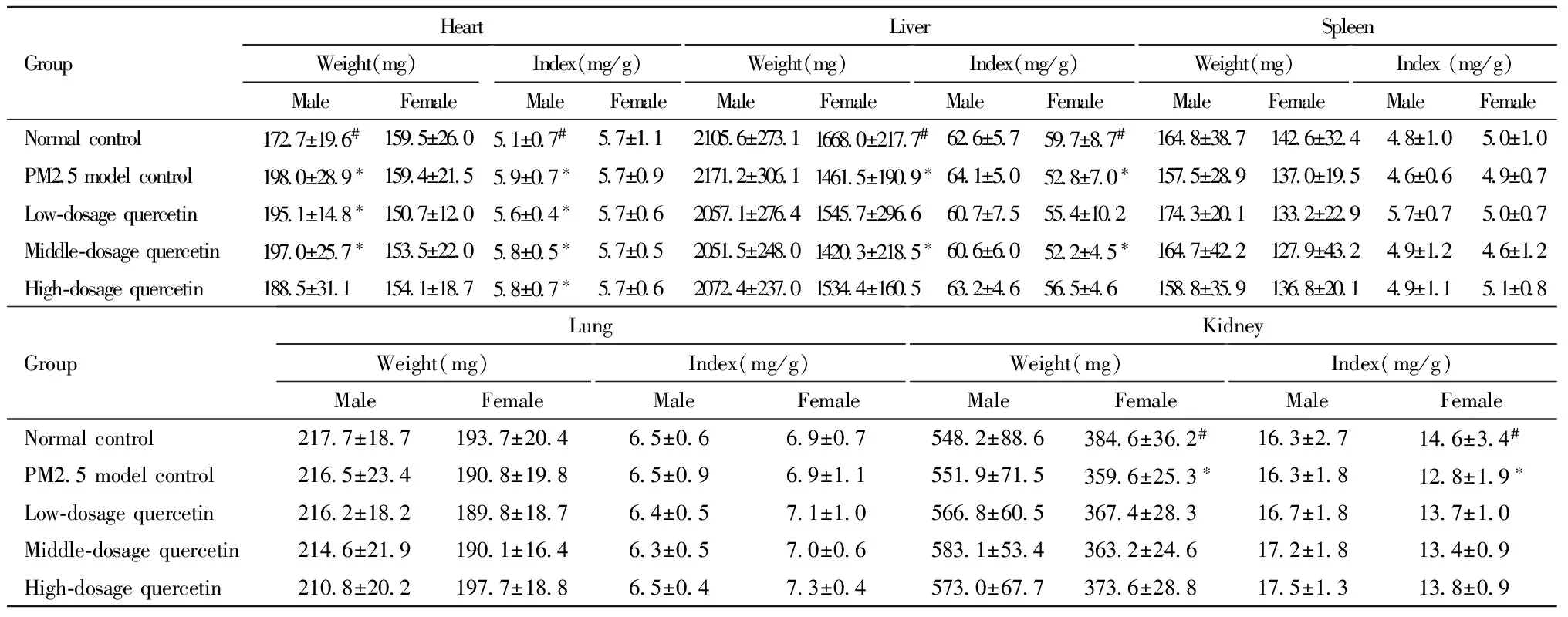
表7 生后35天仔鼠心、肝、脾、肺和肾等脏器重量和脏器系数Table 7 The weight and indexes of heart, liver, spleen, lung and kidney among offspring mice of postnatal day of 35
Note: compared with control group ,*P< 0.05; compared with PM2.5 model group,#P<0.05.
四、仔鼠肠道长度
1.小肠长度:对于雄性仔鼠,各组间生后3天肠道长度无显著统计学差异,如图2-(a)所示。PM2.5模型组、槲皮素低、中、高剂量组生后10天小肠长度显著短于空白对照组(P<0.05),如图2-(b)所示。PM2.5模型组、槲皮素低、中、高剂量组生后21天小肠肠道显著短于空白对照组(P<0.05),如图2-c所示。PM2.5模型组、槲皮素低、中、高剂量组生后5周小肠肠道显著短于空白对照组(P<0.05),如图2-d所示。
对于雌性仔鼠,组间生后3天肠道长度无显著统计学差异,如图2-(a)所示。PM2.5模型组、槲皮素低剂量组生后10天雌性仔鼠小肠长度显著短于空白对照组;槲皮素中、高剂量组小肠长度大于PM2.5模型组(P<0.05),如图2-(b)所示。各组间生后21天、5周肠道长度差异无统计学意义,如图2-(c)、2-(d)所示。
2.大肠长度:PM2.5模型组、槲皮素高剂量组的10天雄性仔鼠的大肠长度短于空白对照组(P<0.05),如表8所示。其余各时间点五组之间差异无统计学意义。
讨 论
研究显示,大气PM2.5是威胁人类健康的因素之一,增加多种疾病的发生率并造成沉重的疾病负担[10]。诸多流行病学研究表明,孕产妇暴露于PM2.5与胎儿和新生儿发育障碍有关[11-13]。PM2.5通过影响母体代谢、免疫功能对母体产生健康危害,进而影响胎儿和婴幼儿发育,且PM2.5可以穿过胎盘屏障直接产生影响[14]。降低空气污染所致的疾病负担存在重大挑战,尽快开展干预措施研究非常重要,本研究选择食物中存在的天然多酚类成分槲皮素进行干预研究,探索安全有效的干预方法。
Xu等[15]研究结果显示,小鼠暴露于PM2.5可诱发肥胖,可能与PM2.5暴露导致机体氧化状态、炎症因子、胰岛素敏感性等发生改变有关,在本研究中,孕期及哺乳期PM2.5模型组母鼠体重要显著高于空白组。哺乳期100 mg/kg、200 mg/kg的槲皮素干预组母鼠体重显著低于PM2.5模型组,可能与槲皮素可以调节胰岛素的生理活性[16]、抗氧化、抗炎等作用有关。张凯等[17]和Liu等[18]对兰州地区PM2.5毒性的研究显示,小鼠孕期暴露于PM2.5可影响仔鼠体重,但在本研究中,除21天PM2.5模型组雄性仔鼠体重显著低于空白组外,其他4个时间点雌雄仔鼠5个组间的体重差异均无统计学意义,造成这种差异的原因可能包括:(1)两个研究的PM2.5采样城市不同,PM2.5颗粒样品的化学组成以及其所携带的化学物质成分可能存在差异;(2)两个研究的染毒剂量、染毒时间和染毒次数均不相同,直接造成对后代发育的影响也不尽相同,具体的原因仍需更多的研究证实。
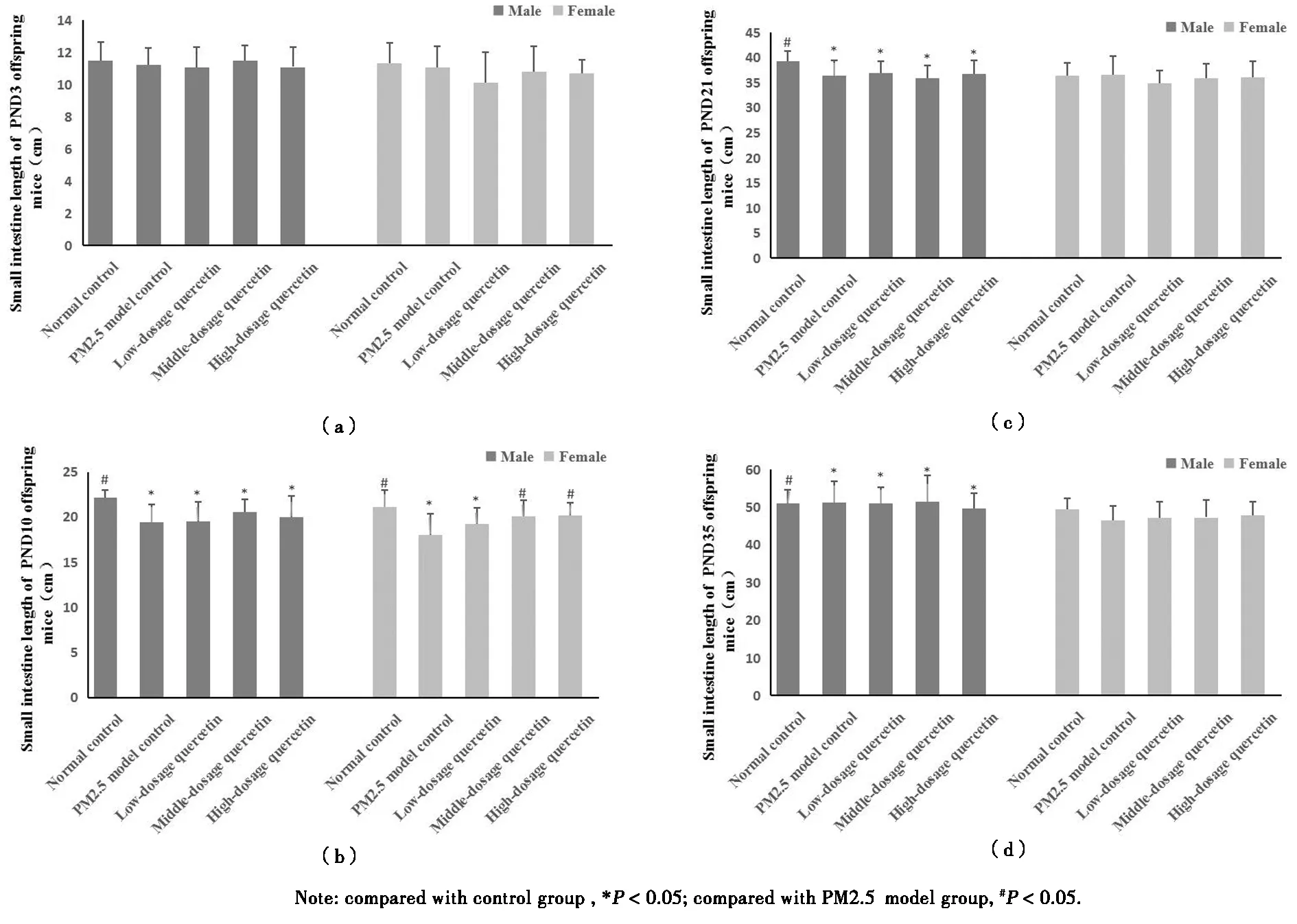
图2 仔鼠小肠长度Figure 2 The length of small intestine among offspring mice
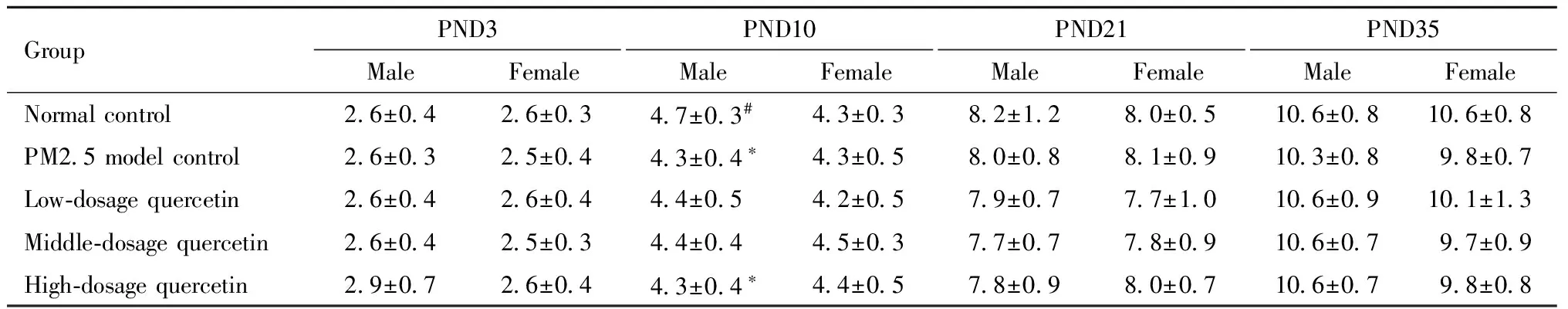
GroupPND3MaleFemalePND10MaleFemalePND21MaleFemalePND35MaleFemaleNormalcontrol2 6±0 42 6±0 34 7±0 3#4 3±0 38 2±1 28 0±0 510 6±0 810 6±0 8PM2 5modelcontrol2 6±0 32 5±0 44 3±0 4∗4 3±0 58 0±0 88 1±0 910 3±0 89 8±0 7Low⁃dosagequercetin2 6±0 42 6±0 44 4±0 54 2±0 57 9±0 77 7±1 010 6±0 910 1±1 3Middle⁃dosagequercetin2 6±0 42 5±0 34 4±0 44 5±0 37 7±0 77 8±0 910 6±0 79 7±0 9High⁃dosagequercetin2 9±0 72 6±0 44 3±0 4∗4 4±0 57 8±0 98 0±0 710 6±0 79 8±0 8
Note: compared with control group ,*P<0.05; compared with PM2.5 model group,#P<0.05.
本研究发现,PM2.5孕期和哺乳期暴露主要影响母鼠肝、脾及肾的重量和脏器系数,而对于心、肺的重量和系数影响较小。PM2.5模型组、50 mg/kg槲皮素干预组母鼠肝脏重量及肝系数均高于空白组,推测PM2.5暴露可能导致了母鼠肝脏的慢性炎症[19]。100 mg/kg、200 mg/kg槲皮素干预组母鼠肝脏重量、肝脏系数与空白组无显著差异,且200 mg/kg槲皮素干预组母鼠肝脏重量低于PM2.5模型组。PM2.5模型组的脾重量、脾系数显著高于空白组,说明在本实验条件下,孕期暴露于PM2.5已对母体主要免疫器官造成影响。Aztatzi-Aguilar等[20]发现亚慢性暴露于PM2.5可导致大鼠肾损伤,在本研究中PM2.5模型组母鼠肾指数显著低于空白组,槲皮素干预可逆转PM2.5导致的母鼠肾脏毒性。
通过对四个时间点脏器重量和脏器系数的比较得出,PM2.5孕期和哺乳期暴露主要影响后代心脏、脾脏的重量和脏器系数,其次是肾脏,而对于仔鼠肝脏、肺的重量和系数影响较小。对于脏器重量和脏器系数的影响多表现为PM2.5模型组较空白组明显降低,说明孕期和哺乳期暴露于PM2.5会影响后代脏器的组织发育,进一步可能会影响相应脏器功能。但是,心脏的发育结果比较特殊,PM2.5模型组仔鼠生后10天、5周龄时心脏重量和系数均表现为大于空白组,分析原因可能是模型组仔鼠宫内心脏发育不良,直接导致生后心脏功能不全,为了尽量适应进一步发育的需要,心脏过度做功发生代偿性肥大,进而出现后期心脏重量增加的情况。PM2.5导致子代小鼠脏器重量显著变化的原因很复杂,可能是由于PM2.5本身对母体造成一系列的炎症反应和氧化应激状态[21],甚至影响到母婴免疫平衡系统,这一系列的损伤导致子宫内的胚胎及其主要脏器发育不全,而这一现象一直持续到出生后。先天脏器发育不全又可能会进一步导致某些脏器(如心脏)后续的代偿性增大。孕期和哺乳期50 mg/kg、100 mg/kg的槲皮素干预,可以在一定程度上逆转PM2.5导致的子代脏器发育不良,但200 mg/kg的槲皮素干预效果并不理想,提示槲皮素的保护作用存在一定的适宜剂量范围。
动物的小肠作为营养物质消化、吸收的重要场所和动物体内最大的内分泌器官、免疫屏障,其结构和功能的完整性对于保证动物健康,促进生长发育具有重要意义[22]。而大肠能够吸收水、无机盐和部分维生素,且大肠内的酸碱度和温度对一般细菌的繁殖极为适宜,故细菌在此大量繁殖,而肠道菌群对于人体健康发挥着非常重要的作用。本研究发现,孕期和哺乳期PM2.5暴露对子代小鼠肠道长度有显著影响。PM2.5模型组仔鼠的小肠长度要显著短于空白组,而对于大肠长度的影响要弱于小肠。通过分析各组雄性仔鼠小肠长度差异看出,PM2.5导致小肠长度变短的效应可延续至生后5周。100 mg/kg、200 mg/kg槲皮素补充对生后10天雌性小肠长度变化可起到一定程度干预效果。与PM2.5模型组相比,不同剂量槲皮素干预已表现出逆转肠道长度的趋势,但无统计学差异。
本研究结果提示,孕期及哺乳期经呼吸道暴露于PM2.5,对雄性子代主要脏器结构发育的影响要大于雌性子代,表现在脏器重量、脏器系数、肠道长度的异常要多于雌性后代。在本研究剂量范围内,槲皮素可以在一定程度上减轻孕期和哺乳期经呼吸道PM2.5暴露对后代主要脏器发育的危害,但存在适宜的干预剂量范围,并非剂量越高拮抗效果越好。
1 郭宇宏,迪丽努尔·塔力甫,康宏,等.新疆部分城市可吸入颗粒物的浓度及粒径分布.环境科学与技术,2012,35:240-244.
2 Cohen AJ,Brauer M,Burnett R,et al.Estimates and 25-year trends of the global burden of disease attributable to ambient air pollution:an analysis of data from the Global Burden of Diseases Study 2015.Lancet,2017,389:1907-1918.
3 Liu A,Qian N,Yu H,et al.Estimation of disease burdens on preterm births and low birth weights attributable to maternal fine particulate matter exposure in Shanghai,China.Sci Total Environ,2017,609:815-821.
4 Li X,Huang S,Jiao A,et al.Association between ambient fine particulate matter and preterm birth or term low birth weight:An updated systematic review and meta-analysis.Environ Pollut,2017,227:596-605.
5 Wang H,Peng X,Cao F,et al.Cardiotoxicity and Mechanism of Particulate Matter 2.5 (PM2.5) Exposure in Offspring Rats During Pregnancy.Med Sci Monit,2017,23:3890-3896.
6 Delfino RJ,Staimer N,Tjoa T,et al.Airway inflammation and oxidative potential of air pollutant particles in a pediatric asthma panel.J Expo Sci Environ Epidemiol,2013,23:466-473.
7 Pei Y,Jiang R,Zou Y,et al.Effects of Fine Particulate Matter (PM2.5) on Systemic Oxidative Stress and Cardiac Function in ApoE(-/-) Mice.Int J Environ Res Public Health,2016,13.
8 Gruse J,Kanitz E,Weitzel JM,et al.Quercetin Feeding in Newborn Dairy Calves Cannot Compensate Colostrum Deprivation:Study on Metabolic,Antioxidative and Inflammatory Traits.PLoS One,2016,11:e146932.
9 Willhite CC.Teratogenic potential of quercetin in the rat.Food Chem Toxicol,1982,20:75-79.
10 Lim SS,Vos T,Flaxman AD,et al.A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions,1990-2010:a systematic analysis for the Global Burden of Disease Study 2010.Lancet,2012,380:2224-2260.
11 Sun X,Luo X,Zhao C,et al.The association between fine particulate matter exposure during pregnancy and preterm birth:a meta-analysis.BMC Pregnancy Childbirth,2015,15:300.
12 Fleisch AF,Rifas-Shiman SL,Koutrakis P,et al.Prenatal exposure to traffic pollution:associations with reduced fetal growth and rapid infant weight gain.Epidemiology,2015,26:43-50.
13 Dadvand P,Parker J,Bell ML,et al.Maternal exposure to particulate air pollution and term birth weight:a multi-country evaluation of effect and heterogeneity.Environ Health Perspect,2013,121:267-373.
14 Lertxundi A,Baccini M,Lertxundi N,et al.Exposure to fine particle matter,nitrogen dioxide and benzene during pregnancy and cognitive and psychomotor developments in children at 15 months of age.Environ Int,2015,80:33-40.
15 Xu X,Yavar Z,Verdin M,et al.Effect of early particulate air pollution exposure on obesity in mice:role of p47phox.Arterioscler Thromb Vasc Biol,2010,30:2518-2527.
16 Seiva FR,Chuffa LG,Braga CP,et al.Quercetin ameliorates glucose and lipid metabolism and improves antioxidant status in postnatally monosodium glutamate-induced metabolic alterations.Food Chem Toxicol,2012,50:3556-3561.
17 张凯,李兴杰,杨蔚,等.兰州市城关区采暖期大气PM_(2.5)成份分析及对子代小鼠的影响研究.冰川冻土,2016,38:1718-1723.
18 Liu Y,Wang L,Wang F,et al.Effect of Fine Particulate Matter (PM(2.5)) on Rat Placenta Pathology and Perinatal Outcomes.Med Sci Monit,2016,22:3274-3280.
19 Zheng Z,Zhang X,Wang J,et al.Exposure to Fine Airborne Particulate Matters Induces Hepatic Fibrosis in Murine Models.J Hepatol,2015,63:1397-1404.
20 Aztatzi-Aguilar OG,Uribe-Ramírez M,Narváez-Morales J,et al.Early kidney damage induced by subchronic exposure to PM(2.5) in rats.Part Fibre Toxicol,2016,13:68.
21 Liu W,Zhang M,Feng J,et al.The Influence of Quercetin on Maternal Immunity,Oxidative Stress,and Inflammation in Mice with Exposure of Fine Particulate Matter during Gestation.IntJ Environ Res Public Health,2017,14:592.
22 黄春喜,袁建敏,周向梅.牛磺酸对断奶小鼠小肠发育的影响.中国农业大学学报,2014,19:129-136.

