沼渣水热炭添加对猪粪中温厌氧消化的促进作用
靳红梅, 杜 静, 郭瑞华, 奚永兰, 叶小梅, 黄红英
(1.江苏省农业科学院循环农业研究中心, 江苏 南京 210014; 2.江苏省农业废弃物资源化工程技术研究中心, 江苏 南京 210014; 3.农业部农村可再生能源开发利用华东科学观测实验站, 江苏 南京 210014)
厌氧消化产沼气技术是农业废弃物无害化处理与资源化利用的重要途径,是促进生态循环农业发展的重要举措[1-2]。十三五期间,我国将以沼气和生物天然气为主要处理方向,基本解决大规模畜禽养殖场粪污处理和资源化问题,大中型沼气工程是未来发展的趋势[3]。
我国是生猪养殖大国,截至2016年生猪年饲养总量(出栏+存栏)已超过11亿头[4]。随着养殖规模不断扩大,猪场产生的粪尿及污水也相对集中,猪粪水的处理已成为畜禽污染处理和防治重点[5]。厌氧消化技术是猪场粪污(特别是废水)处理的重要环节[5],以1个5000 m3池容的沼气工程为例,正常运行每年可消纳粪污30000 t,可减少COD排放1500 t,同时可获得甲烷(CH4)6.98×105m3,残留的沼渣及沼渣还田后可减少化学氮肥约780 t。这不仅大幅提升了粪污集中处理水平和清洁燃气集中供应能力,而且增加了农民受益,适应了新时代广大农民对美丽宜居乡村建设的新要求[3]。
提高物料产气率、保持操作稳定性和沼液质量是提高沼气工程效益的重要因子[6]。然而,物料在厌氧消化过程中会有一些抑制物质[7],如重金属(Cu,Zn,Cr,Cd,Ni,Pb和Hg等)、盐类(Na,K,Mg,Ca,Al等)、氯酚及卤代脂肪族化合物、杀虫剂及抗生素、木质素水解产物等直接抑制物,以及消化过程中产生的挥发性脂肪酸、长链脂肪酸、柠檬烯、硫化物和无机氮等间接抑制物,严重影响产气率及系统稳定性。其中,重金属、盐类和抗生素等物质在猪粪中的含量较高[8-9],很可能成为厌氧消化过程的抑制物质。将猪粪与秸秆等物料混合发酵是降低单一发酵中抑制物质不利影响的有效手段[10]。然而,与欧洲等国家的大型沼气工程不同,我国养殖场沼气工程发酵原料单一、缺乏原料供应服务[10],多原料混合厌氧消化操作和过程控制对于厌氧消化原料较为单一的养猪场较难应用[11]。活性炭可用于猪粪厌氧发酵,具有减少厌氧消化启动阶段有机负荷冲击、可吸附抑制性的硫化物、加速产甲烷菌群累积,以及提高猪粪厌氧消化产甲烷率的作用[12]。但是活性炭价格昂贵,需从厌氧消化剩余物中回收再利用才能减少运行成本,操作不便[13]。因此,研究低成本、简便、高效且环保的猪粪厌氧消化产气率促进方法,对规模猪场沼气工程的实际运行具有迫切的应用价值。
利用农业废弃物制备的生物炭与活性炭理化性质相近,但价格低廉,近年来作为活性炭的替代品在土壤质量改善、环境污染阻控和污染修复等方面有广泛的应用[14]。目前,应用较多的生物炭采用的多为热解炭化所得,其反应温度通常在300℃以上,且物料含水率一般不超过10%[14];而水热炭化(HTC)以水(常处于亚临界状态)为反应介质,在密闭的高压反应釜中以一定温度(通常在300℃以下)和压强将其中的生物质转化为水热炭[15-17]。HTC不受原料含水率的制约,特别适合沼渣这类含水率高(通常超过85%)的废弃物,且操作简单,耗能低(自身是一个放热过程),可大大降低运行成本[18]。
目前,国内外只有少量报道针对生物炭添加对畜禽粪便厌氧发酵产气影响的研究,绝大多数利用的是热解生物炭[19-21],且结果并不一致。例如,Mumme[19]等研究发现添加生物炭可以提高鸡粪、牛粪和藻类及其混合物的产气潜力和甲烷含量;而Inthapanya[20]等研究却发现,添加生物炭在提升牛粪厌氧消化产气潜力的同时,降低了气体中的甲烷含量,且过量的生物炭对提升牛粪厌氧消化产气潜力没有作用。除了生物炭添加量外,其自身的特性也对厌氧消化产气和产甲烷潜力也有显著的影响[21],如pH值、比表面积和孔径大小、表面功能基团等,会调控厌氧发酵体系物质传递与转化、微生物代谢与协同作用等过程。利用HTC处理沼渣,可获得纯度高、分散性好、粒度易控制的生物炭材料,但其在厌氧发酵过程中的作用目前尚不清晰[22]。
尽管很多碳材料都具有促进畜禽粪便厌氧发酵系统稳定性的优点,但从生命周期评价的角度分析,沼渣水热生物炭是耗能最小、成本最低的一种生物炭[23]。将沼渣水热生物炭回用于沼气工程,并提高其对厌氧消化系统和有毒有害物质的削减作用,不仅实现了物质循环,而且开辟了沼渣的高值化利用途径,直接指导生产实践。基于此,本研究以190℃制备的猪粪沼渣为研究对象,探讨其添加后对不同进料浓度(TS1=4.0%和TS2=8.0%)的猪粪中温(37℃)厌氧消化产气特性的影响,以期为养殖场粪污厌氧消化高效处理提供有效的技术支撑。
1 材料与方法
1.1 试验材料
猪粪取自江苏省金坛市某规模生猪养殖场,一次性取样,0~4℃冷藏备用,其总固体(TS)含量为23.9%,挥发性固体(VS)含量为74.4%,总有机碳(TOC)、总氮(TN)和总磷(TP)含量分别为33.0%,2.7%和3.4%,C/N为12.2。接种物为本实验室中温(35℃~40℃)驯化污泥,甲烷产量达55%以上,其TS为3.0%,VS为67.2%
猪粪沼渣(M-R)一次性取自江苏省金坛市某规模生猪养殖场的沼气工程,是新鲜猪粪经完全混合式厌氧反应器(CSTR)中温(37℃)厌氧消化所得,其含水率为86.2%。于0℃~4℃下保存,备用。猪粪沼渣水热炭的制备采用微型聚四氟乙烯水热合成反应釜(HR-200,上海霍铜仪器有限公司)。称取M-R样品约20 g,装入反应釜,旋紧不锈钢外套,置于烘箱中升温至目标温度(即190℃)。据Gao[17]等报道,水热反应时间超过4 h后对样品的化学特性影响甚低。因此,本研究选取反应时间为4 h。反应结束后,待反应釜自然降至室温,取出样品于55℃烘箱中烘干,此时得到的产物即为猪粪沼渣水热炭,记为H-190。M-R和H-190的基本理化特性详见表1。

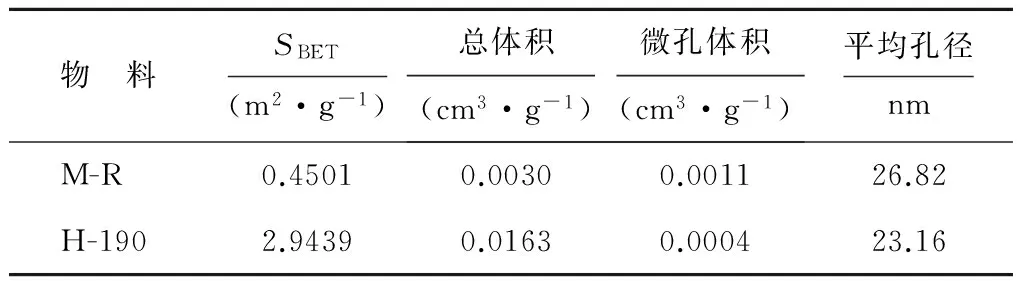
表1 猪粪沼渣及其水热炭的基本特性
注:“-”表示无;DOC为可溶性有机碳;VC为挥发性碳;FC为固定碳
1.2 试验设计
厌氧消化试验在180 mL血清瓶内进行,有效容积150 mL,在顶部设有出气孔口和气体取样口,示意图见图1。整个试验期间将发酵罐放置在恒温水浴锅内,以保证发酵罐内温度恒定在37℃。
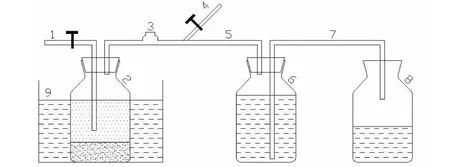
1.取样口; 2.发酵罐; 3.气体采样瓶; 4.排气口; 5.导气管;6.集气瓶; 7.导水管; 8.集水瓶; 9.恒温水箱图1 厌氧发酵装置图
试验采用批次发酵,TS负荷分别为4.0%和8.0%。在上述反应器中接种驯化污泥20.0%(v/v),生物炭的添加量分别占系统干物质重的10.0%,同时设置未加生物炭的处理作为对照,各物料添加量详见表2。物料混合均匀后,通入氮气1 min以驱赶发酵罐内的空气,密封后进行厌氧发酵。每个处理3个重复,取平均值进行分析。

表2 各处理的物料组成及添加量
1.3 取样及分析
1)TS含量:105℃电热恒温鼓风干燥箱(DHG-9076A,上海精宏实验设备有限公司,上海)中烘至恒重,称重; 2)VS含量:550℃马弗炉(SRJX-4-13,天津市泰斯特仪器有限公司,天津)灼烧至恒重时测定; 3)日产气量采用排水法测定; 4)产气中甲烷含量采用GC9890A/T气相色谱仪(南京仁华色谱科技应用开发中心,南京)进行检测,柱箱温度150℃,检测器温度100℃,载气为高纯氢气; 5)表面特征图谱(SEM)采用扫描电子显微镜(JSM-6400-SEM,JEOL,日本)测定;6)表面积采用ASAPTM 2020比表面积仪(麦克仪器公司,美国)测定,以氮气等温吸脱附计算比表面积、孔径分布等。
1.4 数据分析
厌氧消化系统产气过程的动力学模拟采用修正的Gompertz模型,其公式如下:
式中:P(t)为t时间内的累积产气量,mL·g-1VS;Pm为最大累积产气量,mL·g-1VS;Rm为最大产气速率,mL·g-1d-1VS;λ为延滞期,d;e为常数,2.71828。
各指标在不同处理间的差异采用单因素方差分析(ANOVA),多重比较采用最小显著性差异(LSD)法。统计分析软件为SPSS(v.13.0,SPSS公司,美国),数据拟合采用OriginPro 2016(OriginLab公司,美国)。
2 结果与讨论
2.1 猪粪沼渣水热炭对表面特性
猪粪沼渣经190℃水热炭化后,H-190水热炭的表面特征变化详见图2,图3和表3。由图2和图3可见,HTC-190的表面明显变得粗糙;热化学转化过程中,原料碳骨架有轻微的破坏,导致孔隙结构更发达、更复杂。同时,HTC-190表面形成许多微米球颗粒(图3中的小图),这有利于提高其比表面积[15]。表3的测定结果进一步证实了SEM图谱(见图2和图3)的分析。可以看出,HTC后水热炭的比表面积比猪粪沼渣提高6.5倍,总孔隙体积提高5.4倍;但微孔体积有所降低,这主要是由于水热炭材料中中孔结构占优势[16]。N2吸附/脱附特征曲线(见图4和图5)也证明了这一点,根据国际纯理论与应用化学联合会(IUPAC)划分的吸附等温线类型[24],H-190的吸附类型为II型等温线,说明这类物质一般由非孔或宏孔固体产生。在较低压力条件下吸附量都很低,随着压力的增大吸附量上升,明显出现H3型迟滞回线(见图4和图5),主要由片状颗粒材料或由缝形孔材料给出。生物炭的特殊表面特性对厌氧消化过程中的微生物有以下促进作用:首先,生物炭可吸附厌氧消化过程中产生的有害抑制物质(如氨分子或氢氧化铵、硫化物等)有吸附作用,降低其对产甲烷过程的损害[12,19];其次,生物炭可固定微生物[25],改变微生物群落互营关系,促进产甲烷过程中的直接电子传递(DIET)作用[26-27]。

图2 猪粪沼渣表面扫描电镜图
物 料SBET(m2·g-1)总体积微孔体积(cm3·g-1)(cm3·g-1)平均孔径nmM-R0.45010.00300.001126.82H-1902.94390.01630.000423.16
注:SBET为比表面积(基于BET多分子层吸附理论)
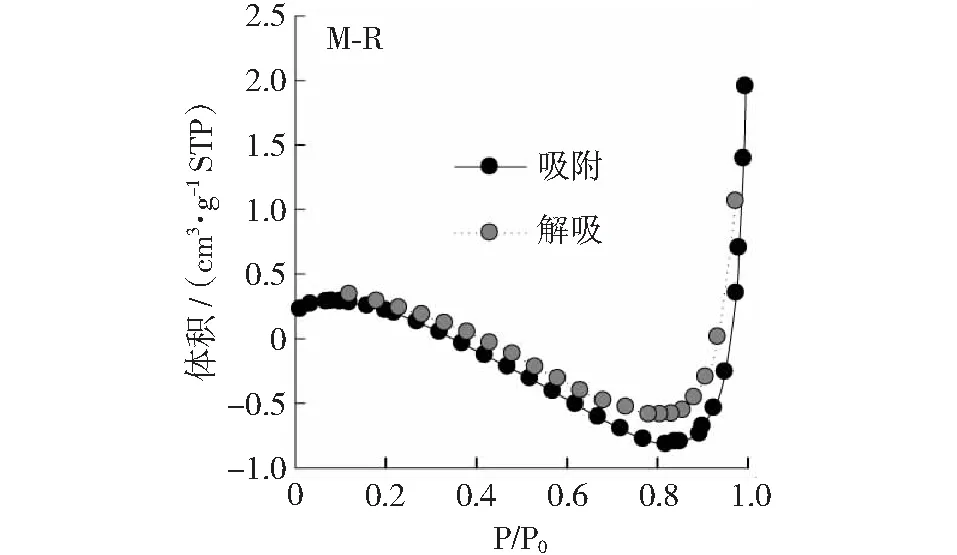
图4 猪粪沼渣的氮气吸附-解吸等温线
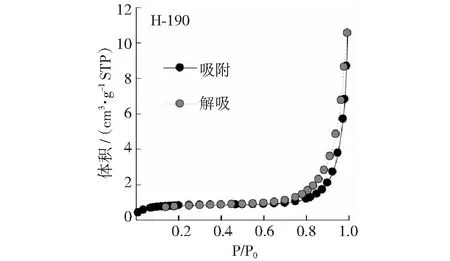
图5 猪粪沼渣水热炭的氮气吸附-解吸等温线
2.2 产气特性
2.2.1 日产气量及甲烷含量
各处理日产气量、累积产气量及甲烷含量如图6~图8所示。由图6可以看出:空白对照(T0C)在前5 d基本正常产气,但之后由于没有新鲜底物(猪粪)的补充,系统逐渐无产气能力,这说明接种物活性基本正常。猪粪厌氧消化的初始阶段,产气量逐渐增加,至第3天出现第1次高峰,随后小幅降低。第5天后日产气量稳步上升,至第12天,TS=4%的处理其日产气量达到最大值(即99和85 mL),随后逐渐降低,直至第32天,反应基本结束;而TS=8%的处理至第12天时,其日产气量仍有巨大产气潜力,并在第19天达到产气最大值(即110和123 mL),随后逐渐降低直至反应结束。添加H-190后,不同TS处理的猪粪消化系统其产气量均有所增加,特别是T8H处理第20 d后,日产气量显著高于T8C(见图6)。
由图7可见,除T0C外,各处理的累积产气量的变化在12 d前基本一致;之后不同TS处理的累积产气量表现出明显的差异,即高浓度大于低浓度、添加生物炭的处理大于未添加生物炭的处理,这与日产气速率基本一致。消化时间T90(即完成一个厌氧消化周期内总产气量的90%所需的时间),是表征消化性能和消化效率的重要指标[28]。T4C和T8C对照处理中,T90分别为23和24 d;添加H-190后,T90分别为21和26 d。可见,低浓度消化系统的有效产气周期减少2 d,这也与前期添加热解炭的结果相一致[21],主要是由于添加水热炭后系统的缓冲能力和微生物的活性得到增强,底物被消耗的速率增加。这说明添加猪粪沼渣水热炭后提高了系统的处理量,具有一定的工程意义;而高浓度消化系统的有效产气周期增加2 d,表明添加H-190后该系统的消化效率小幅降低,但具体原因有待进一步分析。
日产甲烷含量如图8所示。系统正常运行后,除T0C处理甲烷含量保持在55%外,其他各处理甲烷含量绝大多数在60%以上,说明系统产气正常。高浓度处理的甲烷产量大于低浓度处理,这与厌氧消化过程中产气速率的变化密切相关。但产气高峰(19 d)后,添加H-190的处理其产甲烷速率仍有小幅增加,并维持在70%左右。这可能是由于H-190促进了厌氧发酵系统中微生物的互营作用。大量研究表明[26-27,29],生物炭同颗粒活性炭、炭布等物质一样,可作为厌氧发酵过程的电子传递物质,促进Geobactermetallireducens和Geobactersulfurreducens的直接电子传递(DIET),对产甲烷系统非常有利。此外,Hansen[12]等发现,活性炭可促进猪粪厌氧消化过程中甲烷产生,主要原因是活性炭可吸附抑制性的硫化物。此外,水热炭表面的羰基也可能与CO2结合,促进CH4的生成[30]。
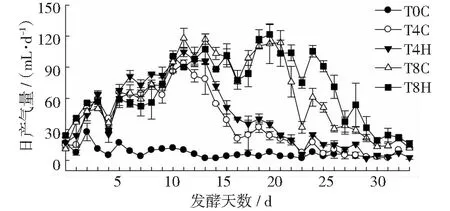
图6 猪粪中温厌氧发酵中的日产气量
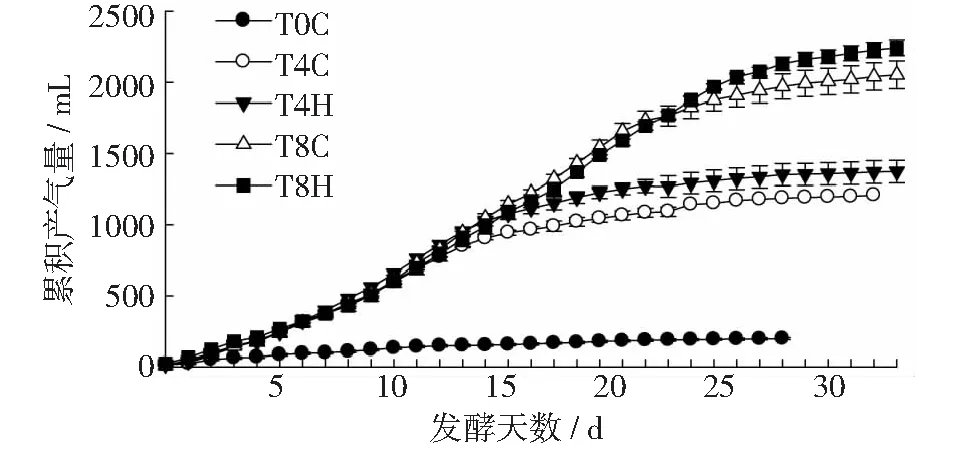
图7 猪粪中温厌氧发酵中的累积产气量
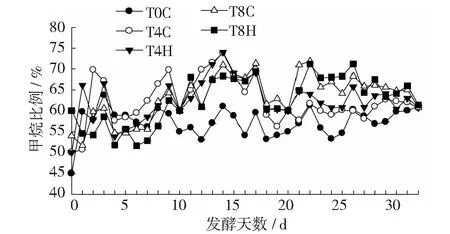
图8 猪粪中温厌氧发酵中的甲烷比例
2.2.2 单位VS产气量及产甲烷量
扣除接种物产气量后,添加猪粪沼渣水热炭后系统的单位VS产气量和产甲烷量如图9和图10所示。可以看出:中温厌氧消化结束后,TS=4%和TS=8%的消化系统其单位VS产气量分别为241.18和208.41 mL·g-1VS;添加H-190后,单位VS产气量分别为313.07和233.59 mL·g-1VS,增幅分别为29.81%和26.22%。未添加水热炭的系统中,猪粪单位VS产甲烷量分别为151.60和127.88 mL·g-1VS(见图9);添加H-190后,系统产甲烷量分别为191.35和145.00 mL·g-1VS,增幅分别为12.08%和13.39%(见图10)。其中,只有T4H处理的单位VS产气量及产甲烷量显著(p<0.05)高于T4C;而TS=8%的系统其产气量和产甲烷量反而小于TS=4%的系统。推测是由于在高有机负荷条件下,厌氧消化系统中短链脂肪酸和乙醇的产生量大,导致过多中间产物的累积,抑制了微生物的互养代谢,进而对产甲烷菌群落产生干扰[31]。添加H-190后,中间产物的抑制现象得到有效的缓解。大量相关研究表明,生物炭添加后厌氧消化系统中互养代谢的促进是由于微生物间电子传递速率的提高[32],特别是DIET[31-32]。本研究中,M-190添加后是否促进了猪粪中温厌氧消化体系的DIET,尚需进一步研究。
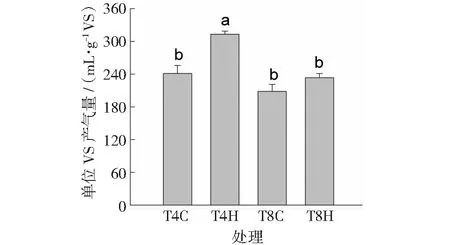
注:不同的小字字母表示各处理间差异显著(p<0.05)图9 中温厌氧发酵中的产气量

注:不同的小写字母表示各处理间差异显著(P<0.05)图10 中温厌氧发酵中的甲烷含量
2.3 动力学分析
修正的Gompertz模型能较好地反映厌氧消化过程中底物利用、微生物生长、发酵产物情况[33]。因此,采用修正的Gompertz模型对本研究中的单位 VS产气量进行拟合。由图11和图12可以看出,各处理产气特性与模型拟合度均较高(R2>0.99)。从拟合结果(见表4)看,拟合值Pm与实测值(即单位VS产气量)相差不大,反映出体系中底物较为一致,且添加H-190后对体系的稳定性有促进作用。延滞期是反映厌氧消化性能的重要指标[28],TS=4%的系统中添加H-190使得系统的延滞期缩短,说明其有利于反应体系中厌氧微生物的增值和活动,进而提高微生物对底物的转化效率,这与T90变化相一致。
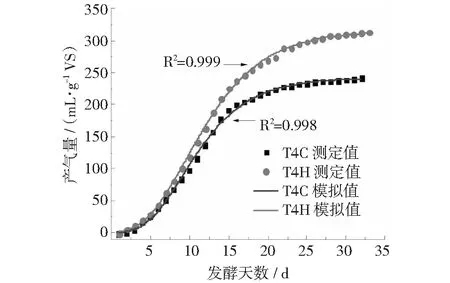
图11 TS为4%时猪粪中温厌氧发酵的VS产气量

图12 TS为8%时猪粪中温厌氧发酵的拟合曲线
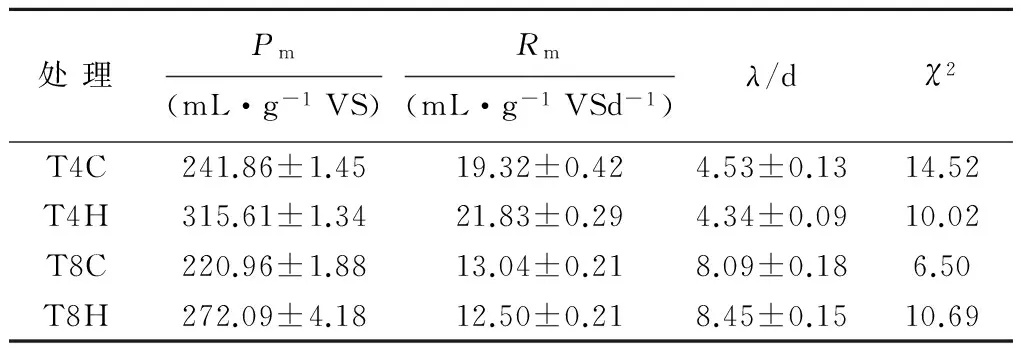
处理Pm(mL·g-1VS)Rm(mL·g-1VSd-1)λ/dχ2T4C241.86±1.4519.32±0.424.53±0.1314.52T4H315.61±1.3421.83±0.294.34±0.0910.02T8C220.96±1.8813.04±0.218.09±0.186.50T8H272.09±4.1812.50±0.218.45±0.1510.69
3 结论
(1)TS=4%的猪粪中温厌氧消化体系中,添加猪粪沼渣水热炭后系统的平均产气量和产甲烷量分别为313.07和191.35 mL·g-1VS,较纯猪粪处理提高了29.81%和26.22%;而TS=8%的体系中,添加猪粪沼渣水热炭后,二者分别为233.59和145.00 mL·g-1VS,较纯猪粪处理提高了12.08%和13.39%。
(2)添加猪粪沼渣水热炭可提高猪粪中温厌氧发酵(TS=4%)的消化效率(T90),缩短厌氧消化的延滞期,但对TS=8%的系统则相反。沼渣水热炭优良的特性是缓解厌氧消化过程中中间代谢物质的抑制、促进微生物间的电子传递、提高猪粪厌氧消化产气和产甲烷的主要原因。
[1] Sun X, Li J, Qiao H, et al. Energy implications of China′s regional development: New insights from multi-regional input-output analysis[J].Applied Energy, 2017, 196: 118-131.
[2] Wang X, Lu X, Yang G, et al. Development process and probable future transformations of rural biogas in China[J].Renewable and Sustainable Energy Reviews, 2016, 55: 703-712.
[3] 国家发改委,农业部.全国农村沼气发展“十三五”规划[Z].2017-02-10.
[4] 中华人民共和国国家统计局.2016年中国统计年鉴[M].北京:中华人民共和国国家统计局, 2014.
[5] 黄泽颖,陈双庆,王济民. 我国养猪户粪污处理问题分析及治理建议——基于四省284个样本的调研[J].畜牧生态,2015,51(10):72-76.
[6] Möller K, Müller T. Effects of anaerobic digestion on digestate nutrient availability and crop growth: A review[J].Engineering in Life Sciences, 2012, 12(3): 242-257.
[7] Fagbohungbe M O, Herbert B M J, Hurst L, et al. The challenges of anaerobic digestion and the role of biochar in optimizing anaerobic digestion[J].Waste Management, 2017, 61: 236-249.
[8] Jin H, Chang Z. Distribution of heavy metal contents and chemical fractions in anaerobically digested manure slurry[J].Applied Biochemistry and Biotechnology, 2011, 164(3): 268-282.
[9] Hvistendahl M. Public health: China takes aim at rampant antibiotics resistance[J].Science, 2012, 336(6083): 795.
[10] Wang X, Yang G, Feng Y, et al. Optimizing feeding composition and carbon-nitrogen ratios for improved methane yield during anaerobic co-digestion of dairy, chicken manure and wheat straw[J].Bioresource Technology, 2012, 120: 78-83.
[11] Banks C J, Zhang Y, Jiang Y, et al. Trace element requirements for stable food waste digestion at elevated ammonia concentrations[J].Bioresource Technology, 2012, 104: 127-135.
[12] Hansen K H, Angelidaki I, Ahring B K. Improving thermophilic anaerobic digestion of swine manure[J].Water Research, 1999, 33 (8): 1805-1810.
[13] Aktas O, Cecen F. Bioregeneration of activated carbon: a review[J].International Biodeterioration and Biodegradation, 2007, 59 (4): 257-272.
[14] Paz-Ferreiro J, Lu H, Fu S, et al. Use of phytoremediation and biochar to remediate heavy metal polluted soils: a review[J].Solid Earth, 2013, 5: 2155-2179.
[15] Donar Y O, Çaglar E, Sinag A. Preparation and characterization of agricultural waste biomass based hydrochars[J].Fuel, 2016, 183: 366-372.
[16] Fang J, Gao B, Chen J, et al. Hydrochars derived from plant biomass under various conditions: Characterization and potential applications and impacts[J].Chemical Engineering Journal, 2015, 267: 253-259.
[17] Gao Y, Wang X, Wang J, et al. Effect of residence time on chemical and structural properties of hydrochar obtained by hydrothermal carbonization of water hyacinth[J].Energy, 2013, 58: 376-383.
[18] 吴艳姣, 李 伟, 吴 琼, 等.水热炭的制备、性质及应用[J].化学进展,2016,(01):121-130.
[19] Mumme J, Srocke F, Heeg K, et al. Use of biochar in anaerobic digestion[J].Bioresource Technology, 2014, 164: 189-197.
[20] Inthapanya S, Preston T, Leng R. Biochar increases biogas production in a batch digester charged with cattle manure[J].Livestock Research for Rural Development, 2012, 24(12): 212.
[21] 许彩云,靳红梅,常志州,等.麦秸生物炭添加对猪粪中温厌氧发酵产气特性的影响[J].农业环境科学学报,2016,35(6):1167-1172.
[22] Luo C, Lü F, Shao L, et al. Application of eco-compatible biochar in anaerobic digestion to relieve acid stress and promote the selective colonization of functional microbes[J].Water Research, 2015, 68: 710-718.
[23] Hoekman S K, Broch A, Robbins C, et al. Hydrothermal carbonization (HTC) of selected woody and herbaceous biomass feedstocks[J].Biomass Conversion and Biorefinery, 2013, 3(2): 113-126.
[24] IUPAC (2015). Reporting Physisorption Data for Gas/Solid Systems with Special Reference to the Determination of Surface Area and Porosity (Recommendations 2015)[R]. International Union of Pure and Applied Chemistry (IUPAC), Zürich, Switzerland.
[25] Abdallah M, Benoliel C, Drider D, et al. Biofilm formation and persistence on abiotic surfaces in the context of food and medical environments[J].Archives of Microbiology, 2014, 196: 453-472.
[26] Chen S, Rotaru A, Shrestha P M, et al. Promoting interspecies electron transfer with biochar[J].Scientific Report, 2014, 4: 5019.
[27] Liu F, Rotaru A E, Shrestha P M, et al. A new model for electron flow during anaerobic digestion: direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane[J].Energy Environmental Science, 2014, 7 (1): 408-415.
[28] 周孟津,张榕林,蔺金印. 沼气实用技术[M].北京:化学工业出版社,2005: 1-15.
[29] Morita M, Malvankar N S, Franks A E, et al. Potential for direct interspecies electron transfer in methanogenic wastewater digester aggregates[J].mBio, 2015, 2(4): e00159-11.
[30] Mao J D, Johnson R L, Lehmann J, et al. Abundant and stable char residues in soils: Implications for soil fertility and carbon sequestration[J].Environment Science Technology, 2012, 46(17): 9571-9576.
[31] Zhao Z, Zhang Y, Woodard T L, et al. Enhancing syntrophic metabolism in up-flow anaerobic sludge blanket reactors with conductive carbon materials[J].Bioresource Technology, 2015, 191: 140-145.
[32] Nevin K P, Richter H, Covalla S F, et al. Power output and columbic efficiencies from biofilms ofGeobactersulfurreducenscomparable to mixed community microbial fuel cells[J].Environmental Microbiology, 2008, 10: 2505-2514.
[33] Mu Y, Zheng X J, Yu H Q, et al. Biological hydrogen production by anaerobic sludge at various temperatures[J].International Journal of Hydrogen Energy, 2006, 31(6): 780-785.

