日粮中添加不同比例的缓释尿素对后备奶牛血液生理指标的影响
张娇娇, 闫 琦, 刘培培, 李珊珊, 田淑云,贾甜华, 王 婷, 李 飞, 王惟惟, 丁路明
(1.兰州大学 生命科学学院,草地农业生态系统国家重点实验室,甘肃 兰州730000;2.兰州大学 草地农业科技学院,草地农业生态系统国家重点实验室,甘肃 兰州730000;3.定西市卫生学校附属医院,甘肃 定西743000)
近年来,随着我国畜牧业产业结构的调整,奶牛业的发展得到极大重视,但是我国奶牛平均产奶量远低于奶牛养殖业发达的国家。而后备牛是成年牛泌乳的基础,是指从出生到第一次分娩前这一阶段的牛,大约持续22~27个月。因为这一时期的后备奶牛没有产出,不能立即带来经济效益,往往得不到重视,但其在奶牛的一生中占有极其重要的作用[1]。如何既降低后备奶牛养殖成本,又保证后备奶牛机体正常生长繁殖,是目前亟待解决的问题。
蛋白质是反刍动物营养的主要限制因素,但豆粕等蛋白饲料价格昂贵,是影响养殖成本的主要因素之一。因此,寻找新型的蛋白质饲料代替品成为养殖业生产中需要解决的首要问题[2]。自从Waesk等[3]于1897年首次报道了反刍动物能将非蛋白氮转化为菌体蛋白,非蛋白氮产品作为蛋白质替代产品已被证明是最直接有效的方式[4-5]。目前,国内外关于非蛋白氮的研究主要集中在非蛋白氮作为蛋白补充饲料的适宜添加比例、日粮中添加非蛋白氮对反刍动物瘤胃环境的影响等方面[6-8],对于血液生理指标与缓释尿素饲喂水平关系的研究报道较少,而血液通过循环系统与全身各组织器官相连,参与机体呼吸、营养和氧气运输、防御病毒侵袭、调节酸碱平衡等各项生理活动,机体的生理病理变化都能在血液的细胞成分和可溶成分中体现,所以本文旨在阐明饲粮中添加不同比例的缓释尿素对后备奶牛血液生理指标的影响。
1 材料与方法
1.1 试验时间与地点
试验于2016年7月3日至10月8日在甘肃省定西市某家畜养殖公司(N35°07'34",E104°59'23",海拔1 899 m)进行,该地区属于中温带半干旱区,年均气温5.7~7.7 ℃,无霜期122~160 d,年均降雨量350~600 mm。
1.2 试验动物及饲养管理
本试验采用单因子随机分组试验设计,选取16头体况良好,体重(322.5±10)kg的10月龄健康荷斯坦后备奶牛,随机分为4组,每组4头,试验牛单槽饲养,自由饮水,按照NRC(2001)推荐的后备奶牛日增重(ADG)800 g营养需求调制配方(表1),饲喂方式为精粗料混合分两次于每日7:00和18:00饲喂。试验用青贮饲料为甘肃省机械研究院提供的海牛品种甜高粱青贮。试验用混合型饲料添加缓释尿素由河北某公司生产。
试验分为两个阶段,预试期20 d,试验期75 d,试验开始前对试验牛及牛舍进行定期驱虫及消毒处理。
1.3 血液及饲料样品的采集与分析
试验期间每两周晨饲前对试验牛尾静脉采集血样。血常规血样采集使用江苏康健医疗用品有限公司生产的抗凝采血管(EDTA-K2),注入血液后立即上下颠倒4~5次,使抗凝剂与血液充分混合,防止凝固,常温放置4 h内进行血常规分析。血常规分析使用全自动血液分析仪(迈瑞BC-3000plus)检测白细胞数目(WBC)、淋巴细胞数目(LYMPH#)、中间细胞数目(Mid#)、中性粒细胞数目(Gran#)、淋巴细胞百分比(LYMPH%)、中间细胞百分比(Mid%)、中性粒细胞百分比(Gran%)、血红蛋白含量(HGB)、红细胞数目(RBC)、红细胞压积(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、红细胞分布宽度变异系数(RDW-CV)、红细胞分布宽度标准差(RDW-SD)、血小板数目(PLT)、平均血小板体积(MPV)、血小板分布宽度(PDW)、血小板压积(PCT)。
试验开始后每两周取饲料样品,饲料营养成分分析参照《饲料分析及饲料质量检测技术》(第二版)[9],使用105 ℃ 烘干法测定干物质(DM)含量;使用ANKOM-2000i型全自动纤维分析仪(美国)测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量;使用JK-9830全自动凯氏定氮仪(济南精密科学仪器仪表有限公司)测定粗蛋白质(CP)含量;使用550 ℃高温灼烧法测定粗灰分(Ash)含量。
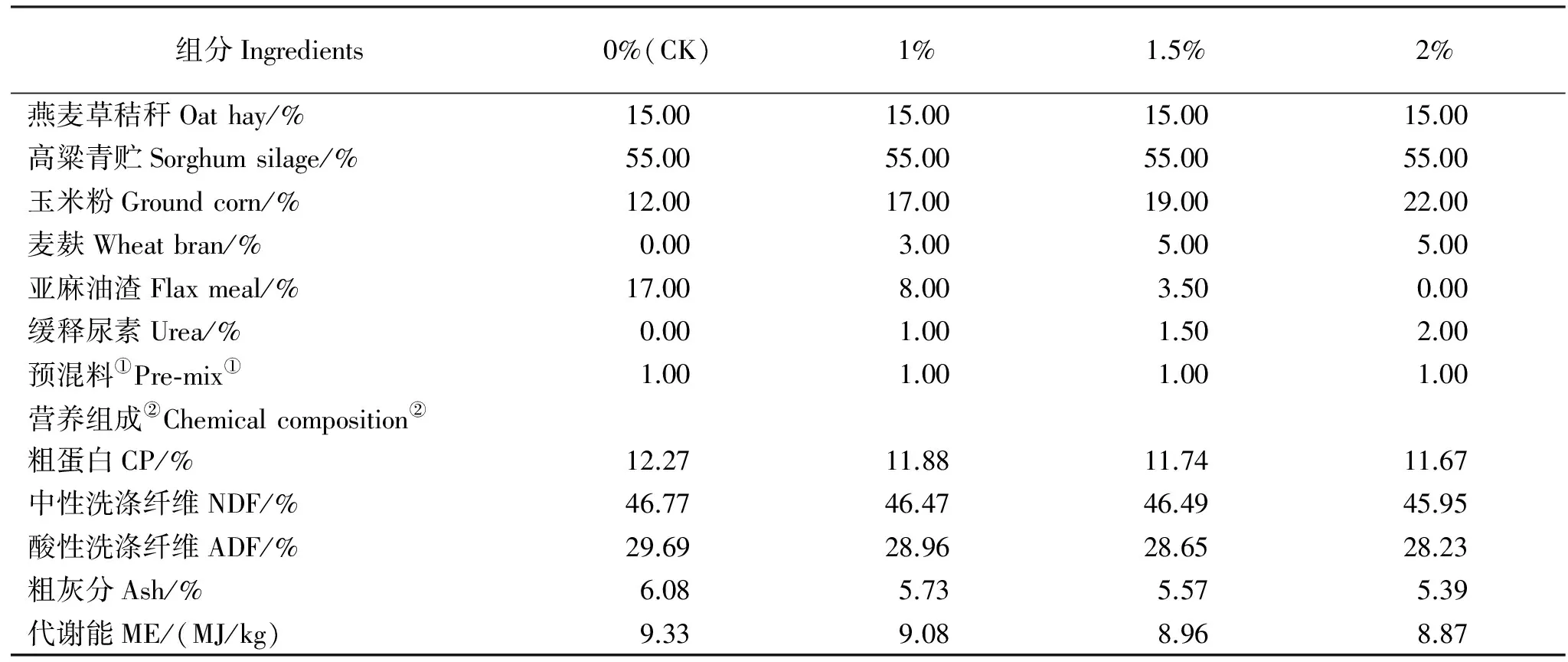
表1 试验饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis)
注:①预混料为每千克饲粮提供:Fe 920 mg, Zn 800 mg, Cu 266 mg, Se 8 mg,I 120 mg, Co 1 mg, VA 110 kIU, VD340 kIU, VE 40 mg, Ca 15 mg,NaCl 8.5 g,P 4.5%.②代谢能为计算值,其余为实测值。
Notes:①Premix provides the following per kilogram of diets:Fe 920 mg, Zn 800 mg, Cu 266 mg, Se 8 mg,I 120 mg, Co 1 mg, VA 110 kIU, VD340 kIU, VE 40 mg, Ca 15 mg,Nacl 8.5 g,P 4.5%;②Nutrient levels were calculated values and others were measured.
1.4 数据分析
本试验结果使用Office 2016版Excel进行饲料营养基础数据处理,使用SPSS 20.0进行ANOVA分析以及Duncan进行之后的多重比较,以P<0.05表示差异显著,结果表示为平均数和均方根误差(SEM)。
2 结果与分析
2.1 白细胞含量
对后备奶牛血常规分析的结果显示,各组之间白细胞数目与温度呈显著正相关(P<0.05)(见表2),即随着试验的进行,后备奶牛白细胞数目增加。由表3知,试验期间各组之间WBC差异不显著(P>0.05)。1.5%添加组的LYMPH#显著高于1%和2%添加组(P<0.05)。2%添加组的LYMPH%显著低于1%组(P<0.05),而0%添加组与各组之间差异不显著(P>0.05)。各组之间的Mid#和Mid%差异不显著(P>0.05)。1%添加组的Gran#显著低于0%、1.5%和2%组(P<0.05)。2%添加组的Gran%显著高于1%和1.5%组(P<0.05),0%添加组与各组之间差异不显著(P>0.05)。
2.2 红细胞含量
各试验组的HGB、MCH与温度呈显著正相关(P<0.05),日粮与HGB呈显著负相关(P<0.05)
(表2)。由表3知,2%添加组的HGB、HCT和RBC显著低于0%、1%、1.5%组(P<0.05),但各组之间MCH差异不显著(P>0.05)。1.5%添加组的MCV显著低于0%和1%组(P<0.05),2%添加组的MCV 显著低于0%组(P<0.05),而与其余各组之间差异不显著(P>0.05)。0%和2%添加组的MCHC显著低于1%和1.5%组(P<0.05)。2%添加组的RDW-CV和RDW-SD显著高于1%和1.5%组(P<0.05),0%添加组与其余各组间差异不显著(P>0.05)。
2.3 血小板含量
1%添加组的PLT显著低于2%组(P<0.05),0%和1.5%添加组与各组之间差异不显著(P>0.05)。0%添加组的MPV显著高于1%和2%组(P<0.01),1.5%添加组的MPV显著低于0%组(P<0.05),而显著高于1%和2%组(P<0.05)。

表2 温度与后备奶牛血常规指标的相关性Table 2 Correlation between temperature and routine blood indexes of dairy heifers
注:* 表示在 0.05 水平(双侧)上显著相关;** 表示在 0.01 水平(双侧)上显著相关。
Notes:* Means significant correlation at the 0.05 level (bilateral); ** Means significant correlation at the 0.01 level (bilateral).

表3 不同缓释尿素添加比例对血常规指标的影响Table 3 Effects of different slow-release urea ratio on the blood index
1%添加组的PDW和PCT显著低于2%组(P<0.05),而0%和1.5%添加组与各组之间差异不显著(P>0.05)(表3)。
3 讨 论
WBC是一类免疫细胞的总称,包括单核细胞、中性粒细胞、嗜酸性粒细胞和淋巴细胞,与动物机体抗感染免疫密切相关[10-11],是血液中重要的有形成分,对于维持正常的血液循环有重要意义,与机体的抗寒能力密不可分。本试验结果显示,各试验组WBC都有随时间增加的趋势,这可能与试验期间试验地气温降低有关(图1)。尹旭辉等[12]的研究表明,寒冷会使动物机体血液浓缩,白细胞数量增加。此外,试验各组间WBC虽未达到统计学上的显著性,但随缓释尿素添加比例升高呈现先升高后降低的趋势,其中2%添加组WBC最低,这与2%添加组氮的利用率有关,因为蛋白质是合成抗体白细胞、T淋巴细胞、干扰素的主要成分,蛋白摄入不足会导致其合成障碍。

图1 试验期间试验地温度变化Fig.1 Temperature variation during the test
RBC、HGB和HCT能够反映动物机体血液运输O2和CO2的能力[13]。Blanco等[14]研究表明,动物血液中HGB和HCT随着蛋白质摄入量的减少而降低;Hall等[15]指出,后备奶牛血清尿素氮随饲粮氮水平提高而升高,刁其玉[16]指出,8~10月龄的后备牛瘤胃液铵态氮浓度随着日粮氮水平升高而显著升高,而赵丽莉等[17]发现,瘤胃微生物只能利用1/4的氨合成菌体蛋白,其余的来不及利用就被瘤胃壁吸收进入肝脏循环后,大部分随尿液排出体外。本试验结果显示,2%缓释尿素添加组具有较低的RBC、HGB和HCT水平,表明2%添加组具有较低的O2和CO2运输能力。产生这种现象的原因是2%缓释尿素添加组中缓释尿素占饲粮总氮的比例较大,在瘤胃中释放较多的氨,而过多的氨来不及被瘤胃微生物利用,就被瘤胃壁吸收进入血液参与肝脏循环后,随尿液排出体外,从而导致2%添加组氮的摄入量不足,蛋白质合成受限,而蛋白质是红细胞的载体,其缺乏会影响造血功能,使血液RBC、HGB和HCT指标降低,从而导致O2和CO2运输能力降低。
MCH、MCHC、RDW和MCV分别反映了红细胞的色素含量、色素饱满度、变异程度和体积大小。MCH、MCV和MCHC被称为贫血三项, 较低的MCH、MCV和MCHC和较高的RDW常作为贫血类型鉴定的重要指标。本试验中,2%添加组具有较低的MCV和MCHC水平,可能为缺铁性贫血的症状[18],可以作为后备牛贫血鉴定的参考依据。RDW-CV作为反映外周血红细胞体积异质性的参数,可反映红细胞体积大小的变异性,临床上RDW-CV和RDW-SD均表示红细胞体积的离散程度[19]。本试验结果中2%组红细胞体积具有较大的离散宽度,说明血管壁对红细胞造成了挤压和破坏,产生这种现象的机制可能是血液中较低的HGB、RBC和HCT指标使内皮细胞处于缺氧状态进而导致红细胞异常增大,使血红蛋白代偿性增加,增加载氧能力,大体积的红细胞在通过血管时受到血管壁的挤压和破坏[15]。2%添加组后备牛出现缺铁性贫血的原因是缓释尿素代替了日粮中较大比例的天然蛋白,却不能提供天然蛋白中的P(磷)、S(硫)、Fe(铁)、Zn(锌)、Cu(铜)、B(硼)、Mn(锰)、I(碘)、Mo(钼)等矿质元素,而这些矿质元素的缺乏会引起蛋白质结构和功能的障碍,所以较大的缓释尿素添加比例引起了后备奶牛缺铁性贫血,而适当比例的缓释尿素添加(1%~1.5%)不但能提高后备奶牛氮的利用效率,且不会影响后备奶牛的身体健康。
PLT是哺乳动物血液中重要的有形成分之一,其在止血、伤口愈合、炎症反应、血栓形成及器官移植排斥等生理和病理过程中有重要作用。血小板增多症常见于急慢性炎症,缺铁性贫血及癌症患者。冯嗣等青[20]的研究报道称缺铁贫血会导致血小板数目增多,本试验结果中2%组具有较高的血小板水平,可能为后备奶牛缺铁性贫血的症状,而0%、1%和1.5%缓释尿素添加组并未表现出缺铁性贫血的症状,与上文所述结果一致。
4 结 论
本试验结果表明,对10月龄荷斯坦后备奶牛饲喂缓释尿素添加比例为2%的日粮会导致后备奶牛因日粮缺乏天然蛋白质中的矿质元素而产生蛋白质合成及功能障碍,引起后备奶牛发生缺铁性贫血。而当缓释尿素的添加比例为1%和1.5%时,其血常规各项指标均正常。因此,后备奶牛日粮中2%的缓释尿素添加比例会影响后备奶牛的健康,而当缓释尿素添加比例为1%~1.5%时不会对后备奶牛的健康造成不良影响。
[1] 张卫兵.蛋白能量比对不同生理阶段后备奶牛生长发育和营养物质消化的影响[D].北京: 中国农业科学院,2009.
[2] 徐作明,夏科,郗伟斌.反刍动物非蛋白氮研究进展[J].养殖与饲料,2009(3):59-61.
[3] 薛白,焦浩鹏,赵新全,等. 矿物质缓释尿素对牦牛瘤胃发酵和血液参数的影响[C]//中国畜牧业协会牛业分会.第五届中国牛业发展大会论文集,2010.
[4] BRYANT M P,ROBINSON I M.Studies on the nitrogen requirements of some ruminal cellulolytic bacteria[J].Applied Microbiology,1961,9(2):96-103.
[5] TAMMINGA S.A review on environmental impacts of nutritional strategies in ruminants[J]. Journal of Animal Science,1996,74(12):3 112-3 124.
[6]EMMANUEL N, PATIL N V, BHAGWAT S R, et al. Effects of different levels of urea supplementation on nutrient intake and growth performance in growing camels fed roughage based complete pellet diets[J]. Animal Nutrition, 2015, 1(4):356-361.
[7] 王宁娟. 人工瘤胃法研究矿物质元素及非蛋白氮对瘤胃发酵的影响[D].陕西杨陵:西北农林科技大学, 2003.
[8] DING L M, LASCANO G J, HEINRICHS A J. Effect of precision feeding high- and low-quality forage with different rumen protein degradability levels on nutrient utilization by dairy heifers. [J]. Journal of Animal Science, 2015, 93(6):3 066-3 075.
[9] 张丽英.饲料分析及饲料质量检测技术[M].2版.北京:中国农业大学出版社,2003.
[10] 付晓平,李嘉彬.猪瘟患猪白细胞与血小板的变化规律[J].中国畜牧兽医文摘,2016,32(4):46-47.
[11] 赵宗胜,米拉,古丽,等.冷、热应激对奶牛血液生理生化指标影响[J].中国奶牛, 2011(22): 18-22.
[12] 尹旭辉,蒋品,杨成君,等.低体温对大鼠血液有形成分的影响[J].职业与健康,2008, 24(15):1 518-1 519.
[13] 伊平昌,顾冬花.大通县高原型牦牛12项血液指标的测定[J].四川畜牧兽医,2014,41(2): 29-30.
[14] BLANCO M, CASASS I, PALACIO J. Effect of age at weaning on the physiological stress response and temperament of two beef cattle breeds[J].Animal,2009,3(1): 108-117.
[15] HALL J B, STAIGMILLER R B, BELLOWS R A, et al. Body composition and metabolic profiles associated with pubertyin beef heifers. The Journal of Animal Science ,1995,73(11):3 409-3 420.
[16] 刁其玉.后备牛蛋白质营养需要研究进展[J].饲料工业,2010(S2):15-19.
[17] 赵丽莉,李耀忠,杨丽琴.缓释尿素对滩母羊血清中尿素浓度的影响[J].农业科学研究, 2007,28(3):24-25.
[18] 康云平,孙宝云.平均红细胞血红蛋白浓度对溶血性贫血的诊断价值[J].疾病监测,2008, 23(6):368-369.
[19] 王欢,胡元会,耿彦婷,等.基于动脉硬化检测仪测定的动脉硬化与红细胞参数的相关性[J].中国动脉硬化杂志, 2016, 24(3):277-280.
[20] 冯嗣青,吴骁,杨光. 缺铁性贫血伴血小板减少的原因分析[C]//浙江省科学技术协会.2012年浙江省血液病学年会论文集,2012.

