HCG注射日血清孕酮水平与取卵周期移植单胎妊娠产科结局的相关性
马媛媛 魏瑗 赵扬玉
为了提高患者的临床妊娠率,大多数人工受精-胚胎移植(in vitro fertilization and embro transfer,IVF-ET)/卵细胞质内单精子注射(intracytoplasmic sperm injection,ICSI)都需要进行控制性超促排卵(controlled ovarian hyperstimulation,COH)。COH中多个卵泡发育,人绒毛膜促性腺素(human chorionic gonadotrophin,HCG)注射日血清孕酮升高。而血清孕酮升高会导致妊娠率下降。血清孕酮升高,子宫内膜基因表达异常,血管内皮生长因子(vascular endothelial cell growth factor ,VEGF)升高[1],VEGF和子痫前期、胎盘植入发生有相关性[2],且孕激素调控滋养细胞浸润[3],推测血清孕酮升高可能与子痫前期、胎盘植入不良产科结局发生有关。目前尚未查阅到HCG血清孕酮与产科结局相关性研究的文献。本文通过回顾性分析2008年1月—2016年6月于我院接受取卵周期移植并分娩的634例单胎孕妇病例资料,探讨血清孕酮与子痫前期、胎盘植入的相关性,为临床咨询及决策提供有价值的依据。
对象与方法
1.对象:2008年1月—2016年6月于我院生殖中心接受取卵周期移植,并在我院分娩的单胎孕妇。入组标准:(1)均为促排卵治疗,且为取卵周期常规IVF或单精子卵胞浆内注射(ICSI) 助孕治疗;(2)我院规律产检;(3)分娩孕周≥28周;(4)新生儿均为活产。排除标准:(1)孕期使用阿司匹林、低分子肝素等抗凝药物;(2)孕期应用雌激素、中晚孕期应用孕激素;(3)基础卵泡刺激素(follicle-stimulating hormone,FSH)≥10 IU/L;(4)慢性高血压;(5)HCG注射日血清孕酮、雌二醇、黄体生成素(luteinizing hormone,LH)及FSH病例资料不全的病例。符合纳入标准的单胎孕妇634例。将研究对象按照是否发生不良产科结局,分为病例组和对照组。不良产科结局包括子痫前期和胎盘植入。
2.观察指标的定义:(1)子痫前期:诊断标准依据中华医学会妇产科分会妊娠期高血压疾病学组2015年颁布的《妊娠期高血压疾病诊治指南》。(2)胎盘植入:胎盘组织对子宫肌层的异常附着或侵袭[4],在产妇孕期和分娩期通过影像学和临床以及病理结果进行诊断。(3)不孕类型:包括原发不孕和继发不孕。(4)受孕方式:新鲜周期常规IVF-ET或ICSI。(5)产后出血:胎儿娩出后24小时内失血量超过500 ml,剖宫产时超过1000 ml。
3.血清激素水平的测定:患者在HCG注射日上午抽静脉血4 ml ,并于当日采用全自动化学发光免疫分析仪(美国西门子IMMULITE 2000)检测激素水平。变异系数分别为雌二醇<8% ,孕酮< 11%,LH<8%。
结果
1.血清孕酮与单胎子痫前期的相关性单因素分析
634例单胎孕妇中,发生子痫前期24例和非子痫前期610例。单因素分析两组HCG日血清孕酮、雌二醇、LH及基础FSH、孕妇年龄、孕妇孕前BMI、不孕类型、受孕方式、产次均无统计学差异,不孕年限子痫前期组低于对照组,差异有统计学意义 (见表1)。

表1 单胎子痫前期的单因素分析
注:两组比较,*P<0.05
2.血清孕酮与单胎子痫前期的相关性多因素分析
单因素分析中有意义的自变量包括不孕年限。以血清孕酮、雌二醇、BMI、不孕年限为自变量,以子痫前期为因变量,采用Logistic回归分析,结果血清孕酮与子痫前期发病无统计学意义的关联(见表2)。
3.血清孕酮与单胎胎盘植入的相关性单因素分析
634例单胎孕妇中,发生胎盘植入29例和非胎盘植入605例。单因素分析中胎盘植入组孕酮、雌二醇较对照组均高(P=0.007,P=0.038),胎盘植入组产后出血的比例较对照组高(P=0.027)。两组HCG日血清LH及基础FSH、孕妇年龄、不孕类型、受孕方式、孕次、产次均无统计学差异(见表3)。
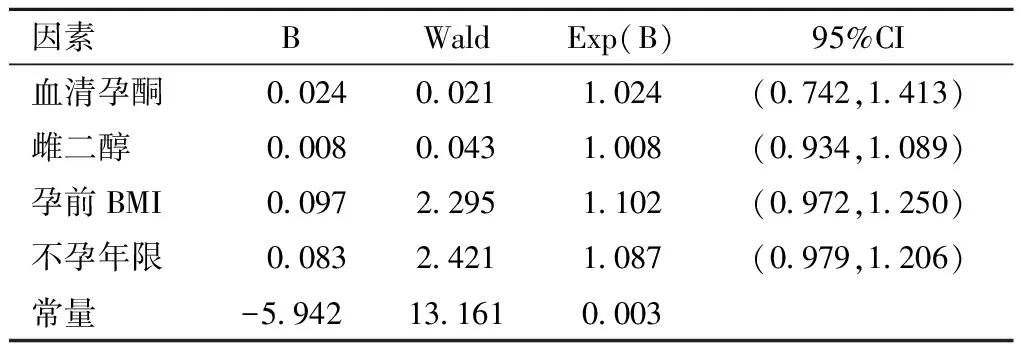
表2 单胎子痫前期危险因素的Logistic回归分析

表3 单胎胎盘植入的单因素分析
注:两组比较,*P<0.05
4.血清孕酮与单胎胎盘植入的相关性多因素分析
单因素分析中有意义的自变量包括雌二醇、孕酮。赋值各变量:胎盘植入,有=1,无=0;产次,>1 =1,<1 =0。以产次、雌二醇、孕酮为自变量,以胎盘植入为因变量。采用Logistic回归分析,结果仅孕酮和胎盘植入有统计学意义的关联(OR=1.397,95%CI 1.093~1.784)(见表4)。
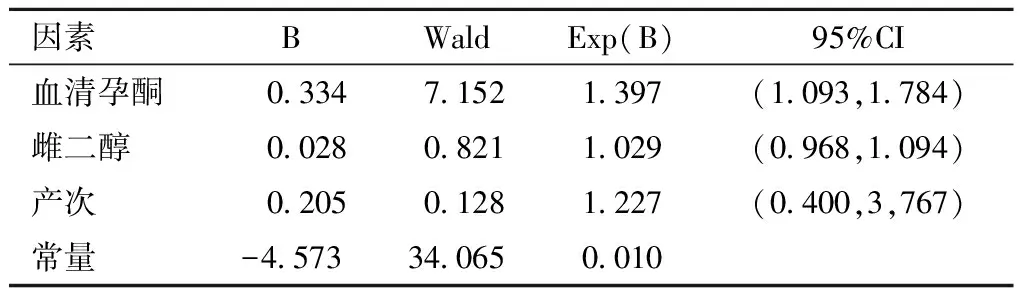
表4 单胎胎盘植入危险因素的Logistic回归分析
讨论
胎盘植入的概念最早在1937由Irving和Hertig提出[4],指产后胎盘完全或部分异常粘连于子宫壁,即胎盘组织对子宫肌层的异常附着或侵袭[4]。胎盘植入是孕期严重并发症,可导致产时大出血、失血性休克、产后出血、子宫切除等,严重威胁孕产妇生命健康,是产科医师面临的棘手问题,本研究中胎盘植入产后出血的比例高于对照组。胎盘植入的具体发病机制尚未明确。各种创伤性操作等导致的蜕膜原发性或继发性缺陷、滋养细胞过度浸润以及子宫胎盘新生血管的异常形成,均可导致胎盘植入的发生。胎盘植入并不仅仅发生于剖宫产后,有时候发生于子宫的一些小创伤后,如:宫腔镜手术史、刮宫等。不孕症患者多有宫腔镜检查、子宫内膜活检等宫腔操作史,有胎盘植入发生的高危因素,本研究中胎盘植入组其中3例患者有宫腔镜子宫内膜息肉切除病史,26例孕前行子宫内膜活检。29例胎盘植入中粘连型27例,植入型2例;本研究中粘连型胎盘植入因分娩前影像学不典型,均依据阴道分娩或剖宫产过程中胎盘剥离困难、手取胎盘诊断;植入型胎盘植入均依据病理诊断。本研究单因素分析中单胎孕妇胎盘植入组孕酮较非胎盘植入组高。胎盘植入组雌二醇较对照组高。雌二醇抑制滋养细胞浸润[5]。多因素分析仅孕酮与胎盘植入有统计学意义的关联(OR=1.397)。提示在单胎妊娠中,孕酮升高,胎盘植入发生风险增高。
本研究中孕酮升高,胎盘植入发病率增加,推测可能的发生机制如下。孕激素通过促进VEGF的表达调控子宫胎盘血管的形成,调控滋养细胞浸润。VEGF是一种强血管生成刺激因子,主要表达于胎盘组织的滋养细胞中,妊娠早期可参与胎盘血管网的形成、妊娠晚期调节血管内皮细胞通透性、并能影响滋养细胞的分化和浸润。Boroujeni等[6]研究发现经孕激素处理的大鼠VEGF基因表达最高,推测孕激素可能调控VEGF的分泌。Nikolettos[1]等研究发现ICSI助孕孕酮>0.9 ng/ml (2.86 nmol/L)的患者血清VEGF水平更高。
胎盘植入患者VEGF表达增加。Tseng[7]等研究发现胎盘植入患者的胎盘溶解物中VEGF表达较对照组显著增高。颜建英等[2]检测胎盘植入、前置胎盘和无并发症孕妇胎盘组织的VEGF表达,研究发现胎盘植入和前置胎盘组VEGF及其mRNA表达水平均高于无并发症组。该研究同时指出胎盘植入组中正常部位、交界部位及胎盘植入部位的胎盘组织中VEGF mRNA表达水平依次递增,表明VEGF表达水平增高可能与滋养细胞侵袭能力增强有关,促进胎盘滋养细胞的过度入侵,促进胎盘植入的发生和发展。Chantraine等[8]利用高分辨率的虚拟成像及计算机辅助成像观察胎盘植入患者母胎界面的血管结构,认为子宫肌层和胎盘交界处大量小血管的形成可能是由于大量入侵的绒毛外滋养细胞产生的VEGF所致。综合以上研究,推测孕酮升高,VEGF表达增加,血管网形成增加,促进滋养细胞浸润,胎盘植入发病率增加。
本研究单因素分析及多因素分析后,孕酮与单胎子痫前期发病均无统计学意义关联。辅助生殖高性激素环境影响子宫内膜和胚胎,影响滋养细胞浸润,HCG注射日血清孕酮升高,子宫内膜容受性下降,后期胎盘发育不良,胎盘通过表观遗传学进行代偿。若未能成功代偿,可能导致不良妊娠结局,如流产、子痫前期和胎儿宫内生长受限。大多数情况,胎盘成功代偿,妊娠可以正常进展[9]。HCG注射日高孕激素环境下,胎盘有可能通过表观遗传机制成功代偿,而不发生子痫前期。
Kim等[10]研究发现和正常妊娠孕妇相比,子痫前期患者胎盘VEGF表达下降。从子痫前期和胎盘植入的发病机制来看,子痫前期是滋养细胞浅浸润,而胎盘植入为滋养细胞过度浸润。该研究中孕酮升高,胎盘植入发病风险增加。并且理论上,孕激素可通过上调VEGF表达,促进滋养细胞浸润,降低子痫前期发病率。但该研究中孕酮与子痫前期并没有相关性,可能由于子痫前期发病机制复杂多样,尚不能完全明确子痫前期的发病因素,无法单纯从某一方面来解释子痫前期的发病。
综上所述,新鲜周期辅助生殖中HCG注射日孕酮升高,胎盘植入发生风险增加;而孕酮与子痫前期发生无相关性。为了改善辅助生殖助孕孕妇的产科结局,临床可通过提前注射HCG、使用温和刺激拮抗剂方案等措施预防HCG注射日血清孕酮升高。该研究为单中心回顾性研究,HCG注射日血清孕酮与胎盘植入、子痫前期的相关性仍需要前瞻性、多中心的随机对照研究进一步证实。
1 Nikolettos N,Asimakopoulos B,Koster F,et al.Cytokine profile in cases with premature elevation of progesterone serum concentrations during ovarian stimulation.Physiol Res,2008,57:215-224.
2 颜建英,吴新枝,张勤建.血管内皮生长因子和胎盘微血管密度与胎盘植入发病的关系.中华围产医学杂志,2016,19:608-613.
3 Schindler AE.Present and future aspects of dydrogesterone in prevention or treatment of pregnancy disorders:an outlook.Horm Mol Biol Clin Investig,2016,27:49-53.
4 Irving C,Hertig AT.A study of placenta accreta.Surg Gynecol Obstet,1937,64:178-200.
5 Albrecht ED,Bonagura TW,Burleigh DW,et al.Suppression of extravillous trophoblast invasion of uterine spiral arteries by estrogen during early baboon pregnancy.Placenta,2006,27:483-490.
6 Boroujeni MB,Boroujeni NB,Gholami M.The effect of progesterone treatment after ovarian induction on endometrial VEGF gene expression and its receptors in mice at pre-implantation time.Iran J Basic Med Sci,2016,19:252-257.
7 Tseng JJ,Chou MM.Differential expression of growth-,angiogenesis- and invasion-related factors in the development of placenta accreta.Taiwan J Obstet Gynecol,2006,45:100-106.
8 Chantraine F,Blacher S,Berndt S,et al.Abnormal vascular architecture at the placental-maternal interface in placenta increta.Am J Obstet Gynecol,2012,207:181-188.
9 Choux C,Carmignac V,Bruno C,et al.The placenta:phenotypic and epigenetic modifications induced by Assisted Reproductive Technologies throughout pregnancy.Clin Epigenetics,2015,7:87.
10 Kim SC,Park MJ,Joo BS,et al.Decreased expressions of vascular endothelial growth factor and visfatin in the placental bed of pregnancies complicated by preeclampsia.J Obstet Gynaecol Res,2012,38:665-673.

