微量采血法较常规采血法的技术与优势
吴筱琴,钟 声,孙 锴,黄孙峰,张 怡,欣 坚,崔 立
(1.上海交通大学农业与生物学院,上海 200240; 2.上海罗氏创新中心,上海 201203)
小鼠体型小,生长繁殖快,成本低,易于操作和控制,是医学实验尤其是药代动力学实验常用动物。在各种动物实验研究中,为了评价药物、新化合物等的药理学、药物代谢动力学特征,常在一定时间内多次采集动物血液[1]。目前,小鼠常用的采血方法有眼眶后静脉丛采血法,眼球摘除采血法,心脏采血法,尾静脉采血法等[2]。据研究报道,采血本身会引起动物应激,某些采血方法甚至会引起动物局部组织的严重损伤甚至是动物死亡[3-4]。其中,小鼠眼眶后静脉丛采血是目前最常用的小鼠连续多次采血方法[5],其采血量可满足药代、药效等常用指标的分析。但在实际应用中,眼眶静脉丛采血会造成动物眼睛局部的严重损伤、甚至是失明,采血过程中动物表现明显痛苦,需要麻醉,且所需动物数量较大、采血量较多,因此该采血方法不完全符合动物福利3R原则。近年来,生物分析仪器灵敏度有大幅提高。以本实验使用的三重四极杆质谱灵敏度为例,Triple Quad 5500比API 4000灵敏度提到了5~10倍。这就从技术上实现了能够支持微量血液样品的生物分析[6]。但目前,以微量采血进行生物分析及药代动力学研究国内尚未见报道。而在这一研究领域,于小鼠后肢隐静脉采血国内外均未见报道。本研究首次建立了小鼠后肢隐静脉微量采血的新方法。该方法所需动物数量显著减少,同时动物表现痛苦小,无需麻醉,对动物局部组织的损伤较小,并可重复采血,采血量小。与常规眼眶后静脉丛采血法比较,所获得的主要药代动力学参数一致,无明显差异。因此在小鼠药代动力学实验中隐静脉微量采血法完全可以替代现有的常规眼眶后静脉丛采血法,且更加符合动物福利3R原则。
1 材料和方法
1.1 实验动物
SPF级雄性CD-1小鼠92只,6~8周龄,体重20~25 g;由上海斯莱克实验动物有限责任公司提供[SCXK (沪) 2012-0002]。本实验在上海美迪西生物医药有限公司SPF动物房进行[SYXK (沪) 2015-0026],动物房恒温恒湿(温度21℃~23℃,湿度40%~60%),光照时间8:00~20:00。实验开始前,小鼠在动物房中适应至少5 d。本实验由上海罗氏创新中心实验动物使用与管理委员会批准号:RICS-20150921。
1.2 主要试剂与仪器
给药溶液的配置:静脉注射溶液由5%(w/v)二甲基亚砜(DMSO)、40%(w/v)聚乙二醇(PEG 400)和55%(w/v)生理盐水配制;口服溶液由2%(w/v)羟丙基纤维素、0.1%(w/v)聚山梨醇酯(polysorbate 80)和0.1%(w/v)对羟基苯甲酸甲酯的水溶液配制;色谱级乙腈、甲醇:Thermo Fisher公司;实验所用其他试剂纯度均为色谱级别。
麻醉机:Matrx公司,型号91805060;超高效液相色谱仪(UPLC-MS/MS):Shimadzu公司,型号Nexera LC System;三重四级杆质谱仪:AB SCIEX公司,型号5500;Chromolith FastGradient RP-18 Endcapp(50×2.0 mm)色谱柱:默克公司;离心机:梅特勒公司,型号5424,Beckman公司,型号Allegra 64R;电子天平:梅特勒公司,型号XP205DR;微量采血毛细管:Sarstedt Ag & Co.公司,型号Minivette POCT;灭菌注射针及注射器:上海米沙瓦公司,型号4.5和6号;一次性抗凝管及一次性血样采集针:江苏康健公司;酒精棉球等。
1.3 实验方法
1.3.1 小鼠药代动力学实验设计
将92只CD-1小鼠分别随机编号并称重,分为16组。分别单次给予静脉注射(intravenous injection,IV)1 mg/kg以及口服灌胃(oral gavage,PO)10 mg/kg的模型化合物A、B、C、D。
① 常规眼眶后静脉丛采血法:静脉注射每组9只动物,口服灌胃每组8只动物;
② 后肢隐静脉微量采血法:静脉注射、口服灌胃每组均3只动物。具体实验设计见表1。
1.3.2 采血时间点
静脉给药组:于给药后5 min、15 min、30 min、1 h、2 h、4 h、7 h、24 h采集样品,共8个时间点。
口服给药组:于给药后15 min、30 min、1 h、2 h、4 h、7 h、24 h采集样品,共7个时间点。
对于常规眼眶后静脉丛采血法,因采血量较大(每只各时间点150 μL),对动物进行间隔采血,每个时间点采用3只动物,每只动物最多采集不超过3次,具体采血安排见表2。
对于隐静脉微量采血法,采血量小(每只各时间点30 μL),在全部3只动物中采集所有时间点的样品。

表2 动物间隔采血安排Tab.2 Time points of blood collection
注:“√”为该采血点所使用动物。
Note. “√” indicates the animals for blood collection at that time point.
1.3.3 采血方法
(1)常规眼眶后静脉丛采血法:将小鼠放入异氟烷麻醉箱进行吸入麻醉后,左手抓紧小鼠颈部皮肤固定头部,并轻轻向下压迫颈部两侧,以突出小鼠眼球并使眼球充血,右手用事先准备好的一次性血样采集针针头顶端(针尖斜面朝内)垂直插入外眦,见针管有血液后,保持此位置连接离心管,血液便会连续不断地滴入,当血液量达到150 μL时拔出采集针立即用灭菌干棉球压迫止血。
(2)隐静脉微量采血法:小鼠无需麻醉,实验前先将小鼠后肢部位剃毛,将小鼠放入合适的固定器中,露出后肢,酒精棉球擦拭采血部位消毒后,将灭菌注射针头迅速刺入后肢隐静脉,血液流出,用微量采血毛细管收集30 μL血液于离心管中。采血结束,立即用灭菌干棉球压迫止血。
1.3.4 小鼠疼痛评估
小鼠在隐静脉微量采血过程中,根据国际NC3RS“小鼠痛苦表情评分”及遵循AAALAC《实验动物饲养管理和使用指南(第八版)》,通过观察小鼠的表情、外貌表现(被毛、理毛行为、眼睛、躯干体姿、呼吸)、饮食和排泄、行为(合群情况、运动、性格、声音)及临床症状(心血管系统、呼吸系统、消化系统、神经系统)评估和判定小鼠的疼痛程度。此评估仅适用于清醒动物,因常规眼眶后静脉丛采血法动物表现明显痛苦,实施麻醉,未进行疼痛评分。
1.3.5 血浆样品处理
(1)常规采血法血浆样品处理:取小鼠血浆样品20 μL,加入60 μL冰乙腈进行1∶4(v/v)蛋白沉淀,涡旋使其充分混合后在4℃条件下以12 000 r/min转速离心10 min后,取上清液进样到AB Sciex Triple Quad 5500 MS/MS系统使用电喷雾离子化模式进行分析。进样体积均为2 μL。
(2)微量采血法血浆样品处理:取小鼠血浆样品5 μL,加入95 μL冰乙腈进行1∶20(v/v)蛋白沉淀,涡旋使其充分混合后在4℃条件下以12 000 r/min转速离心10 min后,取上清液进样到AB Sciex Triple Quad 5500 MS/MS系统使用电喷雾离子化模式进行分析。进样体积均为1 μL。
1.4 数据处理
通过Phoenix软件计算主要药代动力学参数,包括AUC(药时曲线下面积)、t1/2z(消除半衰期)、Cmax(峰浓度)、Tmax(达峰时间)、MRT(平均驻留时间)、CLz(清除率)和Vz(分布容积)。
2 结果
在采血过程中,通过对比NC3RS的“小鼠痛苦表情评分”以及AAALAC《实验动物饲养管理和使用指南(第八版)》,小鼠表现均为正常(所有评分项目为“0”-正常),表明的确将动物损伤降至了最低。对于A、B、C、D四种化合物在小鼠中分别单次给药,采用两种采血方法计算所得的主要药代动力学参数见表3~6,药时曲线见图1~4。结果表明,与常规眼眶后静脉丛采血法相比,采用隐静脉微量采血所获得的主要药代动力学参数一致,无明显差异。因此在小鼠药代动力学实验中隐静脉微量采血法完全可以替代现有的常规眼眶后静脉丛采血法。

表3 小鼠单次给予静脉注射及口服灌胃模型化合物A后微量和常规采血方法的主要药代动力学参数Tab.3 Pharmacokinetics parameters of compound A in the CD-1 mice following an intravenous injection or gastric gavage
注:*表示不适用。下同。
Note.*indicates not applicable (NA). The same below.
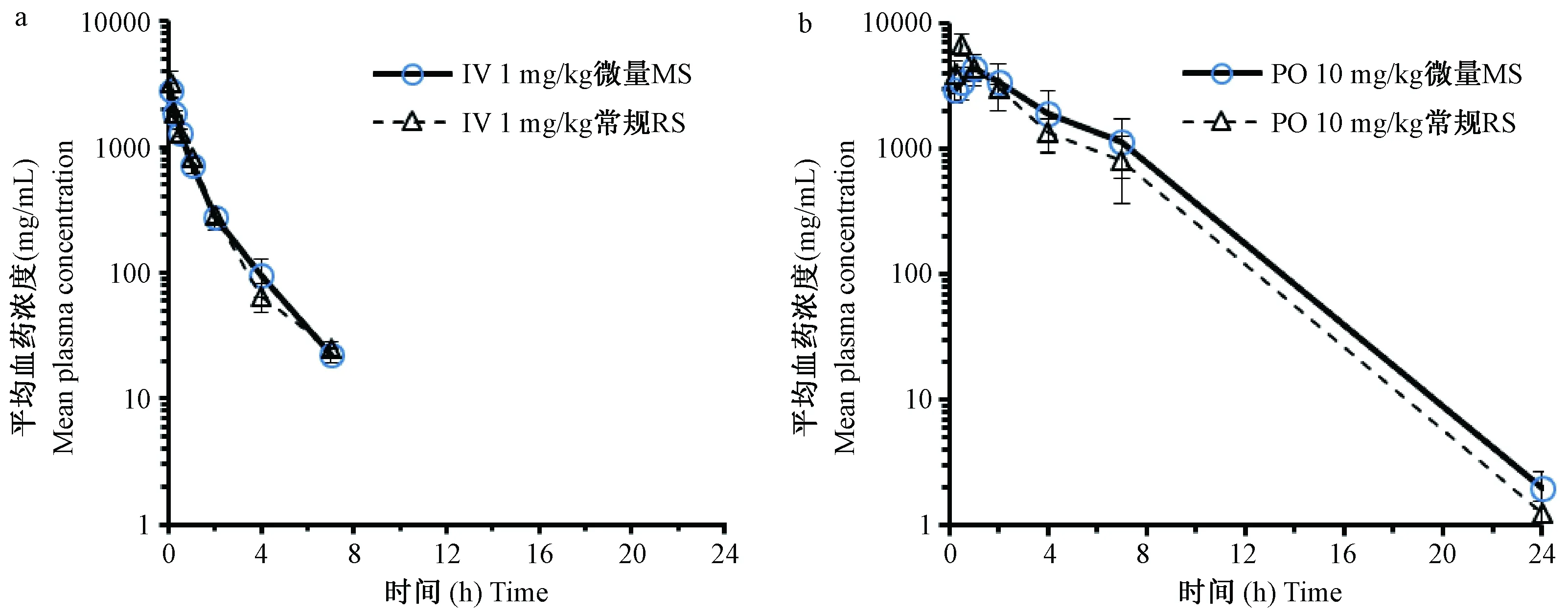
注:a:小鼠单次给予静脉注射1 mg/kg模型化合物;b:小鼠单次给予口服灌胃10 mg/kg模型化合物。下同。图1 微量和常规采血法测得模型化合物A的平均药时曲线Note. a: Mouse intravenous injection of 1 mg/kg of model compound each time. b: Mouse oral gavage of 10 mg/kg of model compound each time. The same below.Fig.1 Comparison of mean plasma concentration-time curves of model compound A in mice by regular blood sampling or micro-sampling method
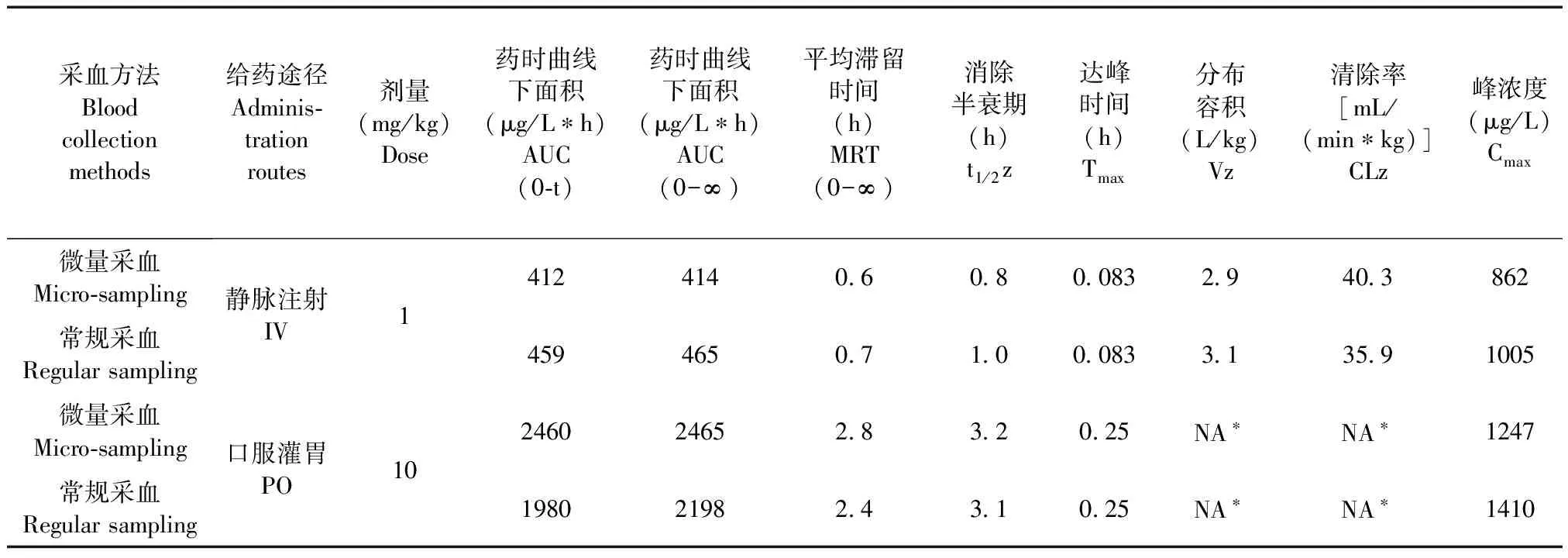
采血方法Bloodcollectionmethods给药途径Adminis⁃trationroutes剂量(mg/kg)Dose药时曲线下面积(μg/L∗h)AUC(0⁃t)药时曲线下面积(μg/L∗h)AUC(0-∞)平均滞留时间(h)MRT(0-∞)消除半衰期(h)t1/2z达峰时间(h)Tmax分布容积(L/kg)Vz清除率[mL/(min∗kg)]CLz峰浓度(μg/L)Cmax微量采血Micro⁃sampling常规采血Regularsampling静脉注射IV1412414060800832940386245946507100083313591005微量采血Micro⁃sampling常规采血Regularsampling口服灌胃PO10246024652832025NA∗NA∗1247198021982431025NA∗NA∗1410

图2 微量和常规采血法测得模型化合物B的平均药时曲线Fig.2 Comparison of mean plasma concentration-time curves of model compound B in mice by regular blood sampling or micro-sampling method

采血方法Bloodcollectionmethods给药途径Adminis⁃trationroutes剂量(mg/kg)Dose药时曲线下面积(μg/L∗h)AUC(0⁃t)药时曲线下面积(μg/L∗h)AUC(0-∞)平均滞留时间(h)MRT(0-∞)消除半衰期(h)t1/2z达峰时间(h)Tmax分布容积(L/kg)Vz清除率[mL/(min∗kg)]CLz峰浓度(μg/L)Cmax微量采血Micro⁃sampling常规采血Regularsampling静脉注射IV116917706050083419412991421580707008365106259微量采血Micro⁃sampling常规采血Regularsampling口服灌胃PO10132147171205NA∗NA∗79496122412805NA∗NA∗432

图3 微量和常规采血法测得模型化合物C的平均药时曲线Fig.3 Comparison of mean plasma concentration-time curves of model compound C in mice by regular sampling or micro-sampling method
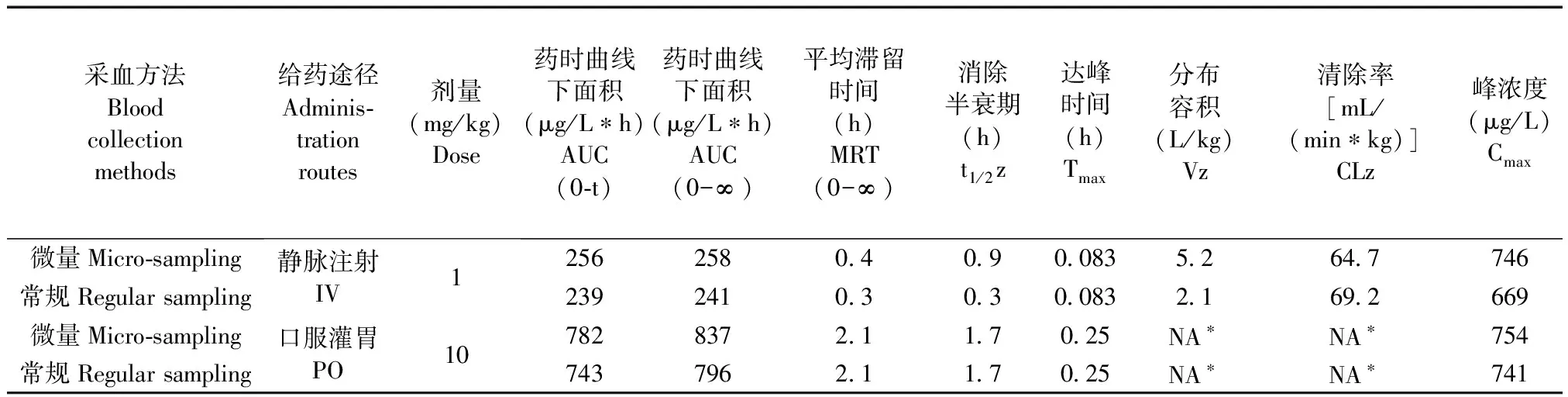
采血方法Bloodcollectionmethods给药途径Adminis⁃trationroutes剂量(mg/kg)Dose药时曲线下面积(μg/L∗h)AUC(0⁃t)药时曲线下面积(μg/L∗h)AUC(0-∞)平均滞留时间(h)MRT(0-∞)消除半衰期(h)t1/2z达峰时间(h)Tmax分布容积(L/kg)Vz清除率[mL/(min∗kg)]CLz峰浓度(μg/L)Cmax微量Micro⁃sampling常规Regularsampling静脉注射IV125625804090083526477462392410303008321692669微量Micro⁃sampling常规Regularsampling口服灌胃PO107828372117025NA∗NA∗7547437962117025NA∗NA∗741
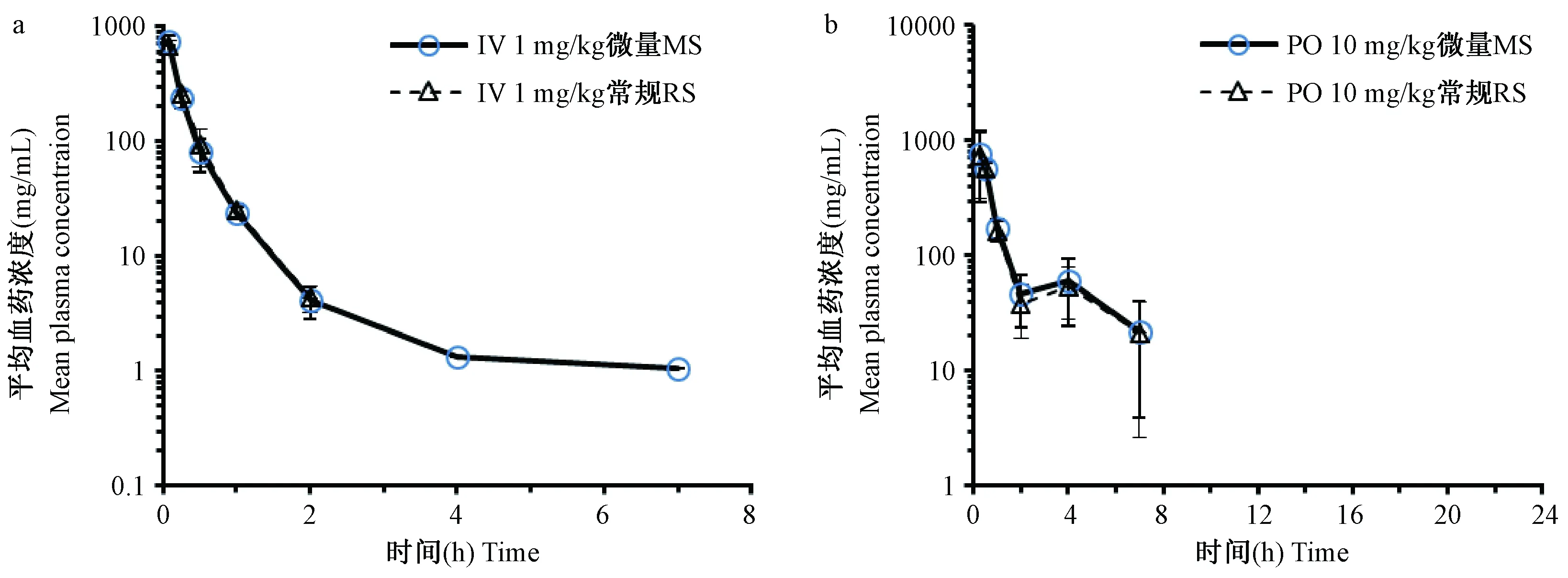
图4 微量和常规采血法测得模型化合物D的平均药时曲线Fig.4 Comparison of mean plasma concentration-time curves of model compound D in the mice by regular sampling or micro-sampling method
3 讨论
本研究在国内外首次建立了小鼠后肢隐静脉微量采血法,并利用高灵敏度的质谱技术生物分析方法,成功实施了药代动力学研究。微量采血法的应用得益于生物分析仪器灵敏度的大幅提高。通过表7可以发现,同样浓度的血浆样品在使用不同质谱进行定量时的灵敏度(色谱峰高)存在明显差异。对于药物研发早期的药动学试验,LLOQ(low limit of quantitation)值通常为1 ng/mL。虽然使用相对老旧型号的质谱也可满足此要求,但往往需要使用更多的血浆以及其他生物样品(20~50 μL)用于方法开发以及样品测定,而新型仪器可以明显降低动物血浆以及其他生物样品的使用量(5~10 μL)。

表7 同一浓度血浆样品(化合物B,1500 ng/mL)使用不同质谱仪分析时的灵敏度比较Tab.7 Sensitivity evaluation by different mass spectrometers using of the samples at the same concentration (compound B, 1500 ng/mL)
小鼠常用的采血方法有眼球摘除采血法、心脏采血法、眼眶后静脉丛采血法、尾静脉采血法等,这些方法各有其优缺点。例如眼球摘除采血法采血量约为300~400 μL,而且易致小鼠失明、易感染,止血不严密时还可致小鼠死亡[7];心脏采血法采血量可达800 μL,但由于小鼠个体小、心脏小、心脏搏动快、采血时位置较难固定,因而操作难度系数大,且需要麻醉[8-9]。这两种方法均不可重复采血,不适用于目前的药代动力学研究。眼眶后静脉丛与尾静脉采血法可重复采血,常用于药代动力学研究,但采用眼眶后静脉丛采血容易混入组织液,且需要麻醉,有可能造成眼球后组织损伤及鼻骨的破坏,甚至导致动物窒息死亡[10]。国外有报道采用尾静脉微量采血法进行药代动力学研究[6,11],但尾静脉采血法易凝血,常须采用暖灯或者温水浴加热尾部以确保重复采血操作正常进行。小鼠隐静脉血管丰富,位置浅表[12]。因此本研究在国内外首次采用了小鼠后肢隐静脉采血实施药代动力学研究。该方法无需麻醉,操作方法简单易学,采血位置和深度易把握,动物所承受痛苦降至最低。同时采血量减少了80%,动物使用量减少了65%。此外,因所有采血时间点来源于同一动物,实验数据更加优化。该采血方法更加符合动物福利3R原则,在药代动力学及其他医学实验研究中应该予以推广。
[1] 梁月琴, 杨波. 大鼠、小鼠给药及采血的几点体会 [J]. 山西医科大学学报, 2000, 31(1): 92-93.
[2] 宗阿南, 邹悦, 任萍萍. 实验动物质量检测中不同采血方法的比较 [J]. 中国比较医学杂志, 2008, l8(2): 74-75.
[3] Diehl KH, Hull R, Morton D, et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes [J]. J Appl Toxicol, 2001, 21(1): 15-23.
[4] Tse FL, Nickerson DF, Aun R. Effect of isoflurane anesthesia on antipyrine pharmacokinetics in the rat [J]. Pharm Res, 1992, 9(11): 1515-1517.
[5] 陈霆, 李枫棣, 邓巍, 等. 小鼠内眦静脉丛注射与尾静脉注射比较 [J]. 中国比较医学杂志, 2014, 24(1): 72-73.
[6] Jonsson O, Palma Villar R, Nilsson LB, et al. Capillary microsampling of 25 μL blood for the determination of toxicokinetic parameters in regulatory studies in animals [J]. Bioanalysis, 2012, 4(6): 661-674.
[7] 孙奎, 梅丹, 姜华, 等. 实验鼠采血方法及特点 [J]. 第四军医大学吉林军医学院学报, 2003, 25(1): 31-32.
[8] 吴晓晴, 郝晨霞. 160只小鼠心脏采血的操作体会 [J]. 实验动物科学与管理, 2004, 21(1): 53-54.
[9] 吕春燕, 马跃荣. 小鼠心脏穿刺采血并存活的几点注意事项 [J]. 泸州医学院学报, 2006, 29(3): 206.
[10] Said R, Abdel-Rehim M, Sadeghi B, et al. Cyclophosphamide pharmacokinetics in mice: a comparison between retro orbital sampling versus serial tail vein bleeding [J]. The Open Pharmacology Journal, 2007(1): 30-35.
[11] Hui YH, Huang NH, Ebbert L, et al. Pharmacokinetic comparisons of tail-bleeding with cannula- or retro-orbital bleeding techniques in rats using six marketed drugs [J]. J Pharmacol Toxicol Methods, 2007, 56(2): 256-264.
[12] Jonsson O, Villar RP, Nilsson LB, et al. Validation of a bioanalytical method using capillary microsampling of 8 μL plasma samples: application to a toxicokinetic study in mice [J]. Bioanalysis, 2012, 4(16): 1989-1998.

