毛绒制品的快速分子鉴定方法
刘晓侠,尤忠毓,王玉洁,孙世元
我国是毛绒制品生产、加工、出口大国,毛绒类纤维的总加工量居世界第一[1]。羊绒作为重要的毛绒类产品之一,其细度均匀,手感滑糯柔软而细腻,拉力强而富有弹性,质感、手感、保暖性等明显优于其他毛绒制品,素有“软黄金”之称[2-3]。一些不法生产厂商为达到降低成本提高利润的目的,在加工羊绒制品过程中往往掺入价值相对较低的其他纤维,如绵羊绒、改性绵羊毛、拉细绵羊毛和羊驼绒等,这些掺假行为不仅损害了消费者的利益,更影响了我国毛绒产业的健康可持续发展。
毛绒类纤维现有的鉴别方法,主要是根据GB/T 16988-2013《特种动物纤维与绵羊毛混合物含量的测定》的规定,使用投影显微镜对山羊绒[4]、兔毛、羊驼毛等绒毛类型的各组分纤维含量的测定。该鉴别方法过分依赖于检测人员的工作经验,而对羊绒、改性绵羊毛和羊驼绒等形态结构极其相似的纤维,这种方法显现出其局限性,已不能满足毛绒产业发展的要求。近年来发展起来的图像识别法[5]、红外光谱法[6]、实时定量PCR法[7]、基因探针法[8-9]、靶向蛋白质组技术[10]和生物芯片法[11]等虽各有千秋,却均因各种原因难以推广。
随着各种毛绒混纺织物的大量出口,毛绒类纤维的成分鉴定工作已成为维护商家与消费者权益,增加我国国际市场竞争力以及打击假冒劣伪产品的重要一环,也一直是纺织检测行业具有挑战性的课题之一,已成为业界亟待解决的问题。
本研究旨在利用基因扩增技术,对毛绒制品实现快速准确地定性鉴定。
1 试验部分
1.1 材料和仪器
标准参考材料:从内蒙古收集来的纯羊绒,以及上海第一纺织有限公司生产的细羊毛、羊驼绒。一般没有市售的参考纤维混合物,纤维混纺是由两种或三种不同的参考材料(羊绒/羊毛/羊驼)定量混合制备(表1和表2),这些参考混合物通过显微镜检查进行了分析。
试剂:Bio miga试剂盒;仪器:PCR扩增仪(5331型,Ger many),冷冻干燥器(6870 SPEX Sa mplePrep Freezer/Mill®,USA)。
1.2 毛绒制品线粒体DNA的提取与扩增
研究和开发动物纤维的DNA检测,关键技术难点在于DNA的提取[3,12]。特别是经过染色、整理等加工处理的毛绒制品,更难获得高质量的可用于进一步分析的DNA片段,而PCR技术只需微量的DNA样品,就能很好地解决上述问题,因此基于线粒体DNA片段的PCR技术是一种理想的选择。
纤维在冷冻干燥器用液氮研磨加工成细小的颗粒。研磨时注意以下条件:先预冷5 min,然后以10次/s的速率运行,1 min内运行2个循环,再冷却1 min。选用Bio miga试剂盒,按说明书步骤稍作改进,将粉碎的毛绒制品进行蛋白酶、DTT预处理→高效裂解→柱分离→获取线粒体DNA等步骤,分别提取羊绒、羊毛,羊驼的线粒体 DNA,并以此为模板进行PCR特异性扩增。PCR反应条件为:95℃预变性5 min,95℃变性30 s,35℃复性45 s,72℃延伸30 min,经过30个循环后,最后72℃延伸10 min。

表1 试验用毛绒织物

表2 试验用混纺毛绒织物
2 结果与讨论
2.1 引物的设计
从Genbank中分别搜索山羊、绵毛和羊驼的Cytb基因,利用Vector NIT软件中align程序进行序列比对,利用比对的非同源性序列设计特异性引物,并确保扩增的羊毛、羊绒及羊驼绒的Cytb基因片段长度不同,设计引物见表3。
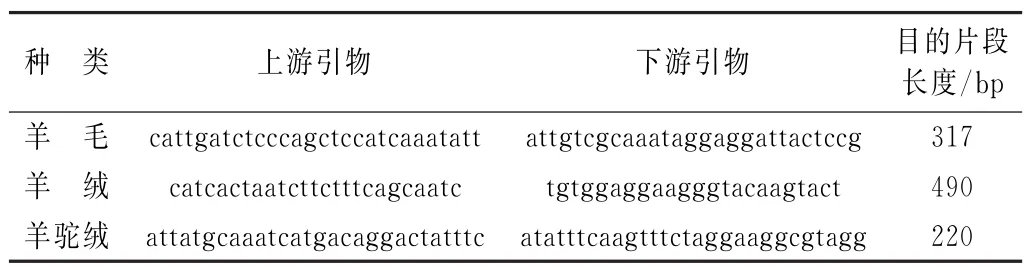
表3 不同来源的Cytb基因片段的引物序列
Cytb基因是编码线粒体内膜细胞色素b氧化酶基因的一个亚基,参与氧化磷酸化合成ATP过程。Cytb基因核苷酸序列总长为1 140 bp,编码379个氨基酸。Cytb基因进化速度适中,易用一些通用引物对所检测的物种进行扩增测序,较小的一段基因片段包括了科间、属间、种间乃至种内的遗传信息,适合于分析种间或者属间的差异被认为是解决系统分类和进化问题最可信的遗传标记之一[13],已被广泛应用到动物的分子鉴定、系统发育分析和起源与进化的研究中。
利用以上引物序列分别对山羊、绵羊及羊驼的线粒体基因组进行扩增,根据扩增产物的大小不同,可分别鉴别出羊绒、羊毛和羊驼绒。
2.2 羊毛、羊绒及羊驼绒的定性
从理论上分析,如果样品中仅存在羊绒、羊毛或羊驼纤维,那么用相应的引物可以扩增出目的条带,但用其他引物则无扩增结果。
分别采用羊毛、羊绒及羊驼引物进行扩增相应的毛绒,扩增结果见图1至图3。

图1 羊绒样品的的扩增结果
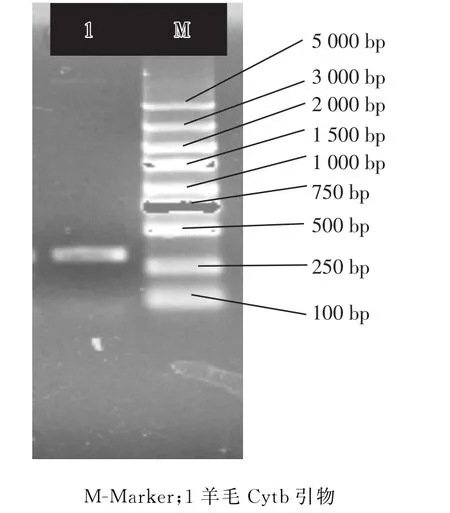
图2 羊毛样品的的扩增结果
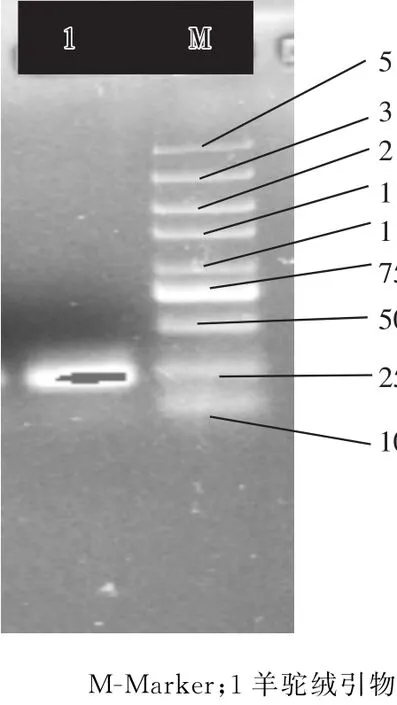
图3 羊驼绒样品的扩增结果
从图1、图2和图3可知,分别利用羊毛、羊绒和羊驼的Cytb基因片段设计的特异性引物,使不同来源的Cytb基因片段均得到特异性扩增。
2.3 羊绒/羊毛混合物的DNA检测灵敏度
当样品中羊绒、羊毛及羊驼绒纤维的含量分别为0.5%、1%、5%、10%、20%。利用相应的Cyt b引物进行特异性扩增,结果见图4。
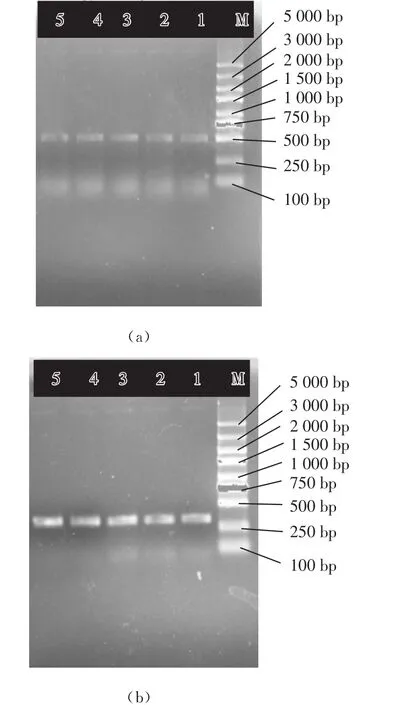
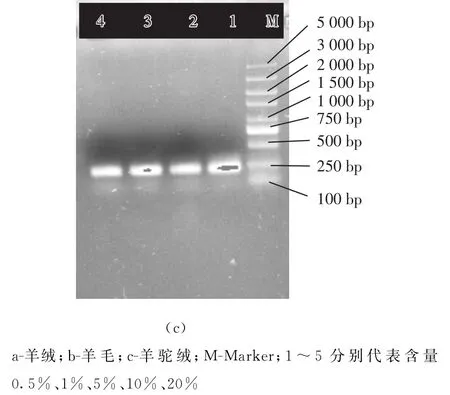
图4 Cyt b基因片段的扩增结果
由图4可知,当混合样品中羊绒比例、羊毛比例或羊驼绒的比例≥0.5%时,利用设计的特异性引物,PCR扩增技术均能准确定性。
2.4 羊绒、羊毛、羊驼混合物定性
理论上分析,如果样品中同时存在羊绒、羊毛和羊驼绒纤维,利用设计的特异性引物,可以同时扩展出三条长度不同的条带,只有当羊绒、羊毛或羊驼绒的含量很低时才有可能导致相应条带的不显著。
将羊绒,羊毛和羊驼绒纤维按不同比例混合(见表2),采用表3中的引物,进行PCR扩增实验,结果见图5。
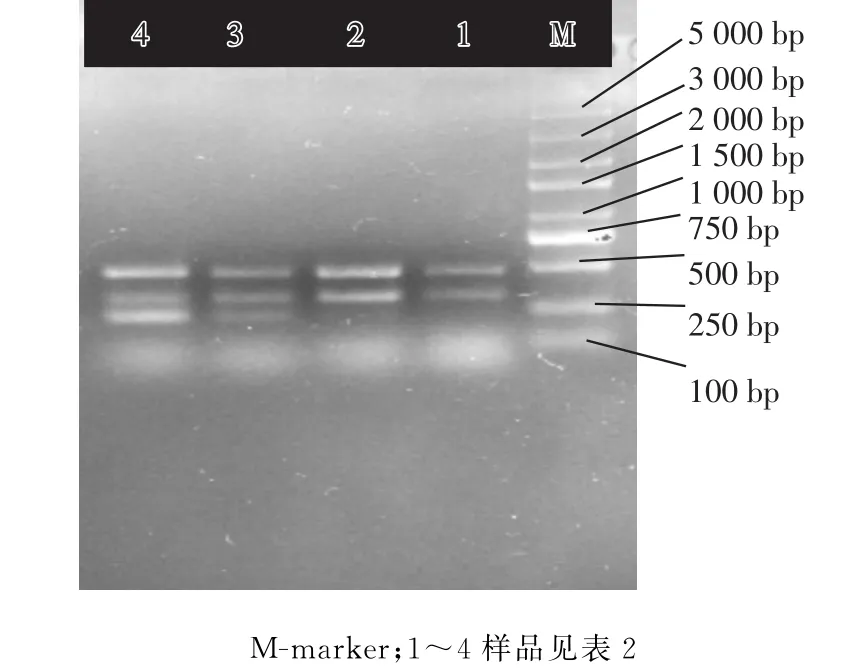
图5 不同来源的Cytb基因片段的扩增结果
从图5中可以看出,混合样品中同时检测多种成分时,羊绒含量仅为0.5%时,就有相应的扩增条带,当混和样品中羊驼绒的含量≥5%时,有相应的扩增条带。
3 结论
(1)基于不同生物Cytb基因非同源性序列设计特异性引物,进行PCR扩增定性鉴别羊绒、羊毛和羊驼绒,只要某一毛绒的含量≥0.5%,就可利用DNA技术定性鉴别出羊绒、羊毛或羊驼绒组分的存在。
(2)对于羊绒、羊毛和羊驼绒的混合物,当羊绒含量≥0.5%,羊驼绒含量≥5% 时,PCR扩增技术定性可同时鉴别羊绒、羊毛及羊驼绒纤维,避免了人为因素的影响,检测准确性、灵敏度极高,对解决贸易纠纷,尤其是国际性贸易争端可以发挥重要作用。
(3)分别针对羊绒、羊毛及羊驼绒纤维Cytb基因设计特异性引物的扩增技术,有效提高了羊绒检测的灵敏度,为PCR技术在毛绒制品方面的推广应用奠定了基础,同时为基于PCR技术的羊绒、羊毛及羊驼绒纤维定性检测研究提供了有力的技术保障。
[1] 高 泉,丁 楠,杨素英,等.浅谈毛绒制品质量安全状况[J].中国纤检,2013,(14):29-30.
[2] 孙 梅,沈淦清,王柏华,等.羊绒形态结构的相关性[J].纺织学报,2016,37(6):18-21.
[3] 张小莉,池海涛,张经华,等.羊绒和羊毛纤维检测技术研究进展[J].毛纺科技,2009,(3):56-59.
[4] 杨素英,高 泉,丁 楠.山羊绒平均直径测量(投影显微镜法)根数之探讨[J].中国纤检,2011,(1):52-54.
[5] 陈 勇,温演庆,朱谱新.计算机图像处理技术应用于纺织检测[J].纺织科技进展,2007,(6):7-10.
[6] 王彩虹,吴雄英,丁雪梅.基于支持向量机的近红外光谱羊毛混纺面料的无损鉴别技术[J].毛纺科技,2016,44(4):1-5.
[7] JI W,BAI L,JI M,et al.A method f or quantif ying mixed goat cash mere and sheep wool[J].Forensic Science Inter national,2011,208:139-14.
[8] HA MLYN P F,NELSON G,MCCART HY B J.Wool fiber identification by means of novel species specific DNA probes[J].Jour nal of Textile Institute,1992,83(1):97-103.
[9] NELSON G,HA MLYN P F,HOLDEN L.A species-specific DNA probe for goat fibre identification[J].Textile Research Jour nal,1992,62(3):590-595.
[10]杨阿芳,李珊珊,张 勇,等.基于发展靶向蛋白质组技术的羊绒纤维组成鉴定及含量分析[J].中国科技论文,2016,11(6):663-669.
[11]林志武.用生物芯片法快速鉴别羊绒羊毛的展望[J].毛纺科技,2008,(4):28-29.
[12]邵碧英,林志武,陈文炳,等.快速、高效的羊绒羊毛织品DNA提取方法的建立[J].生物技术,2009,19(5):38-39.
[13]ZARDOYA R,MEYER A.Phylogenetic perfor mance of mitochondrial protein-coding genes in resolving relationships a mong vertebrates[J].Molecular Biology and Evolution,1996,13(1):933-942.

