体外构建新型骨组织工程三维复合体
麦麦提艾力·阿不力克木 王腾飞 陶 颖 王晓帅 徐磊磊 宋兴华
(新疆医科大学第一附属医院骨科中心,乌鲁木齐 830054)
引言
中国是结核病高负担国家,2015年全国发病率仅次于印度和印度尼西亚,发病绝对数量占全球结核病人数量的9.6%[1]。在所有结核患者中,10%~15%是肺外结核,而肺外结核中居首位的是骨与关节结核[2-3]。近年来,药物耐受以及伴有HIV 感染的结核病发病率急剧增加,加剧结核控制的困难[4]。目前,临床上多采用手术治疗与全身化疗的综合性治疗,而长期全身化疗引起的副反应和手术治疗后形成的骨缺损填补是外科医生治疗骨关节结核面临的难题。为了在治疗中既可以修复骨结核病灶清除后的骨缺损,同时也在局部能够保持有效的药物浓度,有效地预防结核复发,本研究拟构建新型骨组织复合体rADSCs+利福喷丁聚乳酸缓释微球+HA/β-TCP。
1 材料和方法
1.1 实验材料
DMEM培养基(HyClone),10%胎牛血清(HyClone),链霉素-青霉素双抗溶液(Gibco),I型胶原酶(Worthington),磷酸盐缓冲液PBS(HyClone),3%戊巴比妥钠(Merck),25%胰蛋白酶溶液(HyClone),维生素C(Gibco),β-甘油磷酸纳(美国,sigma),地塞米松(美国,sigma),茜素红染液(美国,sigma),利福喷丁标准品(中国药品生物制品检定所,批号为60748-201007, 含量为99.3%),聚乳酸(聚乳酸,试剂级为3万,山东医疗器件有限公司),明胶(美国,sigma),二氯甲烷、甲醇等试剂(分析纯,市售),羟基磷灰石/β-磷酸三钙(Bi-Ostetic)。
1.2 实验仪器
超净工作台(Thermoscientific),CO2培养箱(Thermoscientific),水浴箱(上海精密设备),752紫外可见分光光度计(日本岛津),ME204E电子天平(梅特勒-托利多仪器有限公司),显微镜(Leica),电镜(上海菁华科技仪器有限公司),JJ-1 A-40 W数显增力电动搅拌器(金坛市天竟实验仪器厂),制冰机(上海精密科学仪器有限公司),低速台式离心机(上海安亭科学仪器厂),Savant modulyo冷冻干燥机(美国)。
1.3 实验方法
1.3.1rADSCs的分离培养及成骨诱导鉴定
取一只麻醉满意的兔子,严格无菌取腹股沟脂肪组织,将其放入装有D-hanks缓释液的培养皿中。于超净台在DMEM生长液中将脂肪组织剪碎成糊状,置于20 mL 0.075% I型胶原酶溶液中,37℃水浴箱中消化30 min后,加入3倍体积的DMEM终止消化,以2000转/min离心10 min后,弃上清液及表层漂浮脂肪碎屑,加入3倍体积的DMEM生长液,充分吹打混匀,置于5%CO2、37℃培养箱培养,取第3代rADSCs,滴加成骨诱导剂:DMEM生长液+维生素C(50 μmol/L)+β-甘油磷酸纳(10 mmol/L)+地塞米松(1×10-7mol/L),置于5%CO2、37℃培养箱培养,成骨诱导14 d后茜红染色,观察。
1.3.2利福喷丁聚乳酸缓释微球对rADSCs增殖及成骨活性的影响
按照复乳-溶媒挥发法[5-6]制备利福喷丁聚乳酸缓释微球,即称取聚乳酸0.1 g完全溶解于5 mL二氯甲烷,加入0.1 g利福喷丁,于4℃冰块超声细胞粉碎仪进行超声乳化(超声1 s,间隙2 s,功率为200 W)1.5 min,高速搅拌下缓慢注入到25 mL的0.5%明胶水溶液中,形成O/W乳液,加入75 mL蒸馏水进行稀释,再温和持续搅拌6 h,将获得的悬浮液通过0.88 μm孔径的水系滤膜抽滤,收集并用蒸馏水洗涤,离心(2000转/min,15 min)数次后冷冻干燥24 h,并计算微球载药率及包封率,显微镜及扫描电镜下观察形态大小及表面形态结构。取第3代rADSCs(浓度为3×106个/mL)400 μL与微球3 mg混合均匀后接种于培养皿中,设置2个复皿。设立对照组及未加入利福喷丁聚乳酸缓释微球,均滴加成骨诱导剂,成骨诱导14 d后茜红染色,观察。
1.3.3利福喷丁聚乳酸缓释微球+rADSCs+HA/β-TCP的复合
对用60Co-γ照射消毒并在成骨诱导剂中浸泡24 h的HA/β-TCP,在用无菌滤纸吸净培养基后,将第3代rADSCs悬液400 μL缓慢滴加,在5%CO2、37℃培养箱培养4 h后,将其移至新的培养皿中,加入成骨诱导剂,往第一个培养皿中滴加2.5 g/L胰蛋白酶消化,计算流失细胞数。取第3代rADSCs悬液400 μL与微球3 mg混合后,缓慢滴加到HA/β-TCP支架上,在5%CO2、37℃培养箱内培养4 h后,将其移至新的培养皿中,加入成骨诱导剂,往第一个培养皿中滴加2.5 g/L胰蛋白酶消化,计算流失细胞数。将上述2个复合体置于5%CO2、37℃培养箱培养24 h后,在震荡培养后,将2个复合体移至新的培养皿中,加入成骨诱导剂后继续在5%CO2、37℃的培养箱中培养。旧的培养皿中滴加2.5 g/L胰蛋白酶消化,计算未黏附细胞数。将上述2个复合体在成骨诱导中培养14 d后,沿皿壁吸净培养基,用4%多聚甲醛固定过夜,95%、75%、45%乙醇逐级脱水、喷金后,扫面电镜观察rADSCs在HA/β-TCP支架的黏附及生长情况,以及微球和rADSCs在HA/β-TCP支架上的黏附情况。
1.3.4利福喷丁聚乳酸缓释微球+rADSCs+HA/β-TCP三维复合体的体外释药性
称取利福喷丁标准品10 mg,滴加成骨诱导剂基定容至25 mL容量瓶刻度,从中分别精取0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL液体,滴加至25 mL容量瓶中,用成骨诱导剂基定容至刻度,用紫外分光光度法在475 nm下检测吸光度,画出利福喷丁浓度(c)对吸光度(A)的线性回归曲线为标准曲线。将上述三维复合体置于培养皿中,隔日换液并收集培养基,将培养基离心后取上清液,在475 nm下检测吸光度(A),并代入标准曲线中算出利福喷丁浓度。以时间为横坐标,累计释放量为纵坐标,绘制药物释放曲线。
2 结果
2.1 rADSCs及成骨诱导的显微镜观察
第3代rADSCs呈梭形,镜下可见排列有一定的方向性,呈漩涡状排列分布(见图1)。rADSCs体外成骨诱导,茜素红染色后,经显微镜观察发现,细胞外基质被染成深红色(见图2)。
2.2 利福喷丁聚乳酸缓释微球+rADSCs二维复合体
大体观察,微球外观呈橘红色粉末状,无明显的聚集(见图3)。扫描电镜下呈圆球状,无粘连成团,表面光滑(见图4)。微球平均直径(21.82±5.32)μm,76.4%的微球粒径分布在18~28 μm范围(见图5),微球载药率(27.57±4.72)%,包封率(82.31±1.28)%。微球与第3代rADSCs经成骨诱导14 d,茜素红染色后,显微镜下发现深红染色的许多结节,微球表面塌陷,但保持圆形轮廓(见图6)。

图1 第3代兔脂肪干细胞 (10×)Fig.1 The third generation rADSCs (10×)
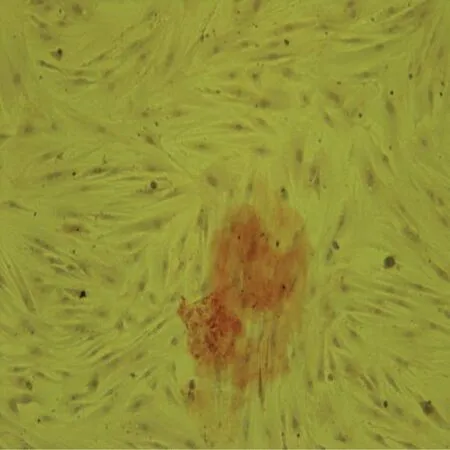
图2 成骨诱导14 d茜素红染色 (5×) Fig.2 The alizarin red dye after osteogenic induction (5×)

图3 微球大体观 Fig.3 The microspheres

图4 微球扫描电镜(600×)Fig.4 The microspheres′s SEM view (600×)

图5 微球粒径分布 Fig.5 The size distribution of microspheres

图6 微球-rADSCs二维复合体(5×)Fig.6 The two-Dimensional Complex(5×)
2.3 利福喷丁聚乳酸缓释微球+rADSCs+HA/β-TCP的复合
rADSCs+HA/β-TCP复合体细胞黏附率(94.24±1.25)%,微球+rADSCs+HA/β-TCP复合体细胞黏附率(92.02±0.74)%,两组数据比较无统计学差异(P>0.05)。在扫描电镜下,HA/β-TCP表面呈不规则颗粒状,各孔间相通,孔隙大小不等。
rADSCs+HA/β-TCP复合体培养14 d后,可见HA/β-TCP表面被rADSCs层状膜形分布(见图7)。微球+rADSCs-HA/β-TCP复合体培养14 d后,HA/β-TCP表面见rADSCs相互融合呈膜状,并将微球牢固地固定在HA/β-TCP上,释微球表面塌陷,但保持圆形轮廓(见图8)。两组复合体中,rADSCs形态无明显差异。

图7 rADSCs+HA/β-TCP复合体(扫描电镜 200×)Fig.7 The two-Dimensional Complex(SEM 200×)

图8 微球+rADSCs+HA/β-TCP复合体(扫描电镜 200×)Fig.8 The three-Dimensional Complex(SEM 200×)
2.4 利福喷丁聚乳酸缓释微球+rADSCs+HA/β-TCP三维复合体的体外释药性
根据紫外线分光光度计的吸光值(A)结果,得出利福喷丁标准品在含成骨诱导剂的DMEM培养基中的标准曲线:A=12.513c-0.011 7(R2=0.999 6)(见图9)。微球+rADSCs+HA/β-TCP三维复合体第6 d释放量最高,达0.127 8±0.000 2 mg,第46 d累计释放量达89.733% (见图10、11)。

图9 标准曲线 Fig.9 The standard curve

图10 药物释放浓度 Fig.10 The drug release concentration

图11 药物累计释放百分率Fig.11 The cumulative release rate of drug
3 讨论
rADSCs是脂肪组织中具有干细胞特性的细胞群,经过一定的定向培养后,可以分化为成骨细胞、软骨细胞、肌细胞、内皮细胞和神经前体细胞。Arrigoin等将rADSCs接种于HA支架上,修复胫骨缺损,8周后发现rADSCs+HA复合体的骨愈合情况明显好于单纯HA的情况[7]。
支架材料在体外构建骨组织工程复合体中具有重要的意义,本实验中所用的HA/β-TCP 是由60%的 HA和40%β-TCP组成的复合材料,是一种新型的植骨材料,也是目前广泛应用于临床的人工骨粒,具有很好的生物相容性、可降解性及骨传导性,能够与骨直接形成键性结合,形成骨组织,是骨组织工程中比较理想的支架材料。李海建等采用HA/β-TCP复合体材料和家兔同种异体骨进行rADSCs培养,结果发现rADSCs在两种材料上附着良好、生长良好、增殖明显并保持均匀分布,HA/β-TCP复合体材料的生物相容性不弱于同种异体骨的生物相容性,可在骨组织工程中充当细胞载体[8]。
利福喷丁是一种新型半合成的利福霉类抗生素,其抗结核杆菌作用比利福平强2~10倍,最低抑菌浓度(MIC)为0.12~0.39 mg/L,具有高效、低毒、长效的优点,是安全有效的抗结核药物[9-10]。通过复乳-溶媒挥发法[5-6]制备具有缓慢释药的微球,其平均直径、载药率及包封率与文献报道的相仿[11]。本实验将rADSCs与微球二维复合后成骨诱导,茜素红染色证明该复合物可向骨分化,成骨诱导14 d后显微镜发现微球表面塌陷,但保持圆形轮廓,可能是微球降解、释放的结果。rADSCs+微球+HA/β-TCP三维复合后,经检测复合体中细胞黏附率较高,微球及rADSCs均未见脱落现象,提示rADSCs与微球及支架均有较好的相容性。此外,复合体中微球向外周释放良好,未见细胞干扰微球释放的现象。
体外释药结果提示,三维复合物初期有“突释”现象,随后药物缓慢释放,释放量逐渐减少,符合聚乳酸缓释材料释放的一般规律[12]。释放周期可达46 d,均高于最低抑菌浓度。实验结果表明,rADSCs、HA/β-TCP和利福喷丁聚乳酸缓释微释球复合,所构建的材料既可以修复骨结核病灶清除后的骨缺损,同时在局部能够保持有效的药物浓度,能有效预防结核复发,为治疗骨结核这一临床难题开辟了崭新的思路。
4 结论
本实验用rADSCs、利福喷丁聚乳酸缓释微球及HA/β-TCP构建新型骨组织工程复合体,可以控制药物的缓慢释放,并且在局部维持有效的抗结核药物的同时,不影响其增殖及成骨活性,为兔脊柱结核的治疗提供新的思路,从而引导临床上治疗骨与关节结核,但其体内抗结核及促进骨愈合作用还需经体内的进一步验证。
[1] World Health Organization.Global tuberculosis report 2015[EB/OL].http://www.tbonline.info/posts/2015/10/28/global-tuberculosis-report-2015,2015-12/2017-05-20.
[2] 全国第五次结核病流行病学抽样调查技术指导组.2010年全国第五次结核病流行病学抽样调查报告[J].中国防痨杂志,2012,34(8):485-508.
[3] Pigrau-serrallach C,Rodr Guez-padro D.Bone and joint tuberculosis[J].Eur Spine J,2013,22(4):556-566.
[4] Chang KC, Yew WW. Management of difficult multidrug-resistant tuberculosis and extensively drug-resistant tuberculosis: Update 2012[J]. Respirology, 2013, 18(1):8-21.
[5] 叶向阳,孙湘,贾会文,等.利福平/聚乳酸-聚羟基乙酸缓释微球的制备及特性[J].中国组织工程研究与临床康复,2011,15(51): 9608-9612.
[6] 刘江涛,王永清,夏侃,等.异烟肼聚乳酸缓释体的制备及体内外释药特性[J].中国脊柱脊髓杂志,2008,18(4):290-293.
[7] Arrigoni E, Girolamo LD, Giancamillo AD. Adipose-derived stem cells and rabbit bone regeneration: histomorphometric, immunohistochemical and mechanical characterization[J]. Journal of Orthopaedic Science, 2013, 18(2):331-339.
[8] 李海建,龙志成,张峥,等. HA/β-TCA复合材料与同种异体骨体外兔脂肪干细胞生物相容性的对比实验[J]. 新疆医科大学学报, 2015(8):949-953.
[9] Jarvis B, Lamb HM. Rifapentine[J]. Drugs, 1998, 56(4):607.
[10] Listed N. Rifapentine[J]. Tuberculosis, 2008, 88(2):155.
[11] 王丹,姜航航. 聚乳酸共聚物复合缓释药物的材料特征与实验应用[J]. 中国组织工程研究, 2013,17(8):1473-1480.
[12] 王丹,姜航航. 聚乳酸共聚物复合缓释药物的材料特征与实验应用[J]. 中国组织工程研究,2013,17(8):1473-1480.

