E-Cad、EGFR和FOXA1在三阴性乳腺癌中表达的临床意义
张言敏,孙辉,李玉军
(1.青岛大学医学部 病理系,山东 青岛 266071;2.山东省潍坊市人民医院肿 瘤外科,山东 潍坊 261000;3.青岛大学附属医院 病理科,山东 青岛 266000)
乳腺癌是女性最常见的恶性肿瘤之一,其中三阴性乳腺癌(triple-negative breast cancer,TNBC)特指雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)表达均为阴性的乳腺癌,其发病率占所有乳腺癌的10%~20%[1]。与非三阴性乳腺癌(non-tri-negative breast cancer, NTNBC)比较,TNBC具有侵袭性强、预后差、易复发及内分泌治疗不敏感等特点,已成为医疗领域广泛研究的对象[2]。临床研究发现,乳腺癌的10年存活率平均为60%,一期乳腺癌治疗后的存活率达80%,零期乳腺癌治疗后的存活率更接近100%,因此乳腺癌的早期诊断并及时治疗非常重要[3]。由于TNBC的治疗相比于NTNBC更为棘手,所以早期诊断出乳腺癌的同时并发现TNBC的意义更为重要。
研究发现,E-钙黏蛋白(E-cadhenrin,E-Cad)和表皮生长因子受体(epidermal growth factor receptor,EGFR)在健康人群和乳腺癌患者中表达有差异,且在TNBC和NTNBC中,E-Cad、EGFR以及组织中叉头框蛋白A1(fork head box protein A1,FOXA1)的表达也有不同[4-5],但关于血清中E-Cad和EGFR的研究较少,国内外鲜有报道。因此,本研究通过收集乳腺癌患者和健康人群血液样本,比较血清中E-Cad和EGFR的差异,并通过受试者工作特征(receiver operating characteristic,ROC)曲线评价血清E-Cad和EGFR对乳腺癌及TNBC的临床诊断价值,同时预测血清中ECad和EGFR的诊断界值。FOXA1在TNBC的发病、治疗和预后等方面起到重要作用,故通过检测乳腺癌患者组织中FOXA1的表达,进一步研究TNBC和NTNBC中FOXA1的表达差异,为TNBC的早期诊断、治疗提供参考。
1 资料与方法
1.1 研究对象
1.1.1 患者组选取2015年7月-2016年8月我院经病理检测确诊为浸润性乳腺癌的247例女性患者。其中,三阴性乳腺癌患者(TNBC组)49例(19.80%),中位年龄47岁(23~71岁)。非三阴性乳腺癌患者(NTNBC组)198例(80.20%),中位年龄51岁(26~75岁)。研究符合伦理委员会相关规定,经本院医学伦理委员会批准。
1.1.2 非患者组随机选取来我院体检的健康人群50例,将血清保存备用。
1.2 方法
1.2.1 E-Cad和EGFR的检测取患者清晨空腹静脉血3 ml,4 000 r/min、4℃离心15 min,常规分离血清,备用进行细胞因子的检测。血清可溶性E-Cad和EGFR的含量测定采用酶联免疫吸附试验,试剂盒由上海钰博生物科技有限公司提供。E-Cad和EGFR检测均采用双抗体夹心ELISA法,各孔加入标准品或样品100 μl,37℃避光孵育90 min,然后弃去孔内液体,甩干后直接加入生物素化抗体工作液,继续孵育1 h,然后洗板3次,最后1次洗板甩干后加入酶结合物工作液,孵育30 min后洗板5次,甩干后加入底物溶液,标准孔出现梯度时,加入终止液,使用酶标仪于450 nm处测定光密度值,绘制标准曲线并计算样本中E-Cad和EGFR的含量。
1.2.2 ROC曲线的建立及界值预测采用SPSS 19.0软件进行非参数法建立E-Cad和EGFR的ROC曲线,计算ROC曲线下面积;并以Youden指数最大值作为临界点,计算血清中E-Cad和EGFR的界值,以及灵敏度和特异性。
1.2.3 FOXA1的检测取TNBC组和NTNBC组乳腺癌患者病理石蜡标本及正常乳腺组织标本,分别进行连续切片6张(8 μm/张)。具体操作步骤按照试剂盒说明书进行操作,用5%血清进行室温封闭40 min后,分别加入1∶1 000的FOXA1单克隆抗体4℃过夜孵育。隔天加入1∶1 000的二抗37℃孵育30 min,PBS清洗后加入SP后进行恒温反应30 min,加入DAB显色液进行显色,中性树胶封片后用×10、×40物镜显微镜进行观察。阳性染色:FOXA1的阳性表达主要表现为细胞内出现棕黄色颗粒。×40显微镜下观察,随机选择5个高倍视野,采用IPP软件进行图像扫描分析,收集数据并计算图片中FOXA1蛋白表达的平均光密度。用于反应组织中FOXA1蛋白的表达含量。平均光密度=累积光密度与面积的比值。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)或中位数及四分位数[M(P25,P75)]表示,组间比较采用方差分析或Kruskal-WallisH检验,方差分析采用LSD-t检验,秩和检验两两比较采用Mann-WhineyU检验,采用ROC曲线评价血清E-Cad和EGFR对乳腺癌或TNBC的临床诊断价值,P<0.05为差异有统计学意义。
2 结果
2.1 不同人群中E-Cad和EGFR表达情况
3组人群E-Cad、EGFR秩和检验分析结果显示,3组间差异有统计学意义(P<0.01)。与非患者组比较,NTNBC组和TNBC组血清中E-Cad、EGFR表达升高(P<0.01);与NTNBC组比较,TNBC组血清中E-Cad表达差异无统计学意义(P>0.05),EGFR表达升高(P<0.05),差异有统计学意义。见附表。
2.2 血清E-Cad、EGFR对乳腺癌和TNBC诊断的ROC曲线
结果可见,E-Cad和EGFR对于诊断乳腺癌的ROC曲线下面积(AUC)分别为0.965(95%CI:0.944,0.986),0.758(95%CI:0.686,0.830)。当 E-Cad 和EGFR的界值分别为1010.7和107.9 ng/ml时,Youden指数最大为0.807和0.385,此时,诊断乳腺癌的敏感性为92.7%和78.5%,特异性为88.0%和60%。由于NTNBC组和TNBC组血清中E-Cad表达差异无统计学意义,所以只对EGFR诊断TNBC进行研究(见图1B),ROC 曲线下面积为 0.776(95%CI:0.703,0.848)。当EGFR界值为139.5 ng/ml时,Youden指数最大为0.473,此时,诊断TNBC的敏感性为79.6%,特异性为67.7%。见图1。
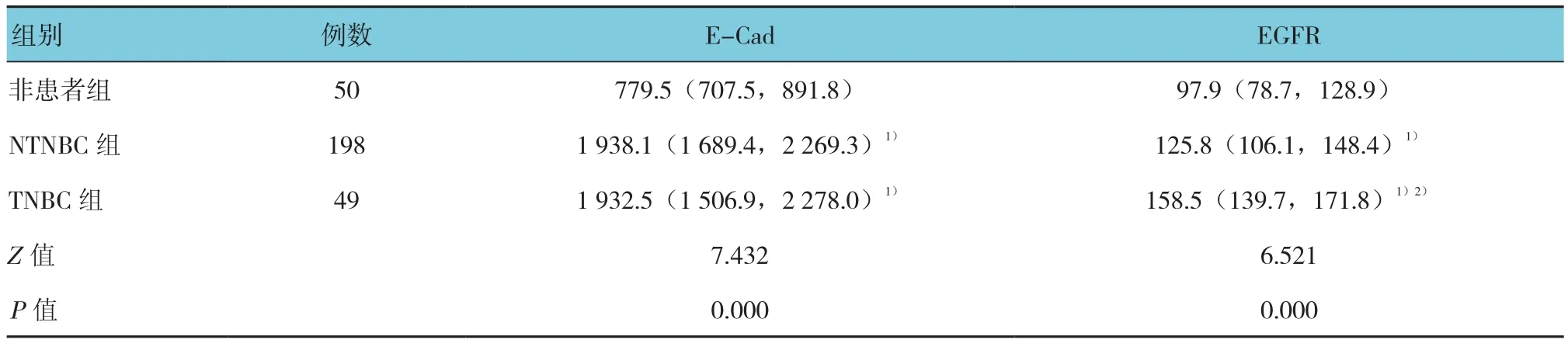
附表 不同人群中E-Cad和EGFR表达比较 [M(P25,P75),ng/ml]
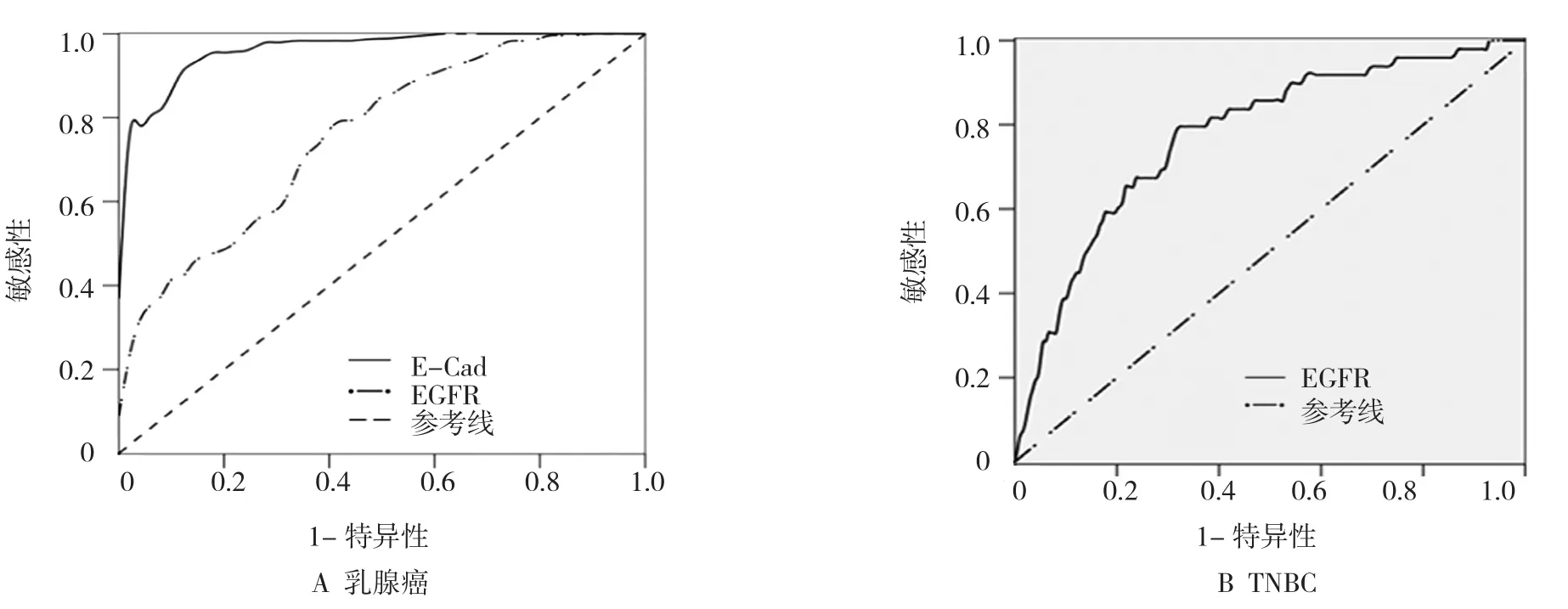
图1 血清E-Cad、EGFR对乳腺癌和TNBC诊断的ROC曲线
2.3 FOXA1的检测结果
3组人群FOXA1平均光密度表达分析结果显示,3组比较差异有统计学意义(F=6.432,P=0.000)。与非患者组FOXA1蛋白含量(0.31±0.04)比较,NTNBC组FOXA1蛋白含量(1.67±0.11)和TNBC组组织中FOXA1蛋白含量(0.87±0.12)表达均上升(P<0.01);与NTNBC组比较,TNBC组组织中FOXA1表达降低(P<0.01),差异有统计学意义,见图2。
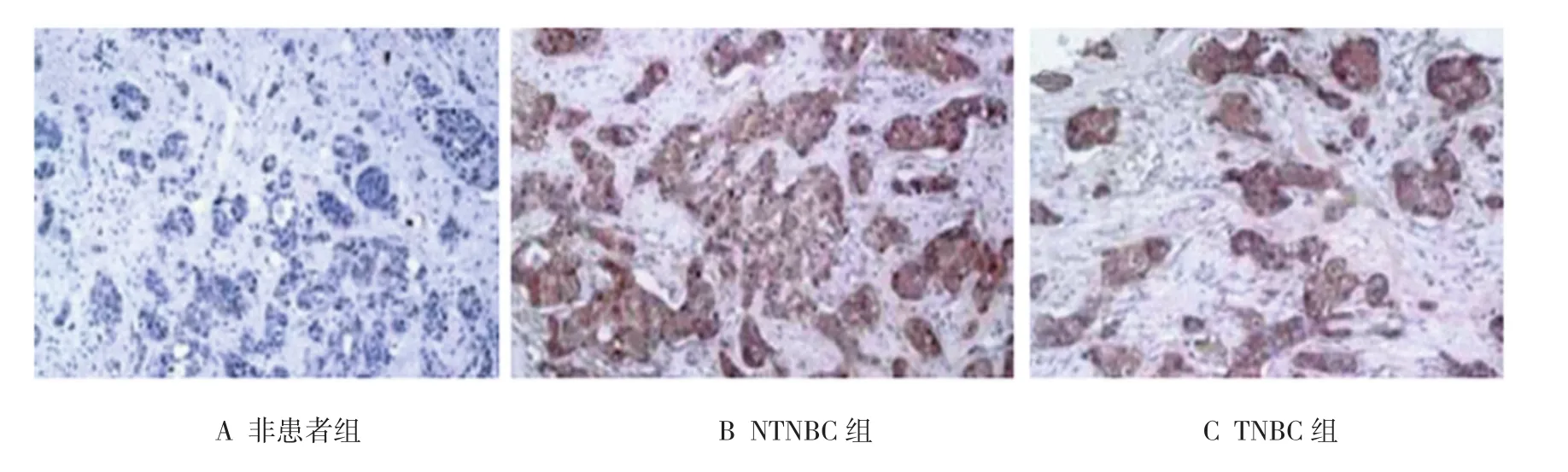
图2 各组FOXA1蛋白表达情况 (×400)
3 讨论
乳腺癌作为一种恶性肿瘤,严重危害女性身体健康,未及时诊断乳腺癌会拖延治疗的最佳时间和治疗效果,因此在乳腺癌研究中,除化疗或手术外,尽早发现及确诊肿瘤已成为其治疗的关键[6]。血清指标检查是早期无创性诊断肿瘤的常用手段,能够极大提高诊断方法的顺应性,为尽早发现肿瘤提供重要参考[7]。E-Cad是一种细胞黏附分子,具有维持组织结构完整等功能,在肿瘤侵袭转移中起到重要作用[8]。LIANG等的研究结果表明[9],相对于健康人群,乳腺癌患者血清中可溶性E-Cad表达升高;LI等的研究表明[10],与NTNBC患者比较,TNBC组织中E-Cad表达降低,但未见NTNBC患者与TNBC患者血清中ECad含量比较的研究。EGFR是一类跨膜糖蛋白,具有酪氨酸激酶活性,并调控细胞增殖作用,高表达的EGFR可促进乳腺癌细胞增殖、转移,并促进肿瘤血管生成[11]。TAS等的研究表明[12],乳腺癌患者血清中EGFR表达升高,且与NTNBC患者比较,TNBC中EGFR表达较高。本研究结果表明,乳腺癌患者血清中E-Cad和EGFR表达相对健康人群升高,且在TNBC患者中EGFR表达高于NTNBC患者,而E-Cad表达无差异。ROC曲线结果表明,血清E-Cad和EGFR均具有一定的乳腺癌诊断价值,E-Cad(曲线下面积为0.965)诊断价值高于EGFR(曲线下面积为0.758),但在乳腺癌患者中,由于TNBC和NTNBC患者血清中E-Cad表达无差异,不具备TNBC诊断价值,而EGFR具有中等的TNBC诊断价值。本研究以Youden指数作为评价准确度的指标,当E-Cad和EGFR的界值分别为1010.7和107.9 ng/ml时,对于乳腺癌具有较高的诊断价值。当EGFR的界值为139.5 ng/ml时,适用于三阴性乳腺癌的诊断。
ER在乳腺癌的临床进展、诊断及治疗中均有着极其重要的作用,研究表明ER已成为评价患者是否需要内分泌治疗的重要指标。但由于ER在三阴性乳腺癌中呈现阴性表达,TNBC患者对内分泌治疗敏感性较低,因此TNBC临床治疗效果常常不佳[13-14]。FOXA1是一类由472个氨基酸残基组成的转录辅助因子,主要受体内激素调控。ER可诱导乳腺癌细胞表达FOXA1,同时FOXA1又可促进ER转录复合物与染色质的结合上调ER表达,从而提高内分泌治疗的效果[15]。研究表明,FOXA1与乳腺癌患者的预后存在相关性,可作为评价治疗效果良好的标志物[16]。DREW等的研究结果表明,与NTNBC患者比较,TNBC中FOXA1表达阳性率降低[17],但相关研究文献较少,缺乏文献支持。本研究结果表明,TNBC患者FOXA1表达降低,表明FOXA1可作为TNBC的诊断指标,更为重要的是,FOXA1有可能成为治疗TNBC的关键靶点。但本研究还未对FOXA1与患者化疗效果及预后的相关性展开研究,这可作为下一步的研究方向。
研究健康人群、TNBC与NTNBC患者血清中E-Cad、EGFR,并结合ROC曲线探讨血清E-Cad和EGFR的临床诊断意义,并预测诊断界值,为临床TNBC的诊断提供无创、便捷的血清检测手段;并通过检测FOXA1的表达,为NTNBC的诊断和靶点治疗提供参考。
[1] ANDREOPOULOU E, KELLY C M, MCDAID H M. Therapeutic advances and new directions for triple-negative breast cancer[J].Breast Care(Basel), 2017, 12(1): 21-28.
[2] SATO N, WAKABAYASHI M, NAKATSUJI M, et al. MEK and PI3K catalytic activity as predictor of the response to molecularly targeted agents in triple-negative breast cancer[J]. Biochem Biophys Res Commun, 2017, 489(4): 484-489.
[3] TEZUKA K, TAKASHIMA T, KASHIWAGI S, et al. Phase I study of nanoparticle albumin- bound paclitaxel, carboplatin and trastuzumab in women with human epidermal growth factor receptor 2-overexpressing breast cancer[J]. Mol Clin Oncol, 2017,6(4): 534-538.
[4] XU H, TIAN Y, LIU Q, et al. CD44 correlates with clinicopathological characteristics and is upregulated by EGFR in breast cancer[J]. Int J Oncol, 2016, 49(4): 1343-1350.
[5] SHEN T, ZHANG K, SIEGAL, et al. Prognostic value of E-cadherin and β-catenin in triple-negative breast cancer[J]. Am J Clin Pathol,2016, 146(5): 603-610.
[6] ORUCEVIC A, CURZON M, CURZON C, et al. Breast cancer in elderly caucasian women-an institution-based study of correlation between breast cancer prognostic markers, TNM stage, and overall survival[J]. Cancers(Basel), 2015, 7(3): 1472-1483.
[7] 龙璐, 陈贞, 王堃, 等. 血清GPC3、GP73、AFP-L3和AFP检测对原发性肝癌诊断的价值[J]. 中国现代医学杂志, 2013, 23(28):46-50.
[8] CHRISTOU N, PERRAUD A, BIONDY S, et al. E-cadherin: A potential biomarker of colorectal cancer prognosis[J]. Oncol Lett,2017, 13(6): 4571-4576.
[9] LIANG Z, SUN X Y, XU L C, et al. Abnormal expression of serum soluble E-Cadherin is correlated with clinicopathological features and prognosis of breast cancer[J]. Med Sci Monit, 2014, 20: 2776-2782.
[10] LI P, SUN T, YUAN Q, et al. The expressions of NEDD9 and E-cadherin correlate with metastasis and poor prognosis in triplenegative breast cancer patients[J]. Onco Targets Ther, 2016, 9:5751-5759.
[11] COSTA R, SHAH A N, SANTA-MARIA C A, et al. Targeting epidermal growth factor receptor in triple negative breast cancer:New discoveries and practical insights for drug development[J].Cancer Treat Rev, 2017, 53: 111-119.
[12] TAS F, BILGIN E, KARABULUT S, et al. Clinical significance of serum epidermal growth factor receptor (EGFR) levels in patients with breast cancer[J]. Cytokine, 2015, 71(1): 66-70.
[13] NAGINI S. Breast cancer: current molecular therapeutic targets and new players[J]. Anticancer Agents Med Chem, 2017, 17(2):152-163.
[14] 杨虹, 曾福仁, 刘剑仑, 等. ER、PR、HER-2、Ki-67与乳腺癌新辅助化疗疗效相关性分析[J]. 中国现代医学杂志, 2016,26(24): 54-57.
[15] ZHANG X L, WANG H S, LIU N, et al. Bisphenol A stimulates the epithelial mesenchymal transition of estrogen negative breast cancer cells via FOXA1 signals[J]. Arch Biochem Biophys, 2015,585: 10-16.
[16] HU Q, LUO Z, XU T, et al. FOXA1: a promising prognostic marker in breast cancer[J]. Asian Pac J Cancer Prev, 2014, 15(1):11-16.
[17] DAVIS D G, SIDDUQUI M T, OPREA-ILIES G, et al. GATA-3 and FOXA1 expression is useful to differentiate breast carcinoma from other carcinomas[J]. Hum Pathol, 2016, 47(1): 26-31.

