血清miR-6861-5p检测在乳腺癌临床诊治中的价值探讨
袁超
乳腺癌是女性最为常见的恶性肿瘤之一,目前据全球女性恶性肿瘤发病率首位,我国每年因乳腺癌死亡的病患超过7万例。近年来,乳腺癌不仅发病率呈逐年上升趋势,而且发病人群越来越年轻化[1]。由于乳腺癌发病机制尚不明确,所以早期诊断和治疗是影响乳腺癌患者生存的关键,但目前常用的乳腺癌血清标志物如CA153、CA125和CEA诊断的敏感度和特异度均较低[2-3]。
microRNA是一类在真核细胞中发现的、由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,通过对其靶基因转录的调控参与真核细胞的分化、增殖、生长和凋亡的调节。目前随着对miRNA研究的不断深入,发现其不仅可以作为多种疾病治疗的靶点[4-5],而且在癌症的发生发展过程中发挥重要作用[6-8]。研究发现[9-10],由于受到内源性RNA酶的保护作用,来源于肿瘤组织的miRNA可以稳定地存在于血液中,这种miRNA对肿瘤具体较高的特异性,且与癌症的临床分期、癌细胞转移、术后复发以及无瘤生存期等有关。本研究通过对比乳腺癌患者、乳腺良性病变患者和健康人群血清miR-6861-5p的表达,分析血清miR-6861-5p与乳腺癌患者临床病理特征、诊断以及预后的关系,探讨血清miR-6861-5p检测对乳腺癌患者的临床诊断价值。
1 材料与方法
1.1 研究对象
收集2013年1月至2015年6月山东省德州市第二人民医院112例乳腺癌患者外周血(乳腺癌组),并经病理证实,同时随机选取同时期乳腺良性病变女性患者外周血37例(良性病变组)(乳腺增生18例、乳腺囊肿12例以及乳腺纤维瘤7例),健康体检女性外周血53例(健康组)。
纳入标准:1)所有研究对象年龄、性别以及体重等一般资料完整;2)健康组和良性病变组患者未合并其他恶性肿瘤;3)乳腺癌患者收集外周血前未经任何放化疗或者手术根除治疗;4)年龄>18周岁,且对本次研究知情并签订知情确认书,并经山东省德州市第二人民医院伦理协会审查通过。排除标准:1)乳腺癌术后病理分期、分子分型不明确;2)合并胰腺癌、结肠癌等消化系统或其他恶性肿瘤的乳腺癌患者;3)健康研究对象纳入前一年内有手术治疗病史或有既往肿瘤病史,采血前3个月内有药物服用史或住院治疗病史;4)乳腺癌和乳腺良性病变患者在采集外周血前1周内有药物服用史。
1.2 方法
1.2.1 血清miR-6861-5p的提取与检测 采集研究对象外周血5~10 mL,EDTA抗凝,离心(1000×g)10 min(5810R,德国Eppendorf AG公司)收集血清。向200 μL血清中加入1 000 μL QIAzol溶解试剂(QI⁃GEN公司,德国),室温静置15 min,根据miRNeasy血清/血浆总RNA提取试剂盒(QIGEN公司,德国)说明书提取血清总RNA,DEPC水溶解总RNA。通过One Step PrimeScript miRNA cDNA Synthesis Kit(Takara,日本)将RNA逆转录为cDNA,PCR参数设置:37℃60 min,85℃ 5s。
RT-qPCR:根据SYBR Premix Ex TaqTM II(TakaRa公司,日本)说明书制备20 μL RT-qPCR反应体系,并使用ABI 7500荧光定量PCR仪(Applied Biosystems公司,美国)进行PCR扩增。PCR引物:mi-6861-5p上游引物:5'-ACACTCCAGCTGGGACTGGGTAGGTGGG C-3',下游引物:5'-GTGCAGGGTCCGAGGT-3';U6上游引物:5'-CTCGCTTCGGCAGCACA-3',下游引物:5'-AACGCTTCACGAATTTGCGT-3'。PCR参数设置:95℃,30 s,40个循环(90℃,5 s,65℃,30 s)。选择U6作为内参照,并用2-Δt法(Δt=CTmiRNA-CTU6)计算miR-6861-5p的相对表达量。
1.2.2 乳腺癌患者血清学指标的检测 收集血清,通过自动生化分析仪(AU680,Beckman Coulter公司,美国)检测血清总胆固醇(total cholesterol,TC),甘油三酯(triglycerdes,TG),高密度胆固醇(high-density cholesterol,HDL-C)以及低密度胆固醇(low-density cholesterol,LDL-C)。
1.2.3 免疫组织化学检测 收集根治性手术切除的乳腺癌组织,经石蜡包埋后制成4 μm的组织切片,根据购买的免疫组织化学试剂盒(北京中杉金桥生物技术有限公司)说明书进行HER-2、孕激素受体(pro⁃gesterone receptor,PR)和雌激素受体(estrogen recep⁃tor,ER)的免疫组织化学检测,以PBS代替一抗作为阴性对照。每张切片选取5个视野,请两位副主任医师以上的病理学专家在200×高倍镜下进行盲法读片,以阳性细胞所占总细胞比例作为阳性细胞比例。PR和ER定位于细胞核,而HER-2则定位于细胞膜,以阳性细胞比例≥10%为阳性,<10%为阴性。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析,t检验比较组间或组内差异;χ2检验比较组间差异。以P<0.05为差异具有统计学意义。
2 结果
2.1 miR-6861-5p在不同患者血清中的表达
3组研究对象在年龄、BMI、TC、TG、HDL-C以及LDL-C等一般临床资料或指标上对比无显著性差异(均P>0.05,表1);112例乳腺癌组患者血清miR-6861-5p相对表达量为(7.99±1.63),显著高于良性病变组患者血清(6.45±1.06)(P<0.05)和健康血清miR-6861-5p相对表达量(6.43±1.28)(P<0.05),但miR-6861-5p在良性病变研究对象和健康研究对象血清中的相对表达量对比无显著性差异(P>0.05,图1)。
2.2 血清miR-6861-5p表达与乳腺癌临床病理特征的关系
以血清miR-6861-5p相对表达量>8为高表达,≤8为低表达:112例乳腺癌患者血清miR-6861-5p低表达患者40例,高表达患者72例;miR-6861-5p在乳腺癌患者血清中表达与年龄、肿瘤直径无关(P>0.05),与淋巴结转移、ER、PR和HER-2表达、TNM分期、分子分型以及组织学分期显著相关(均P<0.05,表2)。
2.3 血清miR-6861-5p在乳腺癌肿瘤切除前后的变化
112例乳腺癌患者均经手术切除肿瘤组织进行治疗。对比手术前后血清miR-6861-5p相对表达量发现,111例乳腺癌患者术后血清miR-6861-5p表达下降,1例表达上升;术后112例乳腺癌患者miR-6861-5p相对表达量平均值为(6.76±1.60),显著低于术前水平(P<0.05,图2)。
2.4 血清miR-6861-5p对乳腺癌临床诊断的价值
miR-6861-5p诊断乳腺癌ROC曲线下面积(AUC)为0.781,当血清miR-6861-5p相对表达量为7.75时,约登指数取最大值,此时miR-6861-5p诊断乳腺癌敏感度为69.6%,特异度为77.8%(图3)。
2.5 miR-6861-5p与乳腺癌术后复发的关系
所有患者术后均进行为期2年的随访,记录患者术后乳腺癌肿瘤复发情况发现,血清miR-6861-5p低表达的乳腺癌患者术后1年、2年复发率分别为10.0%和22.5%,均显著低于血清miR-6861-5p高表达乳腺癌患者(22.2%和38.9%,P<0.05,图4)。
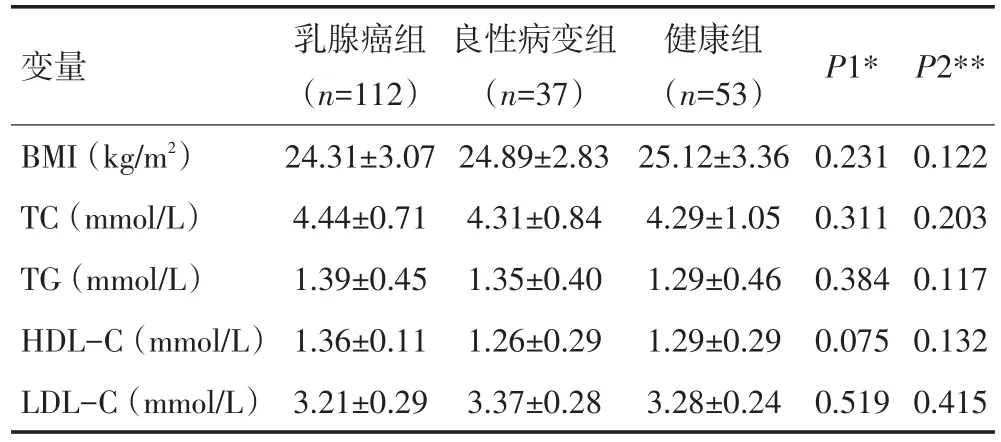
表1 3组研究对象一般资料比较 例

图1 miR-6861-5p在不同研究对象血清中的表达

表2 血清miR-6861-5p表达与乳腺癌临床病理资料的关系例(%)

图2 乳腺癌肿瘤切除前后血清miR-6861-5p变化

图3 ROC曲线分析血清miR-6861-5p对乳腺癌临床诊断价值

图4 miR-6861-5p与乳腺癌术后复发的关系
3 讨论
在血清/血浆中稳定的microRNA被认为是最具潜力的肿瘤生物标志物,在乳腺癌的研究中,多种miRNA被证实可以用于乳腺癌的临床诊断[11-14]。同时,典辉等[15]研究指出miR-127-3p在乳腺癌患者外周血中表达上调,并且其在乳腺癌患者血浆中的表达与乳腺癌肿瘤标志物CA153表达呈正相关,是一个乳腺癌潜在的肿瘤标志物。钟婧等[16]研究发现,miR-21在乳腺癌患者血清中不仅表达上调,而且与乳腺癌患者TNM分期和癌细胞转移等有关,诊断乳腺癌的敏感性高达80%,特异度70%。
本研究发现miR-6861-5p在乳腺癌患者血清中的表达量显著高于健康女性和乳腺良性病变女性患者(P<0.05),并且健康女性和乳腺良性病变女性患者血清 miR-6861-5p表达无显著性差异(P>0.05)。miR-6861-5p定位于人类染色体12q24.13,目前鲜见研究报道miR-6861-5p的功能,仅Shimomura等[17]在日本人群中筛查可用于乳腺癌早期诊断microRNA组合时发现,miR-6861-5p在乳腺癌患者血清中的表达显著高于健康女性,并且与血清miR-1246、miR-1307-3p、miR-6875-5p、miR4634联合诊断乳腺癌的敏感度和特异度分别高达97.3%和82.9%。而本研究miR-6861-5p单独诊断乳腺癌敏感度为69.6%,特异度为77.8%,由此提示血清miR-6861-5p检测对乳腺癌筛查具有一定的临床价值。
淋巴结转移、TNM分期和组织学分期均可描述乳腺癌严重程度和受累范围。本研究发现,淋巴结转移乳腺癌患者血清miR6861-5p高表达比例高达80.4%(37/46),而淋巴结未转移比例仅为53.0%(35/66)。有研究指出[18],由于乳腺并不是人体维持生活活动所必须的器官,所以原位乳腺癌的及时发现与治疗可以取得较好的临床疗效,并不危及患者的生命安全;但是与其他癌细胞一样,乳腺癌细胞也失去了正常细胞的生物学特性,细胞之间的黏连能力较低,容易出现脱落。一旦乳腺癌细胞出现脱落,游离的癌细胞可经血液或淋巴液播散全身,形成转移,危及患者生命,降低生存率。同时,血清miR-6861-5p高表达患者比例随临床分期升高而升高。左婷婷等[18]研究发现,Ⅰ期乳腺癌5年生存率高达90%,但Ⅲ~Ⅳ期乳腺癌却低于70%;乳腺癌患者5年生存率随临床分期升高而降低。
根据乳腺癌肿瘤组织ER、PR和HER-2的表达可将乳腺癌分为Luminia A型、Luminia B型、HER-2过表达型和Basal-like型。乳腺癌分子分型不仅可以指导乳腺癌患者的临床治疗,而且与患者临床治疗效果和预后有关,HER-2(+)过表达型和Basal-like型乳腺癌预后最差,Luminia B型次之,Luminia A型乳腺癌预后最好[19-20]。本研究中miR-6861-5p在乳腺癌患者血清中的表达与乳腺癌肿瘤组织ER、PR、HER-2表达以及乳腺癌分子分型有关,并且手术切除乳腺肿瘤组织miR-6861-5p表达会显著下调,低表达miR-6861患者术后肿瘤复发率较低,这提示检测乳腺癌患者血清miR-6861-5p对乳腺癌患者临床治疗和预后预测具有一定的指导意义。
综上所述,miR-6861-5p在乳腺癌患者血清中表达上调,是术前乳腺癌诊断、肿瘤分期、癌细胞转移和术后监测乳腺癌复发的潜在生物标志物。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].Ca A Cancer J Clin,2016,66(2):115‐132.
[2]易琳,刘兴明,林丁,等.血清CA153、CA125、CEA联合检测在乳腺癌诊断中的价值[J].重庆医科大学学报,2012,37(9):802‐805.
[3]Xia J,Shi J,Wang P,et al.Tumour‐Associated autoantibodies as di‐agnostic biomarkers for breast cancer:A systematic review and me‐ta‐analysis[J].Scand J Immunol,2016,83(6):393‐408.
[4]张帆,崔庆华.microRNA与人类疾病关系研究中的生物信息学方法和资源[J].生理科学进展,2016,47(3):203‐209.
[5]Kang L,Yang C,Song Y,et al.MicroRNA‐23a‐3p promotes the devel‐opment of osteoarthritis by directly targeting SMAD3 in chondro‐cytes[J].Biochem Biophys Res Commun,2016,478(1):467‐473.
[6]刘宁,徐波,梁寒,等.miRNA和恶性肿瘤研究进展[J].中国肿瘤临床,2010,37(7):416‐420.
[7]Li W,Liu C,Zhao C,et al.Downregulation of β3 integrin by miR‐30a‐5p modulates cell adhesion and invasion by interrupting Erk/Ets 1 network in triple‐negative breast cancer[J].Int J Oncol,2016,48(3):151‐159.
[8]Li W F,Dai H,Ou Q,et al.Overexpression of microRNA‐30a‐5p in‐hibits liver cancer cell proliferation and induces apoptosis by target‐ing MTDH/PTEN/AKT pathway.[J].Tumor Biology,2016,37(5):5885‐5895.
[9]张庆勇,李乾元,罗春华.肿瘤标志物外周血microRNA的研究进展[J].细胞与分子免疫学杂志,2015,31(3):419‐421.
[10]Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNAs as sta‐ble blood‐based markers for cancer detection[J].Proc Natl Acad Sci U S A,2008,105(30):10513.
[11]Cuk K,Zucknick M,Heil J,et al.Circulating microRNAs in plasma as early detection markers for breast cancer.Int J Cancer,2013,132(7):1602‐1612.
[12]Shen J,Hu Q,Schrauder M,et al.Circulating miR‐148b and miR‐133a as biomarkers for breast cancer detection[J].Oncotarget,2014,5(14):5284‐5294.
[13]魏倩,张鹏.乳腺癌患者癌组织、血清miR‐17‐5p水平变化及意义[J].山东医药,2015,55(16):54‐55.
[14]Sochor M,Basova P,Pesta M,et al.Oncogenic MicroRNAs:miR‐155,miR‐19a,miR‐181b,and miR‐24 enable monitoring of early breast cancer in serum[J].BMC Cancer,2014,14(1):448.
[15]典辉,库无非,何明长.miR‐127‐3P在乳腺癌患者中的表达及意义[J].肿瘤学杂志,2017,23(7):639‐642.
[16]钟婧,周伟民,马志红,等.微小RNA‐21在乳腺癌患者血清中的表达及其与临床病理特征的关系[J].中华实验外科杂志,2015,32(1):157‐159.
[17]Shimomura A,Shiino S,Kawauchi J,et al.Novel combination of se‐rum microRNA for detecting breast cancer in the early stage[J].Cancer Sci,2016,107(3):326‐334.
[18]左婷婷,陈万青.中国乳腺癌全人群生存率分析研究进展[J].中国肿瘤临床,2016,43(14):639‐642.
[19]赵毅,邓鑫.乳腺癌分子分型与治疗策略[J].中国实用外科杂志,2015,35(7):704‐708.
[20]李双,范红敏,肖菲菲,等.不同分子分型及临床病理特征与乳腺癌术后患者预后的关系[J].临床与实验病理学杂志,2016,32(1):39‐44.

