DT390与TMTP1融合蛋白靶向治疗卵巢癌的实验研究
叶双梅 马湘一 王世宣
卵巢癌是常见的妇科恶性肿瘤,由于早期症状不明显,多数患者临床确诊时已为晚期[1],死亡率高居女性生殖系统恶性肿瘤之首[2]。铂类药物如顺铂是目前卵巢癌治疗的主要药物之一,由于化疗不良反应较大及多药耐药性的出现,卵巢癌的化疗效果受限[3],患者的5年生存率仍无明显提高[4]。因此,迫切需要寻找新的有效治疗方法。靶向治疗能提高病灶局部的药物浓度,减少毒副反应,使药物能安全有效地发挥作用[5],在晚期肿瘤及难治性肿瘤的治疗方面显示了巨大的应用前景。本研究利用本课题组前期研究中发现的一种能特异性结合高转移潜能肿瘤细胞的新型靶向肽TMTP1,通过体内外实验探讨白喉毒素(diphtheria toxin,DT)片段DT390与靶向肽TMTP1的融合蛋白对卵巢癌的靶向治疗效果,为探索卵巢癌新的治疗方法提供理论基础。
1 材料与方法
1.1 材料
1.1.1 细胞 卵巢癌细胞株OV2008和C13*由加拿大渥太华癌症中心的Dr.Rakesh Goel赠送。
1.1.2 主要试剂 含有白喉毒素全长序列的质粒由本实验室保存。TMTP1靶向肽由西安华辰生物科技有限公司合成。MTT与Heochst 33342购自美国Sig⁃ma公司,Annexin V/PI和TUNEL细胞凋亡原位检测试剂盒均购自南京凯基生物科技发展有限公司,酶标仪购自美国Hyperion公司,激光共聚焦显微镜购自日本Olympus公司,流式细胞仪购自美国BD Biosci⁃ences公司,4周龄BALB/c nu/nu小鼠购自上海斯莱克实验动物有限责任公司。
1.2 方法
1.2.1 重组载体的构建及融合蛋白的制备与鉴定 DT390-TMTP1、DT390-biTMTP1和DT390-triT⁃MTP1三种重组载体的构建、融合蛋白的制备和鉴定的详细方法参照本课题组前期报道[6-7]。本研究制备了同样纯度高和活性较好的融合蛋白。
1.2.2 激光共聚焦显微镜观察 参照前期实验结果[6],将PBS以及3 μg/mL的TMTP1、DT390-TMTP1、DT390-biTMTP1和DT390-triTMTP1分别作用于C13*及OV2008细胞,5 h后加入Heochst 33342进行细胞核染色,激光共聚焦显微镜观察细胞核,拍照,存档。
1.2.3 MTT法 收集对数生长期的C13*及OV2008细胞,调整细胞浓度为1.6×104/mL,取500 μL接种于96孔培养板,实验组分别加入不同浓度(1、2、3、4、5 μg/mL)的TMTP1、DT390-TMTP1、DT390-biTMTP1和DT390-triTMTP1,每个浓度设3个复孔,空白对照组加等体积的PBS,调零组为不含细胞的等体积培养基,置37℃、5%CO2温箱培养24 h,每孔加入浓度为5 mg/mL MTT溶液10 μL,培养4 h,弃上清,每孔加入150 μL DMSO,置摇床上避光轻柔摇荡15 min,酶标仪检测490 nm波长各孔吸光度值,计算各组细胞存活率。存活率=(处理组平均吸光度/空白对照组平均吸光度)×100%。
1.2.4 流式细胞术 6孔板内接种处于对数生长期的C13*及OV2008细胞,调整融合度为50%~60%。分别加入4 μg/mL的TMTP1、DT390-TMTP1、DT390-biTMTP1和DT390-triTMTP1,每个浓度设3个复孔,对照组加等体积的PBS,作用24 h后,采用不含EDTA的胰酶消化收集细胞,调整细胞浓度为1×106/mL,取500 μL细胞悬液,800 r/min离心5 min,使用PBS洗涤细胞1次,加入500μLBindingBuffer,再分别加AnnexinV及PI各5μL,混匀,常温、避光反应10 min。1 h内上流式细胞仪检测。
1.2.5 动物实验 选用4周龄雌性BALB/c nu/nu小鼠25只,使用1 mL无菌注射器抽取细胞浓度为1.5×107/mL的C13*细胞悬液200 μL注射到裸鼠左侧大腿根部皮下,3天后将裸鼠随机分为5组,每组5只。分别腹腔注射PBS及TMTP1、DT390-TMTP1、DT390-biTMTP1和DT390-triTMTP1各10 μg,每3天注射1次,连续注射3周,每次注射前先用游标卡尺测量肿瘤最大径及最小径。注射2周后将各组裸鼠用乙醚麻醉后,拍照,观察成瘤率。最后一次测量皮下瘤后,断颈处死裸鼠,取出皮下瘤组织,4%多聚甲醛固定,石蜡包埋,制备厚8 μm的石蜡切片,计算每次测量的肿瘤体积[8]。V=4/3π×(d/2)2×(D/2),d代表肿瘤最小径值,D代表肿瘤最大径值,绘制肿瘤体积增长曲线。动物实验经华中科技大学同济医学院附属同济医院伦理委员会审查批准。
1.2.6 TUNEL法 石蜡切片按常规方法进行脱蜡和水化,按TUNEL试剂盒操作步骤检测裸鼠皮下瘤组织的细胞凋亡,室温下行DAB显色后使用苏木精复染细胞核,中性树胶封片,光学显微镜下观察凋亡细胞并拍照。采用H-Score法(H=I×P)对阳性表达进行半定量统计[9],其中I为染色强度,分为0(无着色)、1(弱阳性)、2(中等强度阳性)、3(强阳性),P为每张切片阳性染色细胞百分比。
1.3 统计学分析
所有实验数据均采用SPSS 13.5软件进行统计学分析。计量数据以表示,多组间比较采用ANO⁃VA单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 卵巢癌细胞核、细胞存活和凋亡的变化
激光共聚焦显微镜观察到DT390-biTMTP1和DT390-triTMTP1作用的C13*细胞发生了明显核碎裂,OV2008细胞发生了明显核皱缩(图1A)。MTT结果显示,不同浓度(1~5 μg/mL)的DT390-biTMTP1和 DT390-triTMTP1作 用 24 h,C13*(图 1B)和OV2008(图1C)细胞的存活率随着浓度增加而显著降低。同样,流式细胞术的结果显示4 μg/mL的DT390-biTMTP1及DT390-triTMTP1作用24 h,C13*(图2A)及OV2008(图2B)细胞的凋亡率显著高于对照组(P<0.05),并且DT390-biTMTP1组与 DT390-triTMTP1组的C13*细胞凋亡率为66.0%±12.0%与72.9%±4.6%,较OV2008细胞的55.5%±8.9%与65.1%±9.8%更高,而对照组、TMTP1组和DT390-TM⁃TP1组的细胞凋亡率无显著性差异(P>0.05)。

图1 各组卵巢癌细胞核及细胞存活率的变化

图2 流式细胞术检测各组细胞的凋亡率
2.2 裸鼠皮下瘤的形成率及生长曲线
与对照组的成瘤率100%相比,DT390-biTMTP1组的46.67%±11.55%和DT390-triTMTP1组的13.33%±11.55%受到显著抑制(P<0.01),而DT390-TMTP1组的成瘤率86.67%±11.55%和TMTP1组的100%与对照组比较无显著性差异(P>0.05,图3A)。肿瘤的生长曲线表明,DT390-biTMTP1和DT390-triTMTP1显著抑制了卵巢癌皮下瘤的生长(P<0.05),而TMTP1和DT390-TMTP1组与对照组比较差异均无统计学意义(P>0.05,图3B)。
2.3 TUNEL法检测裸鼠皮下瘤组织中细胞凋亡
DT390-biTMTP1组和DT390-triTMTP1组的卵巢癌皮下瘤组织的TUNEL阳性表达显著增强(图4A~E)。而TMTP1组以及DT390-TMTP1组的TUNEL阳性表达与对照组比较无显著性差异。H-Score评分结果显示,与对照组10±2相比,DT390-biTMTP1组的150±20和DT390-triTMTP1组的210±30的评分显著增加(P<0.05),而TMTP1组的10±8以及DT390-TM⁃TP1组的35±10与对照组比较无显著性差异(P>0.05,图4F)。

图3 各组裸鼠成瘤率和皮下瘤生长情况
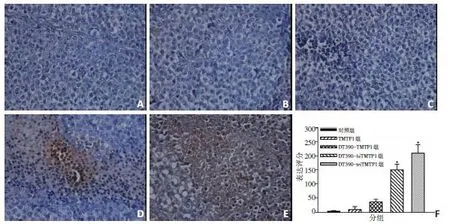
图4 TUNEL法检测各组裸鼠皮下瘤组织的细胞凋亡
3 讨论
卵巢癌发病隐匿,肿瘤标志物特异性不高,早期诊断困难,确诊时多为晚期,并且极易复发,治疗效果较差[1],患者5年生存率不超过40%[10]。耐药是导致卵巢癌治疗失败的关键因素,因缺乏围手术期有效的药物治疗,卵巢癌的病情无法从本质上得到控制和逆转。因此,开发有效的新药对改善卵巢癌患者的生存质量,提高患者的生存率具有十分重要的意义。近年来,将细胞毒性物质通过靶向分子运输到病灶局部发挥作用的治疗方法取得了令人鼓舞的临床效果,如靶向药物索拉非尼是目前国内外指南推荐的治疗晚期原发性肝癌的一线药物[11]。贝伐单抗、奥拉帕尼、尼拉帕尼等靶向药物在卵巢癌治疗中的应用,也为晚期及复发性卵巢癌患者的临床治疗带来了新的选择和曙光[1]。
白喉毒素是感染β噬菌体基因组的白喉棒状杆菌所产生的外毒素,具有极强的毒性[12]。基于白喉毒素的靶向药物已被广泛用于肿瘤、传染病、血液病等治疗,部分药物取得了良好的临床疗效。如ON⁃TAK,即白喉毒素与IL-2的融合蛋白DAB(389)IL-2早在1999年就被美国FDA批准上市用于治疗成人皮肤T细胞淋巴瘤[13]。
小分子靶向肽具有高效、组织穿透性好、毒性小、免疫原性低的特性,是制备靶向药物的理想材料[14]。本课题组前期发现了一种新型肽,由5个氨基酸组成(NVVRQ),命名为TMTP1,体内外实验都证实TMTP1结合高转移潜能肿瘤细胞,不能结合低转移潜能或不转移的肿瘤细胞[15]。本研究组前期采用基因工程技术制备DT390-TMTP1、DT390-biTMTP1以及DT390-triTMTP1融合蛋白,体内外实验结果显示DT390-biTMTP1和DT390-triTMTP1通过诱导细胞凋亡、抑制细胞增殖,显著抑制了前列腺癌和胃癌生长和转移,并且对荷瘤裸鼠腹腔注射DT390-triTMTP1后,该蛋白快速持续地聚集在肿瘤组织内,一过性出现在肝脏和肾脏组织,提示DT390-triTMTP1靶向治疗效果好,对正常组织的毒副反应低[6]。
本研究采用相同的方法制备了上述三种融合蛋白,通过体内外实验探索三者对卵巢癌的靶向杀伤作用,研究结果与前期[6]相似,即DT390-biTMTP1与DT390-triTMTP1均能显著抑制卵巢癌的发生和发展。并且,DT390-biTMTP1和DT390-triTMTP1对顺铂耐药细胞株的杀伤作用比对顺铂敏感细胞株更显著,提示在铂类耐药型卵巢癌的治疗方面,两种融合蛋白都具备良好的深入研究价值和临床转化潜能。同样,DT390-TMTP1也未能显示有效的治疗效果。原因可能是一个小分子量的TMTP1肽(5个氨基酸)难以带动相对巨大的DT390毒性分子(390个氨基酸)靶向结合并进入目标细胞内,或者是在DT390-TMTP1的空间构象中,DT390片段遮挡了TMTP1的结合位点,导致DT390-TMTP1不能与靶细胞结合。
综上所述,本研究通过体内外实验证实了DT390-biTMTP1及DT390-triTMTP1融合蛋白均有效抑制卵巢癌细胞增殖,诱导细胞凋亡,显著抑制卵巢癌的发生和发展,显示了良好的应用价值和治疗前景,为探索卵巢癌新的治疗方法提供了理论基础。
[1]严丽梅,李秀琴.2017肿瘤生物治疗最新进展暨"卵巢癌规范化、个体化、精准治疗高峰论坛"纪要[J].中国实用妇科与产科杂志,2017,33(8):874‐880.
[2]Legge F,Ferrandina G,Salutari V,et al.Biological characterization of ovarian cancer:prognostic and therapeutic implications[J].Ann Oncol,2005,16(Suppl 4):iv95‐101.
[3]申薇,梁冰锋,李秀荣,等.卵巢癌耐药细胞株SKOV3/DDP的建立及其与凋亡途径蛋白的关系[J].河北医科大学学报,2014,35(10):1135‐1139.
[4]Tse BW,Collins A,Oehler MK,et al.Antibody‐based immunothera‐py for ovarian cancer:where are we at[J]?Ann Oncol,2014,25(2):322‐331.
[5]Torchilin VP.Drug targeting[J].Eur J Pharm Sci,2000,11(Suppl 2):S81‐91.
[6]Ma X,Lv P,Ye S,et al.DT390‐triTMTP1,a novel fusion protein of diphtheria toxin with tandem repeat TMTP1 peptide,preferentially targets metastatic tumors[J].Mo Pharm,2013,10(1):115‐126.
[7]叶双梅.DT390与TMTP1融合毒素的构建及其靶向治疗高转移性肿瘤的研究[D].武汉:华中科技大学,2011.
[8]Benito V,Lubrano A,Arencibia O,et al.Laparoscopic extraperitone‐al para‐aortic lymphadenectomy in the staging of locally advanced cervical cancer:is it a feasible procedure at a peripheral center[J]?Int J Gynecol Cancer,2012,22(2):332‐336.
[9]Gatalica Z,Lele SM,Rampy BA,et al.The expression of Fhit protein is related inversely to disease progression in patients with breast carcinoma[J].Cancer,2000,88(6):1378‐1383.
[10]Huo YR,Richards A,Liauw W,et al.Hyperthermic intraperitoneal chemotherapy(HIPEC)and cytoreductive surgery(CRS)in ovarian cancer:A systematic review and meta‐analysis[J].Eur J Surg Oncol,2015,41(12):1578‐1589.
[11]胡秋月,余祖江.分子靶向治疗药物在原发性肝癌中的研究进展[J].国际消化病杂志,2017,37(1):20‐23.
[12]张景锋,朱宽佑,徐秋良,等.白喉毒素作用机制及其应用的研究进展[J].畜牧与饲料科学,2017,38(10):33‐37.
[13]Lansigan F,Stearns DM,Foss F.Role of denileukin diftitox in the treatment of persistent or recurrent cutaneous T‐cell lymphoma[J].Cancer Manag Res,2010,2:53‐59.
[14]Landon LA,Zou J,Deutscher SL.Is phage display technology on tar‐get for developing peptide‐based cancer drugs[J]?Curr Drug Dis‐cov Technol,2004,1(2):113‐132.
[15]Yang W,Luo D,Wang S,et al.TMTP1,a novel tumor‐homing peptide specifically targeting metastasis[J].Clin Cancer Res,2008,14(17):5494‐5502.

