杉木种鳞石蜡切片工艺优化研究
左丹丹 熊 升 李 佳 饶丽莎 林思祖 陈 宇
(1. 福建农林大学林学院,福建 福州 350002;2. 国家林业局杉木工程技术研究中心,福建 福州 350002)
杉木 (Cunninghamialanceolata),是我国南方重要的优良造材树种,具有重要的经济价值。裸子植物种鳞是球果的主要组成部分,不仅与被子植物花瓣一样起到保护作用,还能进行光合作用,为种子发育提供养分。学者通过对初级种子园杉木、第1代、1.5代、第2代、第3代杉木种子园的杉木球果进行了大量研究,并将其与种子性状联系起来[1-7],结果表明种子质量与球果形态具有相关性,但种子质量与杉木种鳞内部细胞结构的相关性研究极为缺乏,因此,开展对杉木种鳞微结构的深入研究非常有必要。
石蜡切片具有成本低、制片薄、切片连续且可永久保存等优点,在植物器官发育及其解剖学研究中应用广泛[8],但不同材料的软硬条件不同,要得到理想的效果,必须对切片工艺进行不断摸索,从而找到最适合的制片条件[9-10]。杉木种鳞表面含有较厚的蜡质层,且木质化严重,采用常规石蜡切片法,则很难得到完整的蜡带。如果试图通过石蜡切片方法观察杉木种鳞的内部解剖结构,石蜡切片工艺的改良就尤为重要。本研究以杉木种鳞为实验材料,在常规石蜡切片工艺的基础上,根据杉木种鳞的结构特性,通过对软化、脱水、透明、浸蜡等步骤进行系列优化与改进,以期建立适合杉木种鳞的石蜡切片工艺,为进一步研究杉木种鳞发育过程提供新的实验方法和手段。
1 材料与方法
1.1 样品采集
本研究以生长于福建省三明市尤溪县国有林产的杉木球果为材料,选择生长良好、无病虫害发生的植株,在1年生枝条或当年生新梢上,采摘良好无病态的球果作为实验材料。采样时间为2016年6月中旬。对采摘的球果进行人工剥取,分样贴好标签后置入固定液中抽气处理,随后固定3 d以上,放入4 ℃冰箱备用。实验在福建农林大学海峡联合研究院基因组中心开展,于2016年7月份进行。
1.2 试验方法
1.2.1固 定
将剥取的新鲜材料进行人工分割成1 cm × 0.5 cm小块,立即放入已配好的2种固定液中:FAA固定液:70%乙醇90 mL + 冰醋酸5 mL + 甲醛5 mL;FPA固定液:70%乙醇90 mL + 丙酸5 mL + 甲醛5 mL。分别抽气3次,每次5 min,抽气后更换新鲜固定液于4 ℃冰箱固定保存。由于种鳞材质较硬,试验中材料与固定液的比值 ≥ 1∶20,且固定时间 ≥ 3 d,以免细胞固定不彻底。
1.2.2软 化
对于材料的软化处理,应选择最适合杉木种鳞材质的方法。本研究设计了3种软化方法,分别为甘油-乙醇软化法、乙二胺浸泡法[11-12]和盐酸浸泡法[13],并用未软化处理的样品做对照,见表1。
1.2.3脱水与透明
软化结束后将材料充分洗涤后进行脱水、透明处理。因为杉木种鳞表面具有很厚的蜡质层,鉴于此,本实验设计了不同的脱水和透明时间,具体见表2。

表1 不同软化处理Table 1 Different softening treatments

表2 脱水与透明处理Table 2 Dehydration and transparent optimization
1.2.4浸 蜡
在石蜡切片的制备过程中,浸蜡的目的是让石蜡缓慢渗入到组织内从而将透明剂代替出来,一般按照从低温到高温顺序进行, 是切片制备关键步骤之一,因此对工艺优化至关重要。
1.2.5包 埋
此操作在徕卡包埋机上进行。用A4纸折成适当大小的纸盒,接入纯蜡,置于冷凝台,立即将材料放入盒中,用热镊子摆正材料,放在固定统一的位置,将要切的面置于底部。静置至石蜡凝固,期间应补蜡2~3次,以免石蜡凝固后凹陷,不利于后期试验的进行。
1.2.6修块、粘固
将包埋好的蜡块撕去纸盒,进行修块。将蜡块修成梯形,上、下两面修成平行面 (以便切出的蜡带完整),将修整好的蜡块固定在包埋盒上。
1.2.7切片、粘片、展片
粘固好的蜡块进行切片,切片厚度为10 μm。切出长度合适的蜡带,用牙签挑到40 ℃的粘片机中,将蜡带展开;使载玻片垂直插入水中,再用牙签轻挑到载玻片上,将玻片放置于40 ℃的展片台上,最后将合格的切片转入40 ℃温箱中烘干。
1.2.8染 色
番红固绿染色是一个需要探索的过程,染料的浓度、时间都需要依材料来改进。本实验针对染色中番红、固绿不易着色现象进行改进,对比染料的不同浓度、时间及其染色结果,从而选出最优染色方法。如表3所示,试验1号采用普通番红,试验2号采用改良版番红进行染色。 (此番红为索莱宝公司推出的改良版番红,较其他番红而言,颜色更正,着色时间短、力度强,大大缩短试验时间,提高效率。)

表3 染色优化处理Table 3 Dye optimization
1.2.9封片、烘片
中性树胶封片,封片后将玻片置于55 ℃温箱中烘2~3 d。
1.2.10显微观察与摄影
通过徕卡DMi8倒置显微镜对烘干制片的切片进行观察,对所需切片进行拍照。
2 结果与分析
2.1 不同固定液固定效果比较
如图1a、1b所示,无论是FAA固定液还是FPA固定液固定的材料,经切片后,细胞结构均完整,轮廓清晰,无萎缩变形现象,细胞核和淀粉粒相对完整,表明这2种固定液都适合于杉木种鳞石蜡切片的前固定。
2.2 不同软化处理方法效果比较
对经过不同软化处理的种鳞进行石蜡切片,并与未经软化处理的种鳞进行对比。结果可见:乙醇甘油溶液浸泡的材料切片后,材料破碎,无法得到完整蜡带 (图2a),与未软化处理的对照组差异不明显 (图2d);经乙二胺浸泡处理后的材料能够与石蜡融合,但内部仍有部分木质化,且细胞皱缩变形严重 (图2b);经盐酸溶液浸泡12 h的种鳞能够与石蜡融合,且可以得到连续的蜡带 (图2c)。由以上结果可知,采用12 h盐酸溶液浸泡这一软化处理即为最优处理。

图12种固定液对杉木鳞片固定效果比较
Fig.1 Comparison of 2 kinds of fixative solution on fixation effect ofC.lanceolatascales
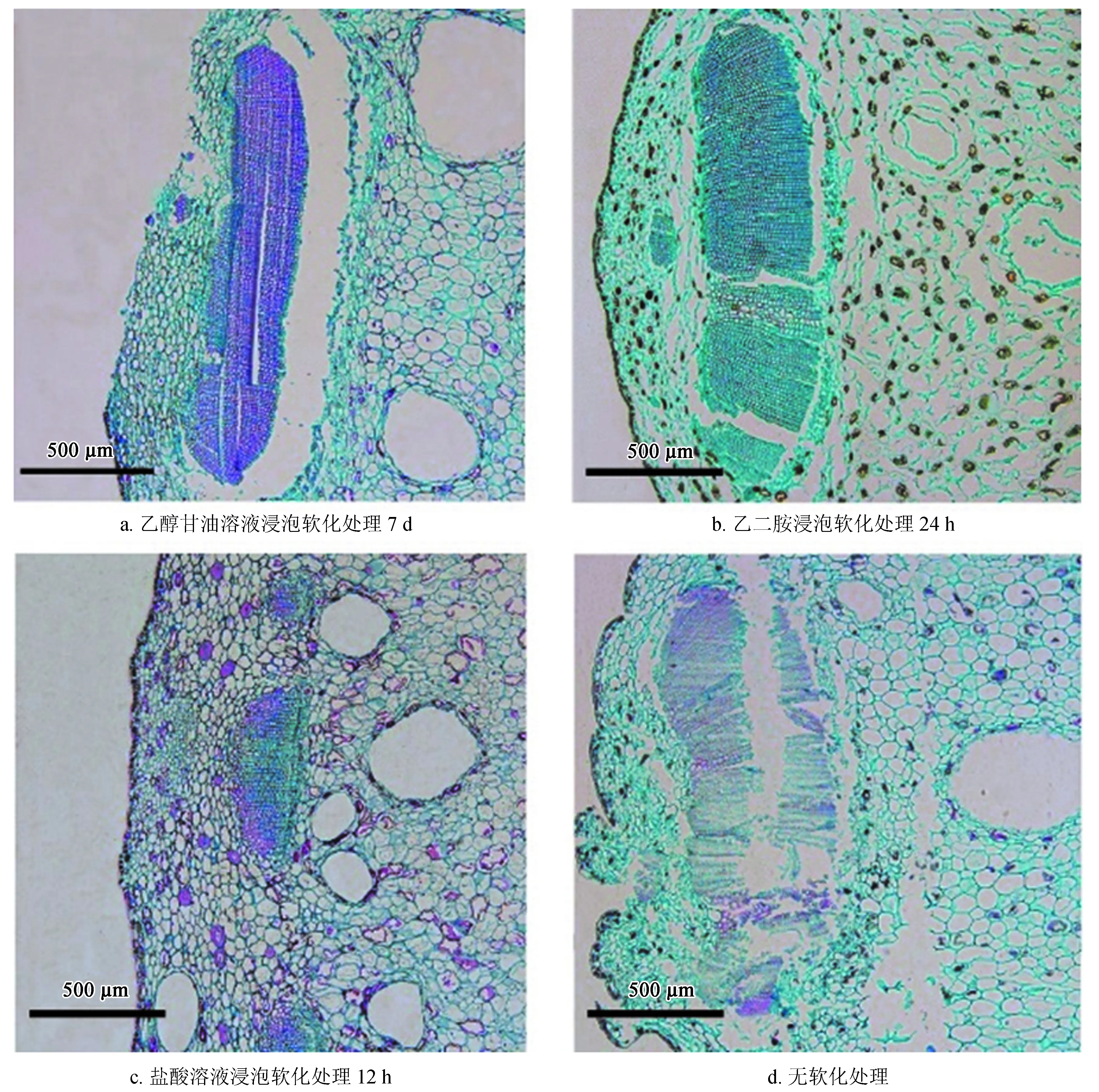
图2不同软化方法对杉木鳞片软化效果比较
Fig.2 Comparison of different softening methods on softening effect ofC.lanceolatascales
2.3 不同脱水和透明方法比较
通过表2中的几种脱水、透明处理,结果发现:1号脱水时间为1 h的处理组,将材料放入纯二甲苯时有大量白色沉淀出现;2号脱水时间为每级1.5 h的处理组,当材料放入纯二甲苯时出现少量沉淀;3号、4号脱水时间分别为每级2、2.5 h的处理组,未见沉淀出现。这表明 1、2号处理的材料在乙醇梯度中脱水不彻底,这会严重影响后续的透明和浸蜡环节。对3号、4号材料的切片观察,由图3b可见,4号处理切片时出现蜡带不完整,材料破碎现象,表明4号脱水、透明时间过久,导致材料偏脆,影响后期的切片。因此,杉木种鳞脱水、透明最优时间为3号,其中脱水每级为2 h (100%乙醇分2次),可将材料彻底脱水;透明每级1 h,且透明过程逐级细分为5步,既不会使材料变脆,又能很好的达到透明效果,由图3a可见材料细胞完整,无变形破碎现象。
2.4 不同浸蜡方式和时间效果比较
浸蜡效果与蜡的选择、浸蜡次数和时间的选择均相关。可先选择低熔点的54 ℃石蜡,再选择熔点高的60 ℃石蜡,这2种蜡均需提前熔化过滤备用。在装有材料的青霉素小瓶中加入2/3二甲苯、1/3石蜡 (熔点54 ℃),放入45 ℃烘箱中过夜;次日将已熔石蜡及二甲苯倒出 (用回收瓶收好,切勿倒入池中,以免堵塞管道),再加入1/3二甲苯、2/3石蜡 (熔点54 ℃),置于50 ℃烘箱3 h;倒空后加入已熔好的纯石蜡 (60 ℃),转入65 ℃烘箱,之后每6~12 h换1次纯蜡,换2~3 d即可。
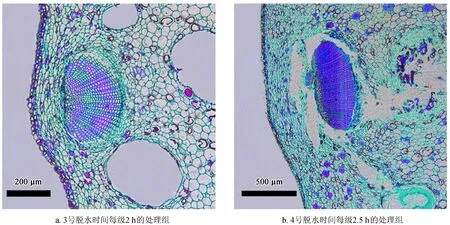
图3不同脱水、透明对杉木鳞片软化效果比较
Fig.3 Comparison of different dewatering and transparence on softening effect ofC.lanceolatascales
2.5 不同染色方法效果比较
染色也是至关重要的一个环节。染色前要对切好的切片进行脱蜡、复水,脱蜡一定要彻底。将装有切片的染色架放入65 ℃烘箱5~10 min,蜡带熔化后,立即转入纯二甲苯中进行脱蜡。完成脱蜡、复水后立即开始染色,图4a为传统方法染色,细胞核、表皮细胞和木质部等均无着色,只有细胞壁染成绿色;图4b为采用改良的番红固绿试剂进行染色,大大提高了番红的着色时间和牢固性,只需染色20 min,细胞核、表皮细胞和木质部等即可染成鲜红色。其具体步骤为:烘蜡 (5~10 min)→ 纯二甲苯 (20 min,2次)→ 1/2二甲苯 + 1/2乙醇 (5 min)→ 无水乙醇 (2 min)→ 无水乙醇 (2 min)→ 95%乙醇 (2 min)→ 85%乙醇 (2 min)→ 70%乙醇 (2 min)→ 1%番红 (20 min)→ 70%乙醇 (3 min)→ 85%乙醇 (3 min)→ 95%乙醇 (3 min)→ 固绿 (1 min)→ 95%乙醇 (2 min)→ 无水乙醇 (2 min)→ 无水乙醇 (2 min)→ 无水乙醇 (2 min)→ 1/2二甲苯 + 1/2乙醇 (2 min)→ 纯二甲苯 (2 min,2次)。
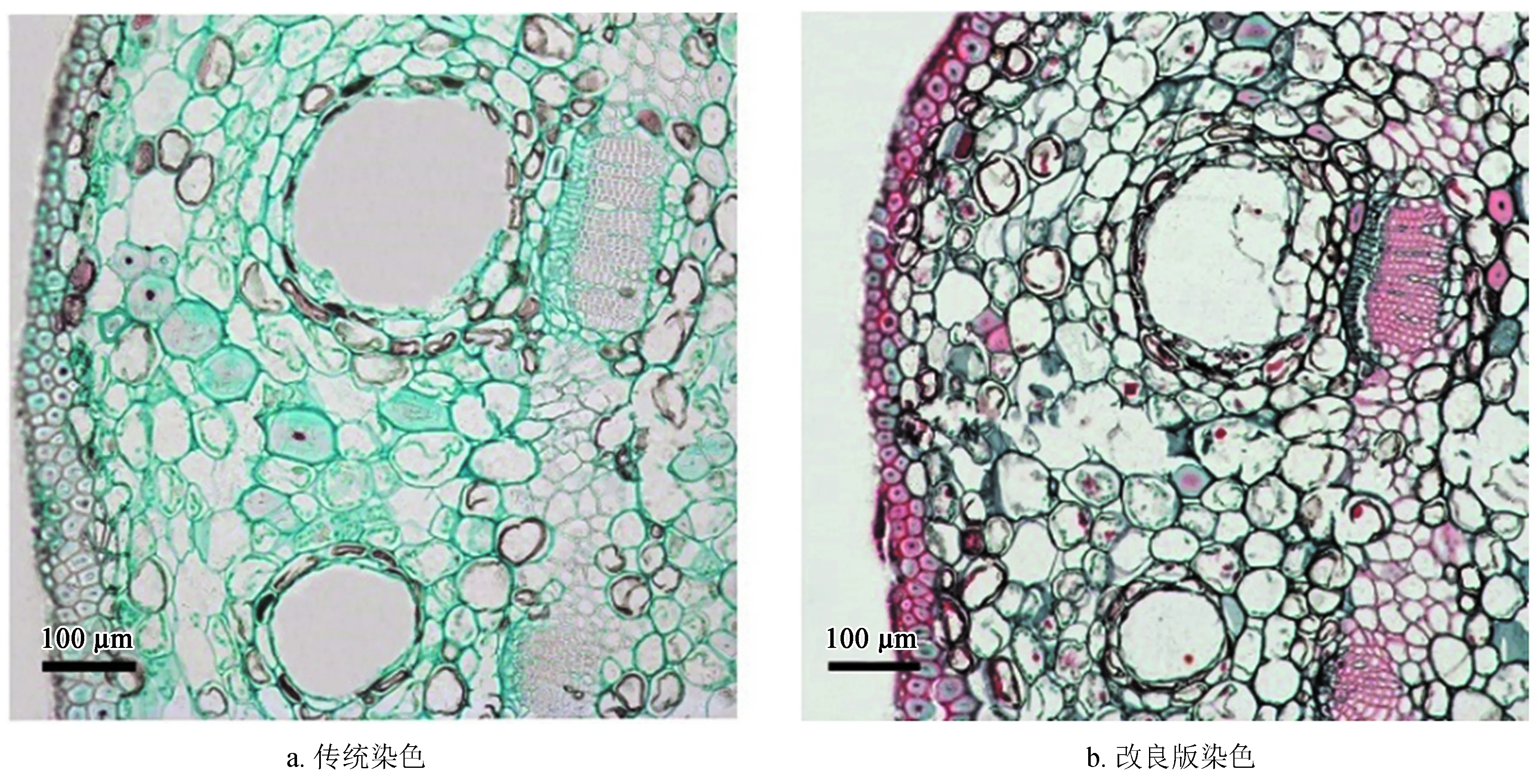
图4不同处理对杉木鳞片染色效果比较
Fig.4 Comparison of different treatments on dyeing effect ofC.lanceolatascales
3 结论与讨论
目前国内外有关裸子植物种鳞解剖学研究较少,而杉木种鳞的细胞学研究更是极为罕见,适合种鳞的石蜡切片技术尚未见报道,有关杉木的解剖学和细胞学研究都停留在杉木叶片上[14-16]。本研究着眼于杉木种鳞这一组织入手,针对杉木球果木质化且蜡质层厚的特点,对传统石蜡切片工艺进行优化改良,最终得出杉木种鳞石蜡切片的优化工艺。并应用此优化工艺,以杉木种鳞为实验材料,通过取材、固定 (FAA或FPA固定液)、盐酸浸泡软化、乙醇梯度脱水、二甲苯梯度透明、浸蜡、包埋、修块、切片、染色、封片、拍照等步骤,制备出完全符合组织精准观察、结构清晰完整的杉木种鳞细胞结构图。通过此研究可得出杉木种鳞石蜡切片的优化工艺为:FAA固定液固定 → 盐酸溶液浸泡软化处理12 h → 2 h分级脱水 → 1 h分级透明 → 2/3二甲苯、1/3石蜡 (熔点54 ℃),45 ℃烘箱过夜 → 1/3二甲苯、2/3石蜡 (熔点54 ℃),50 ℃烘箱3 h,→ 纯石蜡 (60 ℃),65 ℃烘箱,每6~12 h换一次纯蜡,重复2~3 d → 烘蜡 (5~10 min)→ 纯二甲苯 (20 min,两次)→ 1/2二甲苯 + 1/2乙醇 (5 min)→ 无水乙醇 (2 min)→ 无水乙醇 (2 min)→ 95%乙醇 (2 min)→ 85%乙醇 (2 min)→ 70%乙醇 (2 min)→ 1%番红 (20 min)→ 70%乙醇 (3 min)→ 85%乙醇 (3 min)→ 95%乙醇 (3 min)→ 固绿 (1 min)→ 95%乙醇 (2 min)→ 无水乙醇 (2 min)→ 无水乙醇 (2 min)→ 无水乙醇 (2 min)→ 1/2二甲苯 + 1/2乙醇 (2 min)→ 纯二甲苯 (2 min,2次)。
杉木种鳞的横切面由表皮、下皮层、转输组织、维管组织系统组成。种鳞最外层为表皮细胞,细胞壁显著加厚并强烈木质化,气孔在远轴面和近轴面的表皮均有分布,保卫细胞下陷到下皮层;下皮层在表皮细胞下方,是一层矩形木质化细胞,可防止水分蒸发,还能使种鳞具有坚挺的性质;杉木种鳞与叶片不同,无栅栏组织,传输组织发达,近轴面细胞小于远轴面细胞,该组织中分布着大小不一的多个树脂道;种鳞有多个维管束,构成维管组织,木质部在近轴面,韧皮部在远轴面。
对植物组织进行石蜡切片观察前,由于不同植物的软硬程度不同,因此要对木质化严重的植物组织进行软化处理,从而使乙醇等脱水剂、二甲苯等透明剂、石蜡等能彻底进入植物组织中,才能得到较好的切片[17-18]。杉木种鳞随着球果的生长会逐渐木质化,蜡质层增厚,如对固定后的种鳞不进行软化处理,则会脱水、透明不彻底,切片时会出现粉末状碎屑,难以得到完整蜡带,因此在杉木种鳞石蜡切片的制作过程中软化处理这一环节至关重要。本研究中的乙醇甘油溶液浸泡法耗时久且效果差;经过乙二胺浸泡处理后的材料细胞容易皱缩变形;经过盐酸溶液浸泡后的种鳞能够与石蜡融合,且可以得到连续的蜡带,但盐酸腐蚀性强,对时间和浓度把握很重要。
脱水和透明是石蜡切片技术中关键的步骤。脱水时间如果过短会脱水不彻底,时间过长则使材料变硬;用二甲苯透明时,时间过长会导致材料变脆[13],切片时材料易破碎,无法得到完整的切片。本研究参照权金娥等[11]对四倍体刺槐茎段组织石蜡切片以及李谨谨等[12]对乌饭树茎段组织石蜡切片过程中脱水和透明方法,对杉木种鳞脱水和透明时间优化处理:50%乙醇 (2 h)→ 70%乙醇 (过夜)→ 85%乙醇 (2 h)→ 90%乙醇 (2 h)→ 95%乙醇 (2 h)→无水乙醇 (1 h, 2次),可将材料彻底脱水;透明时间为每级1 h,且透明过程逐级细分为5步:V(无水乙醇)∶V(二甲苯)=3∶1 (1 h)→V(无水乙醇)∶V(二甲苯)=1∶1 (1 h)→V(无水乙醇)∶V(二甲苯)=1∶3 (1 h)→纯二甲苯 (1 h, 2次),既不会使材料变脆,又能很好的达到透明效果。
浸蜡这一环节在石蜡切片工艺中同样重要,浸蜡对蜡质、浸蜡次数及时间的选择均有关。本研究先选择低熔点石蜡,再选择高熔点石蜡,从低温到高温顺序进行,使石蜡慢慢渗入到组织内而将二甲苯替代出来。延长浸蜡时间、提高浸蜡温度、采取多次添加的方法,可有利于石蜡与材料充分融合,切出完整蜡带。
在染色过程中,选用番红固绿染色最为常见[19]。传统番红固绿染色常会出现番红或固绿不上色现象,耗时久、效果差。本实验根据杉木种鳞木质化严重的问题,用番红着色,并采用改良版番红染色剂,大大缩短了番红染色时间,20 min即可保证番红能很好的着色,并通过镜检有效延长或缩短后续洗色时间;固绿着色快,一般30 s即可,可通过镜检判断染色深浅来适当缩短或延长时间,从而得到染色效果较好的切片。
[1] 林平, 张卓文, 管圣全, 等. 姥山林场杉木初级种子园球果类型及其种子分布特征[J]. 浙江林学院学报, 1990, 7(4): 69-72.
[2] 陈晓阳, 李文刚, 潘奇敏, 等. 杉木种子园球果解剖性状的研究[J]. 北京林业大学学报, 1996, 18(3): 42-48.
[3] 张卓文. 杉木种子园无性系球果及其种子分布特征[J]. 福建林学院学报, 2004, 24(1): 45-49.
[4] 陈苏英, 马祥庆, 吴鹏飞, 等. 1.5代杉木种子园不同无性系生长和结实性状的评价[J]. 热带亚热带植物学报, 2014, 22(3): 281-291.
[5] 邓伯龙, 陈瑞生, 石杨文, 等. 杉木二代种子园自由授粉球果解剖性状分析[J]. 种子, 2006, 25(6): 71-72.
[6] 赖旭恩, 王润辉, 胡德洽, 等. 杉木2代种子园半同胞子代测定林生长分析[J]. 广东林业科技, 2013, 29(1): 47-50.
[7] 郑新华. 杉木第3代种子园不同家系种子质量评价[J]. 亚热带农业研究, 2015, 11(2): 95-100.
[8] 叶宝兴, 毕建杰, 孙印石. 植物细胞与组织研究方法[M]. 北京: 化学工业出版社, 2011.
[9] Barbosa A C F, Pace M R, Witovisk L, et al. A new method to obtain good anatomical slides of heterogeneous plant parts[J]. Iawa Journal, 2010, 31(4): 373-383.
[10] Carlquist S. The Use of Ethylenediamine in softening hard plant structures for paraffin sectioning[J]. Stain Technology, 1982, 57(5): 311.
[11] 权金娥, 朱海兰, 张春霞, 等. 四倍体刺槐茎段组织石蜡切片的制作方法[J]. 西北林学院学报, 2014, 29(3): 140-144.
[12] 李瑾瑾, 张敏, 周鹏, 等. 乌饭树茎段组织的石蜡切片制作技术研究[J]. 西北林学院学报, 2017, 32(2): 174-179.
[13] 李泽华, 王丹, 姚天月, 等. 费约果花芽石蜡切片技术的改良[J/OL]. 中国农学通报, 2016, 32(17): 35-39. (2016-05-26)[2017-08-10]. http://kns.cnki.net/kcms/detail/11.1984.s.20160526.2020.002.html.
[14] 任世奇, 卢翠香, 邓紫宇, 等. 南方4个速生树种叶片形态与气孔结构特性研究[J]. 广西林业科学, 2016, 45(2): 119-124.
[15] 陈奋学, 黄华宏, 童再康, 等. 矮生杉木的解剖特性[J]. 浙江林学院学报, 2008, 25(5): 619-623.
[16] 马清温. 杉科植物的表皮结构及其气孔参数分析[D]. 北京: 北京林业大学, 2005.
[17] 张军周, 勾晓华, 赵志千, 等. 树轮生态学研究中微树芯石蜡切片制作的方法探讨[J]. 植物生态学报, 2013, 37(10): 972-977.
[18] Day R C. Laser microdissection of paraffin-embedded plant tissues for transcript profiling[J]. Methods in Molecular Biology, 2010, 655: 321-346.
[19] 王秀文. 石蜡切片法中染色技术的改良[J]. 植物研究, 2015, 35(1): 158-160.

