BRAF VE1抗体在检测结直肠癌BRAF V600E基因突变中的应用
(青岛大学附属医院病理科,山东 青岛 266003)
BRAF基因是RAF家族成员,其基因突变可以激活下游的信号传导通路,导致细胞增殖与调节功能紊乱,从而促进肿瘤的发生[1-2]。研究显示结直肠癌中BRAF的突变率为5%~20%,其中90%以上为V600E突变[3-4]。BRAF V600E不仅是散发性微卫星不稳定性结直肠癌的重要标记物[5-6],且其与结直肠癌病人预后相关[7-8],并能预测靶向药物的疗效[9-11]。因此,对BRAF突变进行准确和快速检测,对结直肠癌病人的诊断及治疗有着重要的意义。大量研究表明,BRAF VE1免疫组化抗体检测甲状腺乳头状癌及黑色素瘤中BRAF V600E基因突变具有较高的灵敏度及特异度[12-14]。而目前关于BRAF VE1抗体检测结直肠癌中BRAF V600E基因突变的研究结果却存在很大的争议,主要表现在特异度较低[15]、癌组织的非特异性的细胞核及正常腺体着色[16-17]。而且其优化的染色条件也需要进一步研究。本实验采用全自动免疫组化染色仪探讨合适的BRAF VE1抗体免疫组化染色条件,并评估免疫组化方法检测结直肠癌BRAF V600E基因突变的诊断灵敏度和特异度。现将结果报告如下。
1 材料与方法
1.1 材料
随机收集我院病理科2014—2016年接受手术治疗的116例原发性结直肠癌病人的标本。病人手术前均未行放化疗及靶向治疗;标本均经常规病理诊断确诊。
1.2 免疫组化染色及判断标准
1.2.1免疫组化染色 标本经40 g/L中性缓冲甲醛溶液固定,常规脱水,石蜡包埋,3 μm厚切片。采用Benchmark XT(Roche公司)全自动免疫组化仪对切片进行BRAF V600E(鼠单克隆,克隆号VE1,货号790-4855,Roche公司)免疫组化染色。具体步骤:切片72 ℃脱蜡4 min,氧化抑制4 min,然后以EDTA缓冲液(pH 8.0) 99 ℃抗原修复32 min(其中4例经过测序证实V600E状态的标本,包括2例BRAF V600E突变型,2例BRAF V600E野生型,抗原修复时间分别为24、32、40、48、56和64 min,并采用抗BRAF V600E(VE1)鼠单克隆抗体进行BRAF V600E蛋白检测);OptiView HRP Linker孵育12 min;然后OptiView HRP multimer再孵育12 min;苏木素染色4 min、蓝化、梯度乙醇脱水、二甲苯透明、封片。
1.2.2免疫组化染色判断标准 阴性(-):肿瘤细胞胞浆无着色;弱阳性(+):肿瘤细胞胞浆呈淡黄色;中等阳性():肿瘤细胞胞浆呈黄色;强阳性():肿瘤细胞胞浆呈棕褐色[16]。
1.3 DNA提取
选取与免疫组化同一个石蜡包埋标本8 μm厚切片5张,根据DNA提取试剂盒(北京天根生物科技有限公司,货号DP305)说明书提取基因组DNA。
1.4 ARMS法检测BRAF V600E基因突变
加入DNA模板的量及反应条件均按人BRAF突变检测试剂盒(上海源奇生物科技有限公司,货号CB300026M)说明书要求,最终反应结果按其提供的判断标准确定标本BRAF基因突变状态。
1.5 Sanger测序检测BRAF V600E基因突变
检测用引物序列如下,F:5′-TCATCCTAACA-CATTTCAAGCC-3′,R:5′-GTAAAACGACGGC-CAGTTTTGTGAATACTGGGAACTATGAAA-3′。DNA扩增以及测序按照BRAF V600E基因突变检测试剂盒(上海源奇生物科技有限公司,货号CB-300026M)说明书进行操作。应用ABI3500Dx配套的软件系统Sequencing 5.4分析测序的结果,与BRAF V600E基因组DNA序列(HGNC:1097)进行对比,确定有无突变。
2 结 果
2.1 最佳抗原修复时间
本研究4例经Sanger测序证实V600E状态的标本,在24、32、40、48、56和64 min的抗原修复时间下用全自动免疫组化仪进行染色。结果显示,修复时间32 min时,染色效果最好,定位准确,非特异性着色少见(图1A~L)。
2.2 免疫组化及ARMS法检测BRAF V600E结果的比较
免疫组化结果示,116例结直肠癌组织中,4例BRAF V600E蛋白阳性表达,其中强阳性1例,中等阳性2例,弱阳性1例;阴性表达112例(图2A~D)。ARMS方法检测的结果显示,3例为BRAF V600E突变型,该3例标本免疫组化检测显示为中等阳性以及强阳性,而免疫组化为弱阳性的标本,ARMS检测为BRAF野生型。免疫组化阴性的标本,ARMS法也均为阴性。将4例免疫组化阳性的标本用Sanger测序法进行验证,结果与ARMS检测结果相同,即免疫组化弱阳性表达的组织证实为野生型,其余3例为V600E突变型。与基因检测法比较,结直肠癌中BRAF V600E免疫组化法诊断的灵敏度为100%(3/3),诊断特异度为99.1%(112/113),阳性预测值为75%(3/4),阴性预测值为100%(112/112)。两种方法检测结果的一致性为99.1%(115/116)。
3 讨 论
目前检测BRAF基因突变最常用的检测方法是ARMS-PCR法和Sanger测序法等[18]。由于分子检测需要提取肿瘤组织的DNA,不仅成本高,而且费时费力,更需要专门的实验室、专业仪器及严格的质量控制[10-19]。相比于以上方法,免疫组化技术具有稳定、快速、敏感、易于质控等优势,因此利用免疫组化对BRAF基因突变进行检测具有良好的应用前景[20-21]。
本实验用全自动免疫组化染色仪探讨结直肠癌组织最佳的BRAF VE1抗体免疫组化染色条件,然后对116例结直肠癌组织进行BRAF免疫组化染色和分子检测,评估免疫组化诊断的灵敏度的和特异度。结果显示VE1抗体检测BRAF V600E基因突变最适宜的抗原修复时间为32 min。在此条件下对结直肠癌组织进行BRAF V600E免疫组化检测,其诊断的灵敏度可达100%,特异度达99.1%,免疫组化和分子检测一致性高达99.1%。而且,国外研究显示,单纯手工染色,也能使免疫组化获得良好的表达效果[16]。因此,在没有分子实验室的基层病理科,只要严格控制免疫组化的条件,免疫组化可以作为初步筛查BRAF V600E的良好手段。
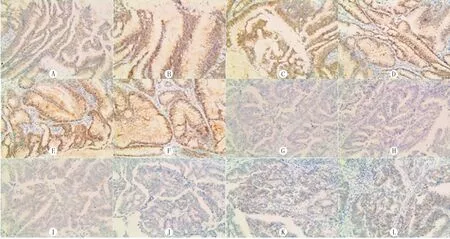
A~F:24、32、40、48、56和64 min修复时间时结直肠癌BRAF V600E突变型标本免疫组化染色情况;G~L:24、32、40、48、56和64 min修复时间时结直肠癌BRAF V600E野生型标本免疫组化染色情况。免疫组化染色法,200倍。
图1不同抗原修复时间结直肠癌BRAFV600E标本免疫组化染色情况

A:阴性染色标本;B:弱阳性染色标本;C:中等阳性染色标本;D:强阳性染色标本。免疫组化染色法,200倍。
研究表明,BRAF免疫组化需要严格的组织前处理条件和染色条件,如固定剂、固定时间和抗原修复液的pH值[16,22-23]。有研究证实,VE1抗体修复液最适合的pH值为8.0[16,24]。但是对于抗原修复的时间,还没有明确研究报道。本研究结果显示,Benchmark XT全自动免疫组化仪进行肠癌组织BRAF染色最佳的修复时间是32 min,低于我们科室甲状腺乳头状癌的修复时间(64 min)。如果应用甲状腺乳头状癌组织的免疫组化程序(抗原修复64 min)对肠癌组织进行染色,其非特异性着色会增加。来自南方医科大学的研究显示,肠癌组织抗原修复时间长于甲状腺癌组织[25],与我们的结论不一致,这可能和组织的前处理、不同的抗原修复条件及抗体浓度等有关。但该报道显示免疫组化法检测BRAF V600E的特异度低,仅为62.9%,我们推测可能和修复时间过长导致非特异性着色增加有关。相关研究显示,加热可以促进抗原暴露抗原决定簇[22,26]。在偏中性及酸性环境中,暴露的多肽冷却后更易折叠而隐藏抗原决定簇,在弱碱性环境中暴露的多肽带负电荷而阻止抗原决定簇的折叠。因此弱碱性条件有利于BRAF蛋白的修复。相比于甲状腺,肠组织有着偏碱性的外周环境,这可以在一定程度上解释为什么肠组织相比于甲状腺需要更少的抗原修复时间。但是在黏液腺癌中,可能是碱性太强,细胞核的非特异性着色依然存在,KUAN等[16]的研究也显示,过碱性(pH 9.0)的修复液也会导致非特异性着色。但是非特异性着色的具体原因仍需要更深入的探讨。
免疫组化应用于临床之前需要严格而准确的评分系统。大部分研究都采用强阳性()、中等阳性()、弱阳性(+)及阴性(-)的评分标准[24,27-28],但是也有研究以阳性肿瘤细胞百分率作为评价的标准[29-30]。我们认为,由于评判结果难以统一,按照阳性肿瘤细胞百分率作为评价标准的方法并不太适合于临床病理诊断。本实验结果显示,免疫组化中强阳性的标本,PCR阳性,免疫组化阴性的标本,PCR也阴性,只有1例弱阳性的标本结果与PCR不符。因此,4个等级的评判标准是更合适的。但是弱阳性标本需要进行分子检测以排除假阳性。
综上所述,我们认为,在严格控制免疫组化染色条件的前提下,VE1抗体检测BRAF V600E与基因检测方法具有很高的一致性。对于不具备分子检测的临床病理科室来说,免疫组织化学检测方法是BRAF V600E检测的一种有效筛查手段,值得推广。对于免疫组化弱阳性的标本,需要进行基因检测以排除假阳性。
[1] THIEL A, RISTIMAKI A. Toward a molecular classification of colorectal cancer:The role of braf[J]. Front Oncol, 2013,3(384):281.
[2] AKABANE H, SULLIVAN R J. The future of molecular analysis in melanoma: Diagnostics to direct molecularly targeted therapy[J]. Am J Clin Dermatol, 2015,17(1):1-10.
[3] VAUGHN C P, ZOBELL S D, FURTADO L V, et al. Frequency of kras, braf, and nras mutations in colorectal cancer[J]. Gene Chromosome Canc, 2011,50(5):307-312.
[4] 朱晓丽,蔡旭,张玲,等. 中国结直肠癌患者中kras与braf基因突变特征及其临床病理相关性[J]. 中华病理学杂志, 2012,41(9):584-589.
[5] LOUGHREY M B, WARING P M, TAN A, et al. Incorporation of somatic braf mutation testing into an algorithm for the investigation of hereditary non-polyposis colorectal cancer[J]. Fam Cancer, 2007,6(3):301-310.
[6] 高玲,陈新华,郭志娟. Braf基因突变在结直肠癌诊治中的研究进展[J]. 世界最新医学信息文摘, 2017(95):44-45.
[7] VAN CUTSEM E, KOHNE C H, LANG I, et al. Cetuximab plus irinotecan, fluorouracil, and leucovorin as first-line treatment for metastatic colorectal cancer: Updated analysis of overall survival according to tumor kras and braf mutation status[J]. J Clin Oncol, 2011,29(15):2011-2019.
[8] 阿茹娜. 对于ⅱ期及ⅲ期微卫星不稳定结肠癌患者braf和kras突变状态的预后价值[J]. 中国普外基础与临床杂志, 2016(7):837-837.
[9] DE ROOCK W, CLAES B, BERNASCONI D, et al. Effects of kras, braf, nras, and pik3ca mutations on the efficacy of cetuximab plus chemotherapy in chemotherapy-refractory metastatic colorectal cancer: A retrospective consortium analysis[J]. Lancet Oncol, 2010,11(8):753-762.
[10] PAI R K, JAYACHANDRAN P, KOONG A C, et al. Braf-mutated, microsatellite-stable adenocarcinoma of the proximal colon: An aggressive adenocarcinoma with poor survival, mucinous differentiation, and adverse morphologic feature[J]. Am J Surg Pathol, 2012,36(5):744-752.
[11] 李森朋,张岫美,张芮. Braf基因突变与肿瘤耐药[J]. 药学研究, 2013,32(8):470-472.
[12] ILIE M I, LASSALLE S, LONG-MIRA E, et al. Diagnostic value of immunohistochemistry for the detection of the braf v600e mutation in papillary thyroid carcinoma: Comparative analysis with three DNA-based assays[J]. Thyroid, 2014,24(5):858-866.
[13] LONG G V, WILMOTT J S, CAPPER D, et al. Immunohistochemistry is highly sensitive and specific for the detection of v600e braf mutation in melanoma[J]. Am J Surg Pathol, 2013,37(1):61-65.
[14] 吕矫洁,孔蕴毅,蔡旭,等. Braf v600e抗体在检测恶性黑色素瘤braf v600e基因突变中的应用价值[J]. 中华病理学杂志, 2017,46(8):548-552.
[15] ADACKAPARA C A, SHOLL L M, BARLETTA J A, et al. Immunohistochemistry using the braf v600e mutation-specific monoclonal antibody ve1 is not a useful surrogate for genotyping in colorectal adenocarcinoma[J]. Histopathology, 2013,63(2):187-193.
[16] KUAN S F, NAVINA S, CRESSMAN K L, et al. Immunohistochemical detection of braf v600e mutant protein using the ve1 antibody in colorectal carcinoma is highly concordant with molecular testing but requires rigorous antibody optimization[J]. Hum Pathol, 2014,45(3):464-472.
[17] BLEDSOE J R, KAMIONEK M, MINO-KENUDSON M. Braf v600e immunohistochemistry is reliable in primary and metastatic colorectal carcinoma regardless of treatment status and shows high intratumoral homogeneity[J]. Am J Surg Pathol, 2014,38(10):1418-1428.
[18] 张旭东,陈瑞雪,王洁. Braf基因突变与肿瘤[J]. 中国细胞生物学学报, 2017(5):668-674.
[19] ABD ELMAGEED Z Y, SHOLL A B, TSUMAGARI K, et al. Immunohistochemistry as an accurate tool for evaluating braf-v600e mutation in 130 samples of papillary thyroid cancer[J]. Surgery, 2017,161(4):1122-1128.
[20] ANNE-KATRIN ZIMMERMANN M D, CAMENISCH U, RECHSTEINER M P, et al. Value of immunohistochemistry in the detection of brafv600e mutations in fine-needle aspiration biopsies of papillary thyroid carcinoma[J]. Cancer Cytopathol, 2014,122(1):48-58.
[21] NA J I, KIM J H, KIM H J, et al. Ve1 immunohistochemical detection of the braf v600e mutation in thyroid carcinoma: A review of its usefulness and limitations[J].
Virchows Archiv, 2015,467(2):155-168.
[22] DVORAK K, AGGELER B, PALTING J, et al. Immunohistochemistry with the anti-braf v600e (ve1) antibody: Impact of pre-analytical conditions and concordance with DNA sequencing in colorectal and papillary thyroid carcinoma[J]. Pathology, 2014,46(6):509-517.
[23] AFFOLTER K, SAMOWITZ W, TRIPP S, et al. Braf v600e mutation detection by immunohistochemistry in colorectal carcinoma[J]. Gene Chromosome Canc 2013,52(8):748-752.
[24] SINICROPE F A, SMYRK T C, TOUGERON D, et al. Mutation-specific antibody detects mutant brafv600e protein expression in human colon carcinomas[J]. Cancer, 2013,119(15):2765-2770.
[25] 时姗姗,王璇,夏秋媛,等. Braf ve1抗体在结直肠癌中检测braf v600e突变的应用[J]. 临床与实验病理学杂志, 2016,32(12):1383-1385.
[26] EMOTO K, YAMASHITA S, OKADA Y.Mechanisms of heat-induced antigen retrieval: Does ph or ionic strength of the solution play a role for refolding antigens[J]. J Histochem Cytochem, 2005,53(11):1311-1321.
[27] ZAGZAG J, POLLACK A, DULTZ L, et al. Clinical utility of immunohistochemistry for the detection of the braf v600e mutation in papillary thyroid carcinoma[J]. Surgery, 2013,154(6):1199-1204
[28] ZHU X, LUO Y, BAI Q, et al. Specific immunohistochemical detection of the braf v600e mutation in primary and metastatic papillary thyroid carcinoma[J]. Exp Mol Pathol, 2016,100(1):236-241.
[29] TOON C W, WALSH M D, CHOU A, et al. Brafv600e immunohistochemistry facilitates universal screening of colorectal cancers for lynch syndrome[J]. Am J Surg Pathol, 2013,37(10):1592-1602.
[30] CAPPER D, VOIGT A, BOZUKOVA G, et al. Braf v600e-specific immunohistochemistry for the exclusion of lynch syndrome in msi-h colorectal cancer[J]. Int J Cancer, 2013,133(7):1624-1630.

