留兰香薄荷离体快繁技术研究
吴雯雯, 陆 兵, 李文清, 邵元健
(南通科技职业学院,江苏南通 226007)
留兰香薄荷(MenthaspicataLinn)是一种多年生宿根草本植物,用途广泛,全草可入药,广泛用于中医药领域,也是世界著名的香料植物,具有较高的药用、食用和工业价值[1]。我国留兰香主要种植在江苏南通及安徽太和地区,目前品种混杂退化严重,其主要原因是随着薄荷市场的低迷,农民种植薄荷的积极性越来越低,母本难以妥善保留。利用植物组织培养的方式,可以很好地实现种质资源的保存和规模化生产[2]。国内关于留兰香组织培养的研究已经有一些,但不是很多,而且不同的研究,结果也不尽相同。柴明良以留兰香玻璃苗为对象,对诱导愈伤组织再生正常植株的培养基条件进行了探索[3]。王小敏等以留兰香茎尖为试验材料,主要研究了外植体消毒、不定芽增殖和试管苗移栽生根的条件[4]。申顺先等以留兰香含顶芽幼嫩茎段为外植体,对芽诱导、增殖和生根进行了研究[5]。这些研究都为留兰香薄荷的组织培养打下了良好的基础。本试验以露地栽培的留兰香带芽茎段为材料,对留兰香离体快繁技术进行研究,旨在为留兰香工厂化育苗和种质资源保存提供理论依据。
1 材料与方法
1.1 试验地点与材料
试验于2015年7月至2016年2月在南通科技职业学院组培室进行。供试材料为留兰香,引种于南通如皋客来花卉园艺场,现栽培于南通科技职业学院苗圃基地。
1.2 主要药剂和仪器
药剂:NaClO、HgCl2、乙醇、6-BA、NAA、MS、N5、B6等均由国药集团化学试剂有限公司生产;组培抗菌剂(简称PPM),购自北京西美杰科技有限公司。仪器:超净工作台、培养架、空调、冰箱、高压蒸汽灭菌锅、电子天平、pH试纸、移液管、容量瓶、营养钵、滤纸、玻璃棒等。
2 试验设计
2.1 初代培养
2.1.1 获取外植体 本试验选取露地栽培,生长旺盛的留兰香茎段为外植体,叶片全部除去,顶芽和腋芽保留。用2%的洗衣粉溶液浸泡外植体并不断搅拌,用刷子仔细刷新,自来水洗净,纱布包好,在流水中淋洗2 h后,置于超净工作台上。
2.1.2 外植体消毒试验 外植体置于消毒好的烧杯里,用75%的乙醇杀菌30 s,然后分别用消毒剂消毒(表1),消毒后用无菌水冲洗5~10次。将消毒后的外植体接种到准备好的培养基上,每个处理设10次重复,每瓶接种4个外植体,10 d 后记录萌动率、污染率和死亡率。培养温度为(25±1) ℃,光照1 500~2 000 lx,湿度80%左右,光照12 h/d。

表1 不同消毒剂和不同消毒时间对消毒效果的影响
2.1.3 芽诱导试验 待萌发的不定芽长到2~3 cm时,选取长势较好的小苗,重新切成1 cm的茎段,转接到培养基上,培养基设3种:(1)MS+1.0 mg/L 6-BA+0.2 mg/L NAA;(2)MS+0.1 mg/L NAA;(3)MS,分别加入30 g/L蔗糖、7 g/L琼脂。每个处理设10次重复,每瓶接种4个茎段。21 d后观察芽诱导率和分化率。
2.2 继代培养
切取初代培养的无菌芽苗,切成1~2 cm的小段,分别接种于增殖培养基上。考察培养基、6-BA、NAA和蔗糖这4种因素对增殖培养的影响,采用L9(34)正交试验设计[6]。每个处理接种10瓶,重复3次,21 d后观察分化增殖情况和苗健壮度。
将培养1个月的增殖苗切割不同部位,即顶芽、距离顶芽的第1个茎段、距离顶芽的第2个茎段、距离顶芽的第3个茎段,不同植株相同部位的苗转接至同一瓶中,每个部位作为1个处理,每个处理重复3次,21 d后观察苗的株高、直径和增殖系数。
2.3 生根培养
将增殖培养基中的有效生产苗取出,接种到生根培养基上,进行生根培养。基本培养基为1/2MS培养基,NAA设3个浓度(0.1、0.2、0.5 mg/L),分别加入15 g/L蔗糖、7 g/L琼脂。每个处理设3个重复,每个重复接种10株。30 d后观察生根率和根的状况。
2.4 结果统计及分析
污染率=污染外植体数/接种外植体数×100%;死亡率=死亡外植体数/接种外植体数×100%;萌动率=萌动外植体数/接种外植体数×100%;诱导率=有不定芽产生的外植体数/接种外植体数×100%;增殖系数=单个外植体再生形成的芽的平均数;生根率=生根外植体数/接种外植体数×100%。
3 结果与分析
3.1 初代培养试验结果
3.1.1 不同消毒剂和不同消毒时间对消毒效果的影响 将消毒处理后的茎段接种在初代培养基上,7 d后,幼芽开始萌动(图1)。研究发现,不同消毒剂和消毒时间的消毒效果不同。随着消毒时间的延长,污染率呈下降趋势,但是死亡率呈上升趋势,萌动率在用消毒剂0.1% HgCl2+2滴PPM消毒10 min时出现最大值,为75%。可见,选取的留兰香茎段,用75%乙醇杀菌30 s,然后用消毒剂0.1% HgCl2+2滴PPM 消毒10 min,表面消毒灭菌效果最好,用NaClO消毒效果最差。

3.1.2 不同激素浓度对芽诱导的影响 接种的茎段培养7 d后明显萌发,21 d后顶芽生长达3~5 cm,底部有不定芽。芽诱导率基本都在80%以上,基本培养基MS适合不定芽生长,激素组合对芽诱导率影响不大。各种激素组合与浓度对分化产生了明显的影响,处理3培养基中顶芽诱导出的平均不定芽数为4.7个,诱导效果最好,随着激素浓度的增加,诱导的不定芽数反而降低(表2、图2)。结果说明,处理3,即只用MS基本培养基,不添加激素,为初代培养的最优培养基。

表2 6-BA和NAA对芽诱导的影响

3.2 继代培养试验结果
3.2.1 不同培养基、激素和蔗糖组合对不定芽继代增殖的影响 极差分析表明,4个因素对增殖系数产生影响由主到次的顺序为基本培养基、6-BA、NAA、蔗糖(表3),说明培养基种类对芽分化和生长起着关键作用,MS培养基效果最好,N5和B6培养基均不适合留兰香芽增殖试验。蔗糖浓度对增殖的影响最弱,但是蔗糖浓度过高,反而会抑制苗的生长。6-BA 影响芽的诱导,浓度提高,分化率也提高,但浓度过高,无根苗会瘦弱,健壮度降低,要经多次壮苗方能生根移栽,反而影响繁殖效率;若浓度太低,无根苗数量会大大减少。综合增殖系数和苗健壮度,选择MS为基本培养基,添加0.2 mg/L 6-BA+0.01 mg/L NAA+25 g/L蔗糖,分化出的组培苗较多较大,易壮苗生根(图3)。
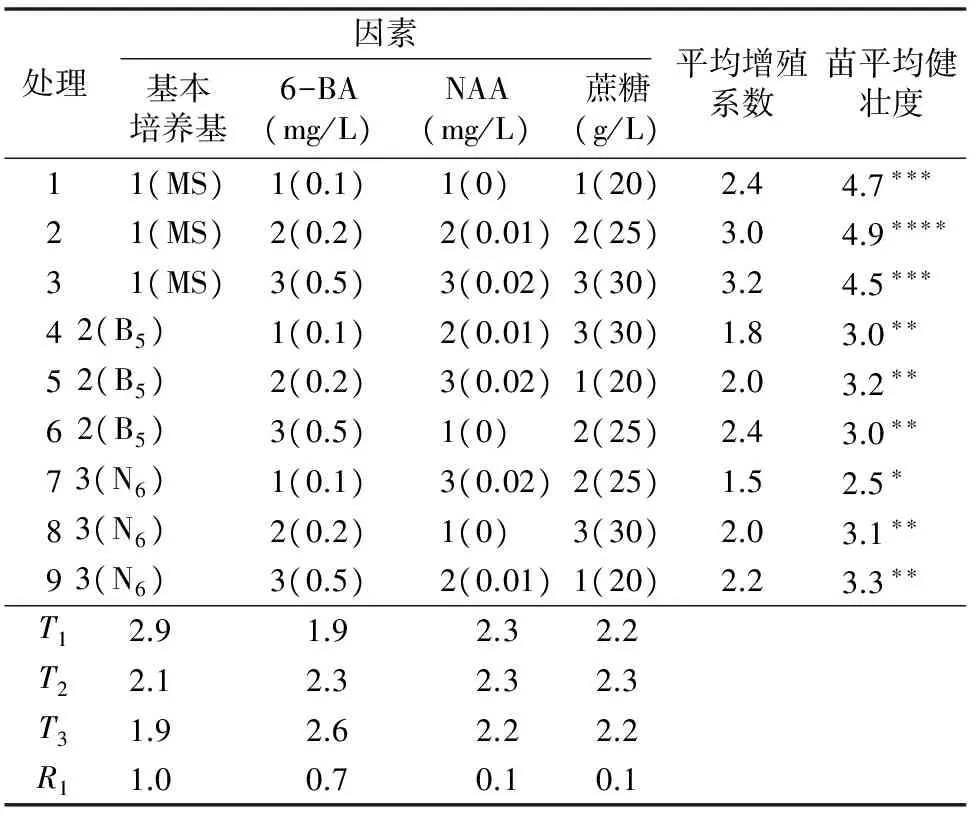
表3 不定芽增殖 L9(34)正交试验配方组合试验结果
注:“*”越多,表明苗越健壮。
3.2.2 不同部位对不定芽增殖的影响 研究发现,留兰香不同的生长部位对增殖有很大的影响,靠近基部的部位,由于有了一定的木质化程度,因此增殖系数最低,而靠近顶芽的下面第1个茎段的分蘖程度不如距离顶芽的第2个茎段完全,而顶芽生长最好,是最有利于增殖的部位,同时也有利于工厂化大量生产(表4)。

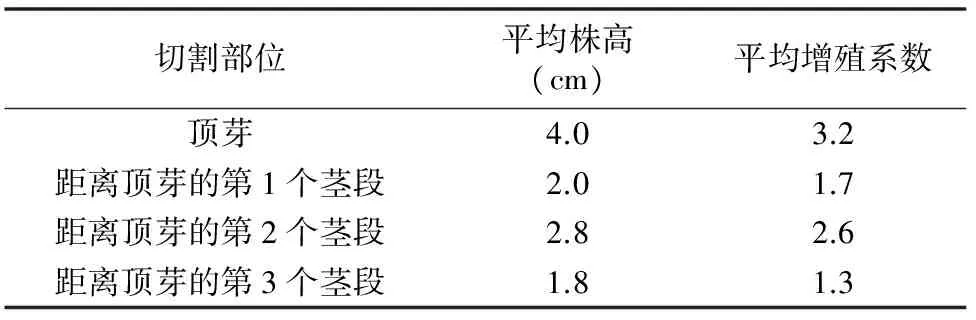
表4 不同部位对不定芽增殖的影响
3.3 生根培养试验结果
研究发现,留兰香组培苗较易生根,在3种NAA浓度下,生根率都达到了100%。添加的NAA浓度为0.1 mg/L时,根粗壮,有较多的毛细根,这种根系吸收面积大,吸收能力强,移栽时成活率高(表5、图4)。因此,适宜生根的NAA浓度为0.1 mg/L。
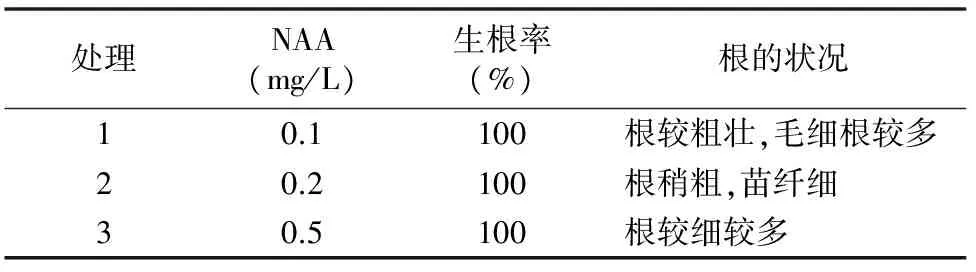
表5 NAA浓度对生根的影响

3.4 炼苗移栽
将生根状态理想的组培苗连同培养容器从培养室取出,置于温室大棚中,在自然光照下进行适应性锻炼10 d,再打开瓶口2 d。炼苗后,将组培苗从瓶中小心取出,洗干净黏附在根部的培养基,用0.1%的多菌灵1 000倍溶液浸根,然后移栽至已经高锰酸钾消毒的基质中(沙子 ∶草炭土为1 ∶1)。注意保持水分供需平衡,防止杂菌孳生,一般移栽成活率可达到85%(图5)。

4 讨论与结论
本研究结果表明,初代培养的最佳条件为MS基本培养基+30 g/L蔗糖,不加激素,产生的不定芽数最多,诱导率也较高;继代培养的最佳条件为MS+0.2 mg/L 6-BA+0.01 mg/L NAA+25 g/L蔗糖,选用顶芽部位进行增殖更有利于留兰香最后的生根比例;生根培养的最佳条件为1/2MS+0.1 mg/L NAA+15 g/L蔗糖,通过此途径长成的薄荷苗大多健壮,茎粗壮,叶片肥厚,容易生根。
试验结果显示,在组织培养整个过程中,留兰香对6-BA和NAA的浓度需求都比较低,如果激素浓度稍高,反而会抑制试管苗的生长,同时会长出较多气生根,这与王丽等的研究[7]一致。
本研究以留兰香茎段为外植体进行薄荷离体快繁研究,因为留兰香茎段上茸毛较多,腋芽与茎秆的交界处难以消毒干净,所以在外植体消毒时,先用75%的乙醇消毒30 s,再用0.1% HgCl2+2滴PPM 消毒10 min,杀菌效果较好。PPM是美国Plant Cell Technology专门为植物组织培养而研发的高效抗菌试剂,目前还尚未有在薄荷外植体消毒中使用的报道。由于培育的苗还未进行成分分析,具体使用PPM后,对薄荷精油的品质是否有影响,还需进一步研究。
[1]张泽宏,王兵丽,陈巧玲. 薄荷组织和细胞培养的研究进展[J]. 漳州师范学院学报(自然科学版),2013(3):93-95.
[2]陈世昌. 植物组织培养[M]. 2版.北京:高等教育出版社,2015:227-230.
[3]柴明良. 留兰香玻璃苗愈伤组织化再生正常植株[J]. 植物生理学通讯,1991,27(5):371.
[4]王小敏,梁呈元,李维林. 留兰香组织培养及快速繁殖条件的优化[J]. 植物资源与环境学报,2007,16(4):38-42.
[5]申顺先,李学慧,贺爱利,等. 留兰香微繁技术体系研究[J]. 北方园艺,2013(13):146-149.
[6]盖钧镒. 试验统计方法[M]. 北京:中国农业出版社,2000:285-290.
[7]王 莉. “草原”美国薄荷的组织培养及挥发油成份研究[D]. 雅安:四川农业大学,2008:43-45.

