64排CTP观察米诺环素在兔脑缺血再灌注中价值评价*
1.牡丹江医学院附属红旗医院磁共振科 (黑龙江 牡丹江 157011)2.牡丹江市心血管病医院影像科(黑龙江 牡丹江 157000)
魏秀芳1 李洪义1 董益国2 邢 健1 包 权1 朱 敏1 任春慧1 胡明成1 刘 鹤1 尹燕伟1 李 奇1 张宇航1
脑缺血再灌注是一个复杂的病理生理过程,有效再灌注对避免缺血引发一系列临床症状至关重要,再灌注是一个与多因素、彼此间相互影响的过程,有效评估再灌注效果对指导及评估临床治疗效果具有重要意义[1]。目前,神经影像学是临床脑卒中患者获得脑组织灌注信息的重要检查方法,如MR灌注加权成像、经颅多普勒检查、正电子发射体层摄影及单光子发射体层摄影已用于临床研究及实践应用,CT灌注扫描是近年来逐渐开始应用的检查方法,具有经济、简单、快速、准确及较高的空间分辨率的优点,尤其MSCT技术的应用,可以连续获得多层面灌注成像,以此同时实现了大范围观察[2]。作为第二代半合成四环素类抗生素的米诺环素,除了已证实抗菌作用疗效确切外,也具有一定的抗炎免疫调节、抗细胞凋亡及清除氧自由基等作用,近年来研究发现米诺环素对脑缺血具有一定的神经保护作用,可以有效对抗各种损伤机制诱发的损伤进而起到保护作用[3]。本研究主要是应用64排CTP观察米诺环素在活体动物脑缺血再灌注中的应用。
1 资料及方法
1.1 实验动物与分组选取雄性新西兰白兔50只,每只体重(2.5±0.58kg),其随机分成5组(每组10只):I组为假手术,同时间注入同单位量的生理盐水;II组为脑缺血-再灌注组,同时间注入同单位量生理盐水;III组为脑缺血-再灌注+缺血前12h给予米诺环素治疗组;IV组脑缺血-再灌注+缺血后2h给予米诺环素治疗组;V组脑缺血-再灌注+缺血后6h给予米诺环素治疗组。
1.2 动物模型实验前准备取长度为8cm塑料线(直径0.28cm),在一侧头部沾取硅橡胶,制成直径为0.5mm,长度2mm的插头,自然晾干,分别在距插头5cm、6cm处做标记,然后用95%酒精浸泡消毒。所选取得动物实验前8h给予禁食处置,并以速眠新0.2mg/Kg肌注麻醉,保留自主呼吸。
于右侧股静脉留置肝素钠浸泡的细麻醉套管,取颈部正中直切口,逐层分离组织,暴露右侧颈总动脉主干,向上分离至舌骨水平,分离该侧迷走神经并进行保护处置,分离颈总动脉鞘,游离颈总动脉,在其分叉处寻找颈内、外动脉及枕动脉,分离右颈内动脉近端及枕动脉,永久性结扎颈外动脉、枕动脉及近端颈总动脉。在颈总动脉上结扎处与动脉分叉间剪一小口,将制好的插线由颈总动脉插入颈内动脉,至5.0~5.5cm处将感到阻力,插头所到达的位置为右侧大脑中动脉起始处,结扎颈内动脉以固定插线,并剪去多余插线,缝合切口。
1.3 分组及给药处置I组:仅结扎右侧颈总动脉,相同时间注入同单位量的生理盐水;II组:脑缺血-再灌注后,拔出插线并由颈内动脉注入同单位量生理盐水;III组:脑栓塞前12h腹腔内注入米诺环素(80mg/Kg);IV组:脑栓塞2h行CT灌注扫描后,拔出插线使右侧大脑中动脉血管再通,然后腹腔内注入米诺环素
1.4 研究项目64排CTP观察米诺环素在活体兔脑缺血再灌注损伤中的作用,分析米诺环素治疗活体兔脑缺血再灌注组与对照组CTP的脑血流灌注图、脑血容积图、血流灌注峰值时间图及功能图像差异性。分析不同组间是否存在统计学差异,若存在差异,即进行组间比较。
TTC染色:CT扫描结束后对活体兔麻醉处死,行染色处置并获取梗死区,并计算得出容积百分百。
1.5 检查方法采用东芝64排CT机,按以下扫描序列进行:活体兔麻醉后取俯卧位,固定头部,取冠状面,股静脉留置管连接高压注射器。扫描条件:120kv、70mA、层厚:8mm、矩阵512×512、扫描野:100mm×100mm。
首先行探查性全脑平扫,动态CT测量设置在视交叉层面。选定层面后,从股静脉以2mL/s,总量2.5mL/kg注入优维显300,实行同步扫描,层厚8mm、4层、速度1层/s、持续50s,获得连续动态扫描图像。
1.6 诊断标准将所获得的连续图像传入工作站,使用Asceng CT Perfusion 2.1软件处理,获得时间-密度曲线,并获得功能图像,脑血流灌注图、血管外脑血流灌注图、峰值图、脑容积图、血流灌注开始时间图及血流灌注峰值时间图。
1.7 统计学方法分别统计不同组别所显示的图像情况,统计学分析采用配对χ2检验,当P<0.05时认为差异有统计学意义。
2 结 果
2.1 脑缺血模型CTP与病理对照在缺血不同时间段,CBF图与MTT图的缺损面积间比较无显著差异(P>0.05);CVB图缺损面积与TTB染色缺损面积在缺血不同时间段之间比较无明显差异(P>0.05);但在缺血2h组,CBF、MTT图与CBV图缺损面积、TTC染色缺损面积组之间比较有显著差异(P<0.05);在缺血6h组无显著差异(P>0.05)。具体结果见表1。
2.2 米诺环素用药疗效观察活体兔脑缺血再灌注用米诺环素治疗后脑缺血容积减少且具有统计学意义(P<0.05)。具体结果见表2(80mg/Kg);V组:脑栓塞2h行CT灌注扫描后,拔出插线使右侧大脑中动脉血管再通,于6h后腹腔内注入米诺环素(80mg/Kg)。
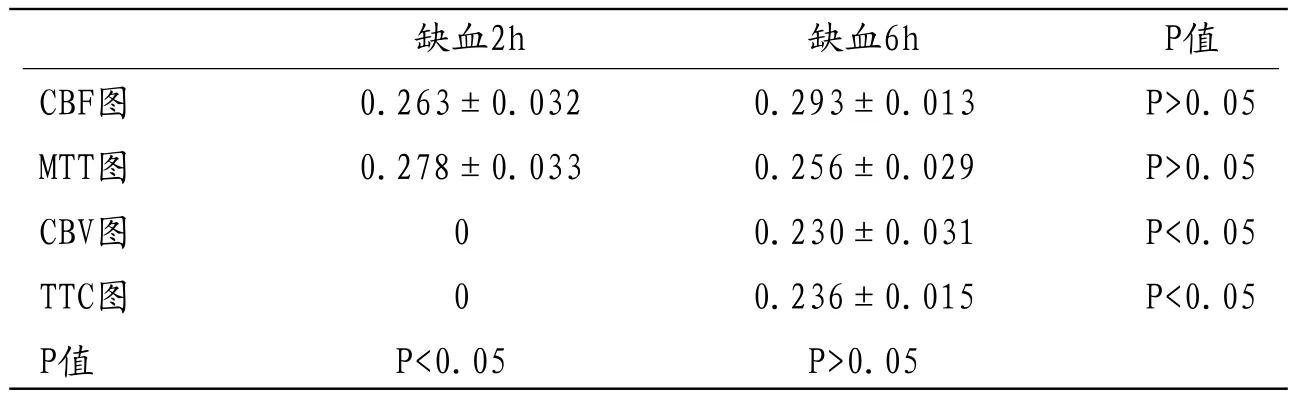
表1 缺血不同时间段灌注图缺损容积与TTC染色缺损容积比较

表2 实验组与对照组容积百分百比较
3 讨 论
脑血管病是临床中最为常见的神经系统病症,其主要是各种原因致脑组织血液循环发生障碍,致使局部神经功能缺失,临床中具有发病率高、致残率高、死亡率高、复发率高和并发症多的特点,严重影响着人类的生存期和生活质量[3-4]。
本研究中采取CT灌注成像评价脑血流情况进而分析,CT灌注成像技术早在1991年由科学家MILES等人提出,现今随着多层螺旋CT硬件设备及扫描技术的不断发展,CT灌注成像各方面都得到了提升,实现了扫描时间快、空间分辨率高、扫描野大等进步。本研究采取的为64排螺旋CT机,有效降低单位时间内辐射剂量同时减少扫描时间、提高图像空间分辨率。本研究主要采用碘造影剂(优维显)在CT灌注扫描观察靶组织内部浓度变化程度与CT值得改变情况及两者间的线性关系[5]。本研究先行探查性全脑平扫,动态CT测量设置在视交叉层面。选定层面后股静脉注入碘造影剂,实行同步扫描,薄层获得连续动态扫描图像,进一步通过后处理系统得出时间-密度曲线,经后处理系统得出脑组织血流灌注情况的多量化参数:达峰时间(TTP)、局部脑血流量(rCBF)、局部脑血容量(rCBV) 及平均通过时间(MTT)等。本研究中缺血2h组,CBF、MTT图与CBV图缺损面积、TTC染色缺损面积组之间比较有显著差异(P<0.05);在缺血6h组无显著差异(P>0.05),分析这一结果可能与多因素有关,主要可能与脑血管的自动调节系统有关,当血流发生变化时,脑血流系统产生自动调节,使血流动力学发生改变;此变化可能还与侧支循环代偿能力有一定关系脑血流侧支循环存在一定差异,这也将导致局部脑组织的代谢发生改变[6-7],因此导致了血流动力学的不同参数在脑部缺血区域不同时期的变化也不尽相同。
米诺环素作为第二代半合成的四环素类抗生素,由于其可以有效抗革兰阳性菌及革兰阴性菌的特征,临床中主要用于治疗关节炎及感染性病变,此外还具有亲脂性高,可透过血脑屏障的特点。有学者近年还提出了米诺环素在慢性神经变性疾病如阿尔茨海默病、帕金森病及运动神经元病中的作用,并且有相关研究提出了其具有可靠疗效的数据[8]。本研究中活体兔脑缺血再灌注用米诺环素治疗后脑缺血容积减少且具有统计学意义(P<0.05)。本研究中米诺环素组治疗组的实验数据优于预处理组的结果,这可能与米诺环素可以有效明显降低COX-2、PGE2的表达有关。Kim等学者目前认为米诺环素的使用可以通过抑制诱导型一氧化氮合酶产生,进而减少一氧化氮产生降低脑组织缺血后COX-2,PGE2的表达,与此同时还可以有效抑制还原型辅酶Ⅱ氧化酶的活性、抑制P38促分裂原活化蛋白激酶(p38-MAPK)的磷酸化等途径, 抑制小神经胶质细胞的激活与增殖而起作用的[9]。米诺环素还可以有效对抗脑缺血后神经元的死亡包括坏死和凋亡的产生。有研究数据表明米诺环素具有潜在的神经保护功能,有实验证实均匀动物低剂量的米诺环素静脉途径给药具有神经系统保护作用,这一作用可能与选择性抑制MMP-9蛋白表达有关[10-11],主要是在脑缺血过程中造成血脑屏障破坏,这种破坏往往可能是不可逆性的,而米诺环素能缓解血脑屏障的破坏,降低血脑屏障的破坏,从而减轻缺血后脑组织的损伤。
综上所述,本研究表明在活体兔局灶性脑缺血再灌注损伤中,米诺环素能够改善由缺血再灌注引起的损伤,尤其对于短时间的效果较为确切,同时使用CTP成像评估活体兔血流改变准确、可靠,可以通过脑血流动力学信息,为病因的确定、治疗方案的选择及疗效的评估提供全面资料。因此,应用64排CTP观察米诺环素对活体兔脑缺血再灌注效果良好、准确,值得临床实践应用。
[1]Liu Y,Wang D,Wang H,et al.The protective effect of HET0016 on brain edema and bloodbrain barrier dysfunction after cerebral ischemia/r e p e r f u s i o n[J].B r a i n Res,2014,1544(5):45-53.
[2]Fan X,Lo E H,Wang X.Effects of minocycline plus tissue p l a s m i n o g e n a c t i v a t o r combination therapy after focal embolic stroke in type 1 diabetic rats[J].Stroke,2013,44(3):745-752.
[3]唐兆华,廖正步,石全红,等.p38 信号通路对大鼠脑创伤后MMP-9的表达及脑水肿形成的影响[J].南方医科大学学报,2012,32(7):928-931.
[4]Tao T,Xu G,Si Chen C,et al.Minocycline promotes axonal regeneration through suppression of RGMa in rat MCAO/reperfusion model[J].Synapse,2013,67(4):189-198.
[5]Zhang Y,Zhang P,Shen X,et al.Early exercise protects the blood-brain barrier from ischemic brain injury via the regulation of MMP-9 and occludin in rats[J].Int J Mol Sci,2013,14(6):11096-11112.
[6]Plane JM,Shen Y,Pleasure DE,et al.Prospects for minocycline neuroprotection[J].Arch Neurol,2010,67(12):1442-1448.
[7]Xia D,Shen K,Zhong W,et al.Administration of minocycline ame-liorates damage in a renal ischemia/reperfusion injury model[J].Clin Invest Med,2011,34(2):E55-63.
[8]Fagan SC,Edwards DJ,Borlongan CV,et al.Optimal delivery of mi-nocycline to the b r a i n:i m p l i c a t i o n f o r human studies of acute neuro:protection[J].Exp Neurol,2004,186(2):248-251.
[9]Qiao M,Malisza KL,Del Bigio MR,et al.Correlation of cerebral hypoxicischemic T2 changes with tissue alterations in water content and protein extravasation[J].Stroke,2001,32(4):958-963.
[10]Apple FS.Tissue specificity of cardiac troponin I,cardiac troponin T and creatine kinase MB[J].Clin Chim Acta,1999,284(2):151-158.
[11]Meyer JR,Gutierrez A,Mock B,e t a l.H i g h-b-v a l u e d i f f u s i o n-w e i g h t e d M R imaging of suspected brain infarction[J]. AJNR Am J Neuroradiol,2000,21(10):1821-1829.

