5株乳酸菌复合物与CaCO3,酶及尿素不同组合对全株玉米青贮品质影响
王建福,雷赵民,万学瑞,姜辉,李洁,吴建平*
(1.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;2.甘肃农业大学动物医学院,甘肃 兰州 730070)
青贮是提高玉米(Zeamays)秸秆利用率并有效保存其营养价值的重要手段。在青贮发酵的微生物体系中,同质发酵乳酸菌所产生的乳酸可以使环境pH值迅速降低,从而抑制其他有氧细菌、酵母菌和霉菌的生长,减少其他有机酸的生成量,从而减少青贮营养损失并保证青贮品质[1]。玉米秸秆上所附着的乳酸菌数量往往不足,导致发酵后pH值下降缓慢,腐败菌生长期延长,营养物质损失增加[2]。通过添加外源乳酸菌,使其在青贮发酵系统中形成优势菌群,产生大量乳酸,迅速降低pH值并抑制其他腐败菌的生长,对保存青贮营养价值具有重要作用[3]。CaCO3、纤维素酶、淀粉酶和尿素在青贮中的应用均有报道:CaCO3不仅可以补充饲料中钙含量,而且可以中和青贮中的酸,提高发酵产物的适口性[4];淀粉酶和纤维素酶可以增加青贮发酵中的可溶性糖的浓度,为乳酸菌发酵的迅速启动提供充足底物,以促进发酵[5];尿素不但可以为微生物发酵提供氮源,提高发酵产物的粗蛋白含量和营养价值,其本身还可以直接作为反刍动物饲料中的非蛋白氮添加剂[6]。在前期的试验中筛选出了5株具有提高青贮发酵品质并抑制二次发酵潜力的乳酸菌[7],为了检测其混合菌液及其与CaCO3、纤维素酶、淀粉酶和尿素等复合制剂对全株玉米青贮发酵促进和营养成分保存的作用过程和效果,通过检测发酵过程中不同添加组合青贮发酵品质和营养品质的变化,为玉米秸秆青贮调制及乳酸菌复合制剂研制提供理论依据和技术参考。
1 材料与方法
1.1 材料及设备
蜡熟期收获的全株玉米为2016年10月由临洮县华加牧业有限公司提供,干物质含量约29%~33%;肠膜明串珠菌肠膜亚种(Leuconostocmesenteroidessubsp.mesenteroides)B1-7、戊糖片球菌(Pediococcuspentosaceus)B2-3、植物乳杆菌(Lactobacillusplantarum)B3-1、屎肠球菌(Enterococcusfaecium)B5-2、发酵乳杆菌(Lactobacillusfermentum)E2-3均由本实验室分离鉴定并保存, 乳酸菌用Modified Sholtens’ Broth (MSB)液体培养基培养至对数生长期,调浓度为1×109cfu·mL-1,按5 mL·kg-1青贮原料添加,即5×106cfu·g-1,不添加菌液组添加等体积的MSB液体培养基;CaCO3和尿素为分析纯试剂;纤维素酶酶活20000 U·g-1,α-淀粉酶酶活3700 U·g-1;秸秆粉碎机(9Z-9A型青贮铡草对辊揉搓型)由洛阳四达农机有限公司生产;相关仪器还包括聚乙烯真空包装袋(22 cm×28 cm)及真空包装机;相关发酵品质及营养成分检测设备由甘肃农业大学动物科学技术学院实验室提供。
1.2 试验设计
试验共设置8个组,其中1个空白对照组(CK),1个复合乳酸菌对照组(B),6个处理组(Bca、BU、BCA、BCaCA、BCAU、BCaCAU),见表1。每组设置3个重复,每袋装样量为0.5 kg,真空包装后室温保存。
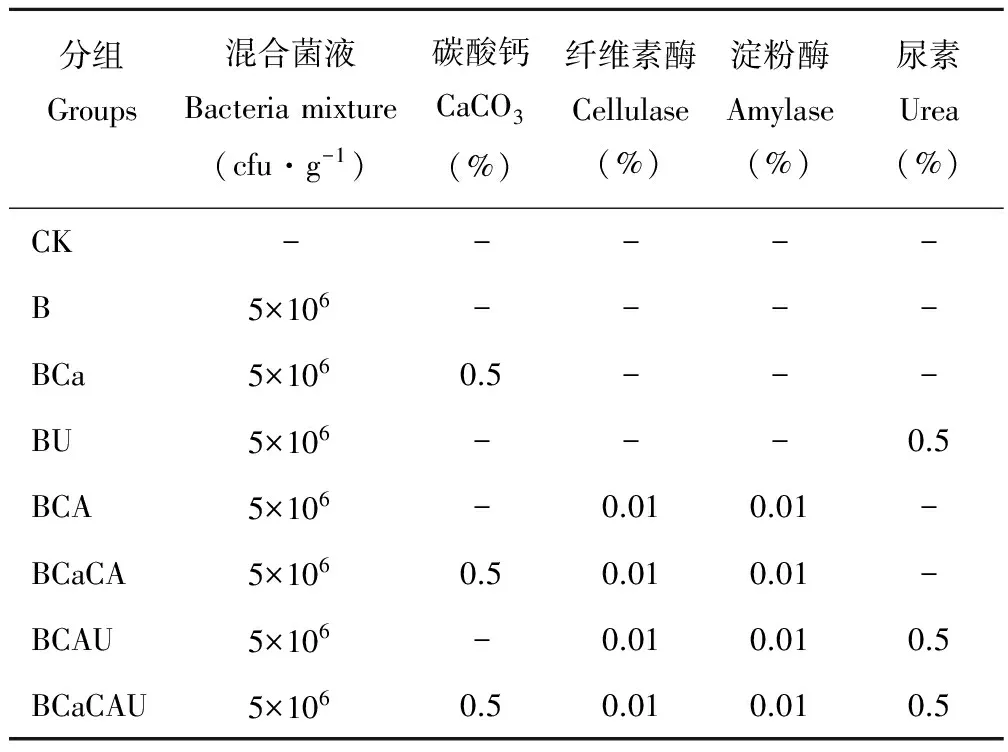
表1 试验设计Table 1 The design of experiment
1.3 测定方法
按常规法[8]测定青贮饲料的干物质(dry matter,DM)、粗蛋白(crude protein,CP)和粗脂肪(ether extract,EE)含量; 采用Van Soest等[9]的方法测定酸性洗涤纤维(acid detergent fiber,ADF)和中性洗涤纤维(neutral detergent fiber,NDF);按照Dubois等[10]的方法测定水溶性碳水化合物(water soluble carbohydrate,WSC)含量;液相色谱法(Waters ACQUITY UPLC,色谱柱BEH C18 1.0 mm×50 mm, 1.7 μm,流动相为水和0.3%磷酸甲醇,流速为0.1 mL·min-1,检测波长210 nm,进样量5 μL)测定青贮中的乳酸(lactic acid,LA)和乙酸(acetic acid,AA);苯酚-次氯酸钠比色法[11]测定NH3-N;取青贮样品20 g,加入180 mL蒸馏水,搅拌均匀,组织捣碎机均匀捣碎后纱布过滤,pH计测定滤液pH值。
1.4 数据处理与分析
利用Excel软件进行数据整理,SPSS Statistic 19.0软件包进行单因素ANOVA方差分析和Duncan氏多重比较,试验结果采用平均值±标准差表示,P<0.05表示差异显著。
2 结果与分析
2.1 发酵前玉米秸秆营养成分
青贮前全株玉米粉碎后的DM含量为28.86%,CP含量为7.73%,EE含量为3.47%,WSC含量为14.92%,NDF含量为52.17%,ADF含量为26.13%。原料的可溶性糖类含量和含水量符合青贮饲料调制要求。
2.2 全株玉米青贮发酵不同时期产物品质
全株玉米青贮发酵不同时期产物品质如表2所示。发酵3 d,BCAU组LA含量最高,显著高于除BCaCA组和BCaCAU组外的其他各组(P<0.05),B组含量最低;BCa组AA含量最高,显著高于其他各组(P<0.05),B组含量最低;B组LA/AA最高,BCa组最低,但差异不显著(P>0.05);BCaCA组氨态氮含量最低,显著低于除CK和B组之外的其他各组(P<0.05),BU组含量最高;B组pH值显著低于其他各组(P<0.05),BCa组和BCaCA组pH值较高,显著高于其他各组(P<0.05)。
发酵10 d,BCAU组LA含量最高,显著高于除BCaCAU组外的其他各组(P<0.05),CK组含量最低;CK组AA含量最低,显著低于除B组之外的其他各组(P<0.05),BCa组含量最高;CK组LA/AA最高,BCa组最低,但差异不显著(P>0.05);BCaCA组氨态氮含量最低,显著低于除CK组和BCa组外的其他各组(P<0.05),BCAU组氨态氮含量最高;CK组pH值最低,显著低于其他各组(P<0.05),BCaCA组最高。
发酵30 d,BCa、BCaCA、BCAU和BCaCAU组LA含量均较高,显著高于其他各组(P<0.05),CK组最低;CK组AA含量最低,显著低于除B组和BCA组外的其他各组(P<0.05),BCaCAU组含量最高;BCaCA组和BCAU组LA/AA最高,BU组最低,但差异不显著(P>0.05);B组氨态氮含量最低,显著低于BU组、BCAU组和BCaCAU组(P<0.05),BU组含量最高;B组pH值最低,显著低于除CK组之外的其他各组(P<0.05),BCaCA组最高。
2.3 全株玉米青贮发酵不同时期产物化学成分
全株玉米青贮发酵不同时期产物化学成分如表3所示。发酵3 d,BU组CP含量最高,显著高于除BCaCAU组的其他各组(P<0.05),BCaCA组含量最低;BCaCA组EE含量最高,显著高于除BCa组外的其他各组(P<0.05),BCaCAU组含量最低;B组ADF含量最低,显著低于除CK、BU和BCA组之外的其他各组(P<0.05),BCa组含量最高;B组NDF含量最低,显著低于除CK、BU、BCA和BCaCA组之外的其他各组(P<0.05),BCAU组含量最高;BCA组的WSC含量最高,显著高于除CK、B、BCAU和BCaCAU组外的其他各组(P<0.05),BU组含量最低。
发酵10 d,BCaCAU组的CP含量最高,显著高于除BCAU组外的其他各组(P<0.05),BCaCA组含量最低;BCaCA组EE含量最高,显著高于除BCa组之外的其他各组(P<0.05),BCAU组含量最低;ADF和NDF各组均无显著差异(P>0.05);BCA组WSC含量最高,显著高于除CK组和B组之外的其他各组(P<0.05),BCaCAU组含量最低。
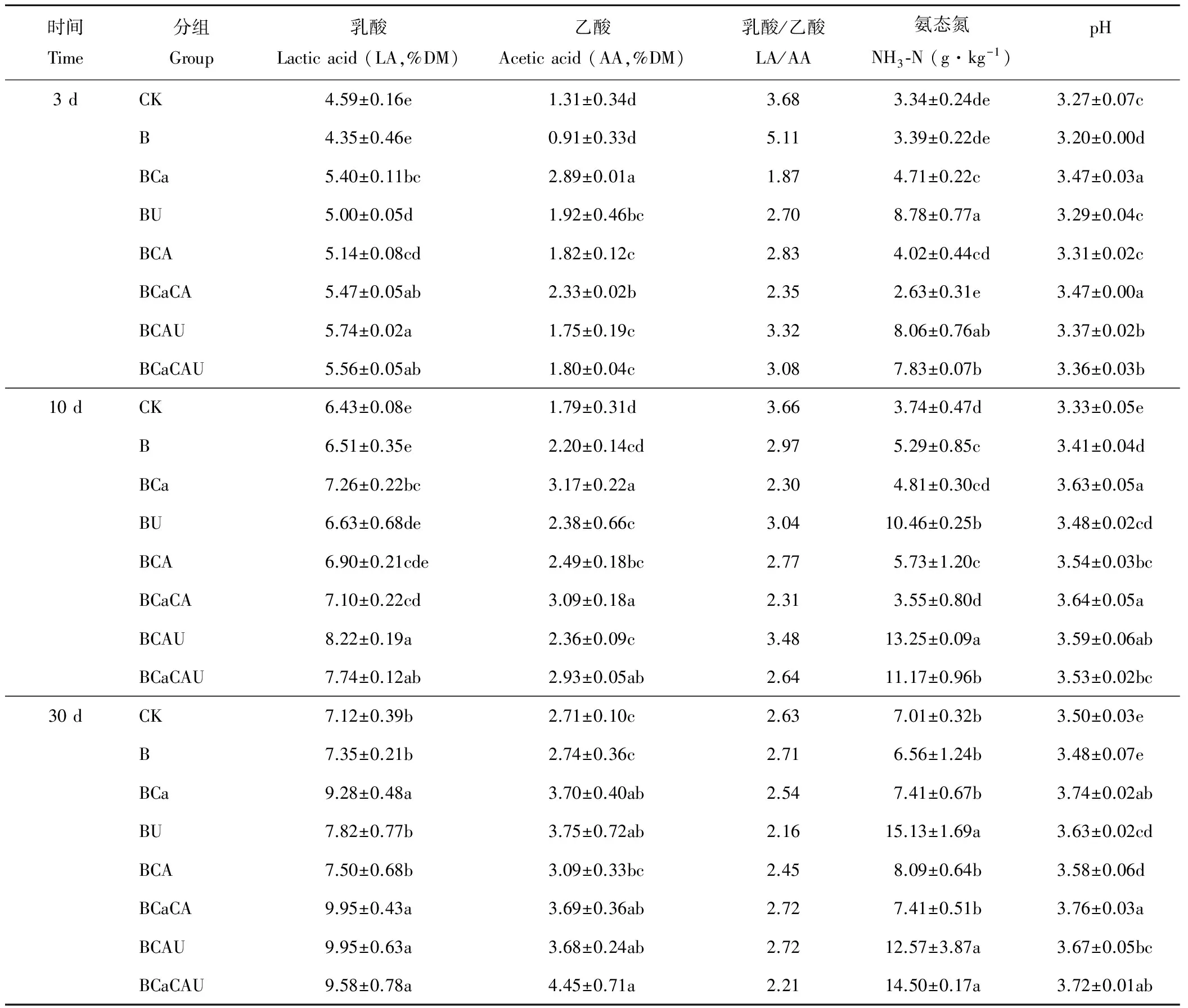
表2 不同添加物对全株玉米青贮发酵不同时间产物品质变化影响Table 2 Fermentation quality of corn silage in different time with different inoculant
注:同列不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05),下同。
Note: The different lowercase letters in the same column mean significant differences atP<0.05, the same or no letter mean no significant differences atP>0.05. The same below.
发酵30 d,BCaCAU组CP含量最高,显著高于除BU组之外的其他各组(P<0.05),CK组含量最低;BCaCA组EE含量最高,显著高于除BCa、BCA和BCAU组外的其他各组(P<0.05),BU组含量最低;B组ADF含量最低,但除显著低于BCaCAU组之外(P<0.05),与其他各组差异均不显著(P>0.05);各组NDF差异均不显著(P>0.05);CK组WSC含量最高,显著高于除B和BCA组外的其他各组(P<0.05),BCAU组含量最低。
3 讨论
3.1 复合乳酸菌对全株玉米青贮发酵品质和营养品质变化的影响
乳酸菌可以分为同质发酵乳酸菌和异质发酵乳酸菌,同质发酵往往仅产生乳酸,青贮的品质较高,营养成分损失较少[12],但青贮取用后的有氧稳定性往往较差,在实际生产中使用并不理想。异质发酵过程除了产生乳酸之外,还产生乙酸、甘露醇甚至乙醇等物质,发酵过程的营养和能量损失往往较大,但乙酸等可以抑制有害菌的生长, 使取用后的青贮有氧稳定性增强[13]。所以,在青贮实际使用的乳酸菌制剂中,往往既有同质发酵乳酸菌也有异质发酵乳酸菌,并添加其他青贮促进或不利发酵抑制物质。本试验所使用的5株乳酸菌中,戊糖片球菌B2-3、植物乳杆菌B3-1和屎肠球菌B5-2属于同质发酵乳酸菌,肠膜明串珠菌肠膜亚种B1-7和发酵乳杆菌E2-3属于异质发酵乳酸菌。从5株菌复合物的添加效果来看,其提高了30 d发酵LA和AA的产量以及LA/AA比例,降低了氨态氮和pH值,提高了30 d发酵产物的CP、EE,降低了ADF和NDF含量,提高了全株玉米青贮的发酵品质和营养品质。但从时间上来看,发酵过程中的发酵品质和营养品质变化是复杂的,趋势并不完全一致,所以,还需要对发酵过程中微生物种类和数量的变化及其发酵的底物和产物进行综合分析来揭示复合添加物对发酵品质变化的影响机制。
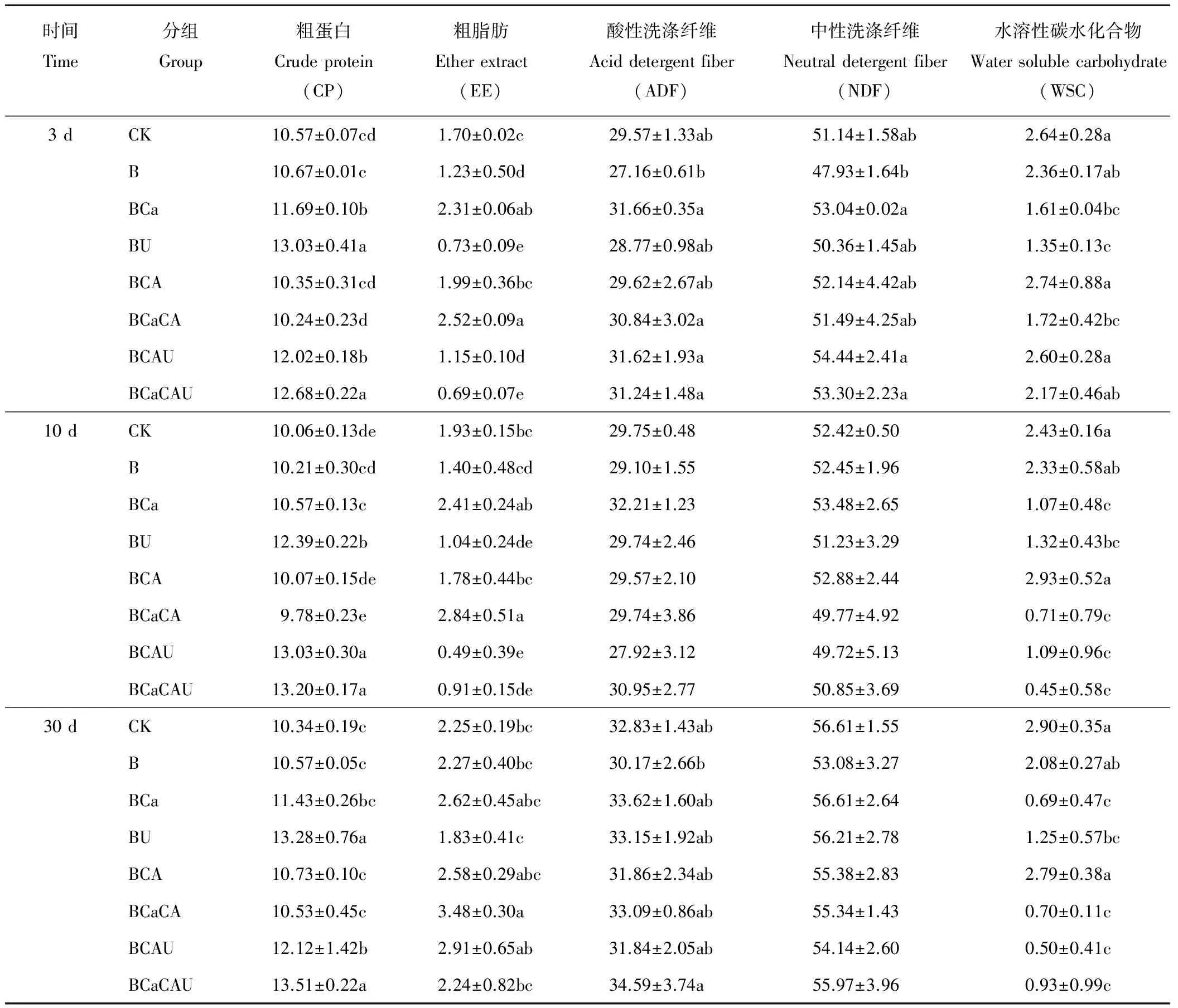
表3 不同添加物对全株玉米青贮发酵不同时间产物化学成分变化的影响Table 3 Chemical composition of corn silage in different time with different inoculant (%DM)
3.2 复合乳酸菌和CaCO3复合添加对玉米秸秆青贮发酵品质和营养品质变化的影响
从本试验结果可见,CaCO3的添加提高了青贮过程中的LA和AA的产量,可以提高青贮产物中的总酸产量,其中对AA的增加作用较大,降低了LA/AA比例,提高了发酵的pH值以及氨态氮的含量。随着发酵时间的延长,CaCO3除了能进一步显著提高LA和AA产量外,还可以提高LA/AA的比例,从而提高青贮发酵品质。在30 d发酵后,CaCO3与乳酸菌复合添加组LA含量相比单独的复合乳酸菌添加组及空白对照组分别提高了26%和30%;AA含量相比单独的复合乳酸菌添加组和空白对照组分别提高了35%和37%。AA对真菌具有较好的抑制作用,所以AA含量的提高对提高青贮产物的有氧稳定性是有利的。Pejin等[14]在啤酒糟的发酵过程中添加CaCO3分别使添加发酵乳杆菌和鼠李糖乳杆菌发酵组LA产量增加了13%和17%。Li等[15]发现在玉米青贮中添加CaCO3能够快速的产生LA,发酵3 d的LA产量已经比对照组高出3倍,同时也提高了AA的产量。本试验中发酵3 d添加CaCO3组也获得了较高的LA产量,但AA产量增幅更大。
郭天龙等[16]发现在甜菜(Betavulgaris)青贮发酵中添加CaCO3可使WSC含量降低,而对其他营养成分含量无影响,而本试验发现,CaCO3的添加提高了玉米秸秆青贮的CP和EE含量,有提高ADF和NDF的趋势,降低了WSC的含量。可能是因为与单独添加复合乳酸菌相比,添加CaCO3进一步促进了复合乳酸菌以及其他菌类的发酵,利用了发酵底物WSC,增加了微生物的含量所致。Santos等[17]在甘蔗(Saccharumofficinarum)青贮试验中也发现添加复合乳酸菌不能使青贮营养成分含量提高,但是添加CaCO3提高了发酵产物的营养价值。本试验中,复合乳酸菌和CaCO3复合添加对进一步促进青贮发酵具有显著效果,并且随着发酵时间的延长,EE、ADF、NDF有增加的趋势,WSC有降低的趋势。
3.3 复合乳酸菌和尿素复合添加对玉米秸秆青贮发酵品质和营养品质变化的影响
尿素作为一种含氮物质,在玉米青贮过程中可以显著提高CP含量,弥补玉米秸秆本身蛋白含量的不足[18]。但也有研究认为,青贮中添加尿素会使LA/AA比例降低,氨态氮含量增加,降低青贮发酵品质[19]。本研究中,复合乳酸菌和尿素的复合添加提高了青贮料氨态氮的含量及pH值,LA/AA比例下降,但LA和AA的含量均高于空白对照组和复合乳酸菌单独添加组,尤其是AA含量的增加明显。发酵产物中增加的氨态氮含量主要由添加的尿素产生,反刍动物瘤胃中本身也可以利用这种非蛋白氮,而且尿素作为氮源,促进了青贮过程中发酵菌的生长,进一步提高了蛋白含量,发酵产生的乙酸具有抑制霉菌等有害菌的作用,有利于提高发酵产物的有氧稳定性,降低青贮取用后的二次发酵损失[20]。
3.4 复合乳酸菌和纤维素酶、淀粉酶复合添加对全株玉米青贮发酵品质和营养品质变化的影响
纤维素酶和淀粉酶可以分解秸秆中的纤维素和淀粉,为青贮发酵提供更多的可溶性糖类底物,从而促进青贮发酵过程,尤其是当发酵底物中的WSC含量不足时,这种作用更加显著[21]。本研究发现在全株玉米青贮中添加复合乳酸菌和两种酶制剂在发酵3 d时,可以显著提高LA和AA的产量,但随着发酵时间的延长,这种作用变弱,并且与对照组和复合乳酸菌单独添加组差异变得不显著。随着发酵时间的延长,纤维素酶和淀粉酶的添加可以进一步增加AA产量,降低LA/AA比例,更有利于提高青贮发酵产物的有氧稳定性。纤维素酶和淀粉酶与复合乳酸菌的复合添加没有使全株玉米青贮发酵过程中的营养品质有所改善,CP、EE、ADF、NDF以及WSC与对照组和复合乳酸菌单独添加组相比差异均不显著。但与添加CaCO3和复合乳酸菌组以及尿素和复合乳酸菌组相比,显著提高了发酵产物的WSC含量,进一步体现了多种添加剂组合可能对乳酸菌发酵的促进作用。但是可能由于全株玉米青贮原料的可溶性糖类含量丰富,两种酶对可溶性糖类的增加作用有限[22-23]。
3.5 复合乳酸菌、CaCO3、尿素与纤维素酶和淀粉酶的复合添加对全株玉米青贮发酵品质和营养品质变化的影响
复合乳酸菌、CaCO3和两种酶的复合添加可以增加全株玉米青贮发酵的LA和AA产量,提高EE含量和pH值,降低WSC含量,并且在所测定的时间内这种趋势是持续的。可见,同时添加复合乳酸菌、CaCO3和两种酶有利于促进青贮发酵,提高全株玉米青贮的发酵品质和营养品质,也有利于改善发酵产物的适口性[24]。复合乳酸菌、两种酶和尿素的复合添加可以增加全株玉米青贮发酵的LA和AA产量,提高发酵产物的氨态氮含量、pH值和CP含量,降低WSC含量,在所测定的时间内LA和AA产量、pH值及WSC含量的变化趋势是持续的,氨态氮和CP含量呈现先增加后降低的趋势。可见,同时添加复合乳酸菌、两种酶和尿素有利于促进青贮发酵,提高全株玉米青贮的发酵品质和营养品质,尤其是可以显著提高发酵产物的CP含量,也有利于改善发酵产物的适口性。复合乳酸菌、CaCO3、两种酶和尿素的复合添加可以增加全株玉米青贮发酵的LA和AA产量,提高发酵产物的氨态氮含量、pH值和CP含量,降低WSC含量,在所测定的时间内LA和AA产量、氨态氮含量、pH值及CP含量的变化趋势是持续的,WSC含量呈现先降低后增加的趋势。可见,同时添加复合乳酸菌、CaCO3、两种酶和尿素有利于促进青贮发酵,提高全株玉米青贮的发酵品质和营养品质,也有利于改善发酵产物的适口性。同时添加CaCO3、尿素和两种酶组CP随着发酵时间的延长逐渐增加,而EE、ADF、NDF和WSC均表现出了先降低后增加的趋势,可见微生物发酵在3~30 d期间活跃且复杂[25],而相关的机理尚需进一步通过研究不同微生物组成及产物和底物变化的特点来阐明。综合比较,同时添加复合乳酸菌、CaCO3、两种酶和尿素组30 d后发酵产物的发酵品质和营养品质最好。
4 结论
5株乳酸菌混合剂的添加可以提高全株玉米青贮发酵的发酵品质和营养品质;同时添加CaCO3和复合乳酸菌能进一步增加青贮的LA和AA产量,尤其是AA产量,防止pH值过分降低,也有提高青贮营养品质的趋势;同时添加尿素和复合乳酸菌能进一步提高青贮的AA和氨态氮的含量,防止pH值过分降低,显著提高CP含量,从而提高青贮营养品质;纤维素酶和淀粉酶可以提高发酵产物的WSC含量,提高LA和AA的产量,提高青贮发酵品质;CaCO3、尿素、纤维素酶、淀粉酶和复合乳酸菌的添加对全株玉米青贮的发酵品质和营养品质的提高效果最好;全株玉米青贮发酵品质和营养品质在前3 d变化最快,发酵不同阶段不同添加组合的变化不尽一致。
References:
[1] Ranjit N K, Kung L J. The effect ofLactobacillusbuchneri,Lactobacillusplantarum, or a chemical preservative on the fermentation and aerobic stability of corn silage. Journal of Dairy Science, 2000, 83(3): 526-535.
[2] Santos A O,vila C L, Pinto J C,etal. Fermentative profile and bacterial diversity of corn silages inoculated with new tropical lactic acid bacteria. Journal of Applied Microbiology, 2015, 120(2): 266-279.
[3] Aksu T, Baytok E D. Effects of a bacterial silage inoculant on corn silage fermentation and nutrient digestibility. Small Ruminant Research, 2004, 55(3): 249-252.
[4] Simkins K L J, Baumgardt B R, Niedermeier R P. Feeding value of calcium carbonate-treated corn silage for dairy cows. Journal of Dairy Science, 1965, 48(10): 1315-1318.
[5] Kowaluk E A, Roberts M S, Polack A E. Effects of an enzyme-inoculant mixture on the course of fermentation of corn silage. Journal of Dairy Science, 1994, 77(11): 3401-3409.
[6] Jr K L, Robinson J R, Ranjit N K,etal. Microbial populations, fermentation end-products, and aerobic stability of corn silage treated with ammonia or a propionic acid-based preservative. Journal of Dairy Science, 2000, 83(7): 1479-1486.
[7] Wan X R, Wu J P, Lei Z M,etal. Effect of lactic acid bacteria on corn silage quality and stability after aerobic exposure. Acta Prataculturae Sinica, 2016, 25(4): 204-211.
万学瑞, 吴建平, 雷赵民, 等. 优良抑菌活性乳酸菌对玉米青贮及有氧暴露期微生物数量和pH的影响. 草业学报, 2016, 25(4): 204-211.
[8] Zhang L Y. Feed analysis and feed quality testing technology. Beijing: China Agricultural University Press, 2003: 46-75.
张丽英. 饲料分析及饲料质量检测技术. 北京: 中国农业大学出版社, 2003: 46-75.
[9] Van Soest P J, Robertson J B, Lewis B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition. Journal of Dairy Science, 1991, 74(10): 3583-3597.
[10] Dubois M, Gilles K A, Hamilton J K. Colorimetric method for determination of sugars and related substances. Analytical Chemistry, 1956, 28(3): 350-356.
[11] Wang Y, Yuan X J, Guo G,etal. Fermentation and aerobic stability of mixed ration forages in Tibet. Acta Prataculturae Sinica, 2014, 23(6): 95-102.
王勇, 原现军, 郭刚, 等. 西藏不同饲草全混合日粮发酵品质和有氧稳定性的研究. 草业学报, 2014, 23(6): 95-102.
[12] Sadeghi K, Khorvash M, Ghorbani G R,etal. Effects of homo-fermentative bacterial inoculants on fermentation characteristics and nutritive value of low dry matter corn silage. Iranian Journal of Veterinary Research, 2012, 41(4): 303-309.
[13] Kleinschmit D H, Schmidt R J, Kung L J. The effects of various antifungal additives on the fermentation and aerobic stability of corn silage. Journal of Dairy Science, 2005, 88(6): 2130-2139.
[14] Pejin J, Radosavljeviĉ M, Mojoviĉ L,etal. The influence of Calcium-Carbonate and yeast extract addition on lactic acid fermentation of brewer’s spent grain hydrolysate. Food Research International, 2014, 73(30): 31-37.
[15] Li X, Hansen W P, Otterby D E,etal. Effect of additives on fermentation of corn silage containing different amounts of added nitrate nitrogen 1. Journal of Dairy Science, 1992, 75(6): 1555-1561.
[16] Guo T L, Hou X Z, Han J Y,etal. The effect of different additives on quality of beet silage. China Animal Husbandry & Veterinary Medicine, 2009, 36(5): 14-17.
郭天龙, 侯先志, 韩吉雨, 等. 不同添加剂对甜菜茎叶青贮品质的影响. 中国畜牧兽医, 2009, 36(5): 14-17.
[17] Santos M C, Nussio L G, Mourão G B,etal. Nutritive value of sugarcane silage treated with chemical additives. Scientia Agricola, 2009, 66(2): 159-163.
[18] Zang Y Y, Wang Y, Gu X Y,etal. Effects of propionic acid and urea on the quality of whole-crop corn silage. Pratacultural Science, 29(1): 156-159.
臧艳运, 王雁, 顾雪莹, 等. 添加丙酸和尿素对玉米青贮品质的影响. 草业科学, 2012, 29(1): 156-159.
[19] Rong H, Yu C Q, Li Z H,etal. Effects of adding molasses and urea on fermentation quality of napier grass silage. Acta Agrestia Sinica, 2012, 20(5): 940-946.
荣辉, 余成群, 李志华, 等. 添加糖蜜和尿素对象草青贮发酵品质的影响. 草地学报, 2012, 20(5): 940-946.
[20] Danner H, Holzer M, Mayrhuber E,etal. Acetic acid increases stability of silage under aerobic conditions. Applied & Environmental Microbiology, 2003, 69(1): 562-567.
[21] Sun Z H, Liu S M, Tayo G O,etal. Effects of cellulase or lactic acid bacteria on silage fermentation andinvitrogas production of several morphological fractions of maize stover. Animal Feed Science & Technology, 2009, 152(4): 219-231.
[22] Nadeau E M G, Russell J R, Buxton D R. Intake, digestibility, and composition of orchardgrass and alfalfa silages treated with cellulase, inoculant, and formic acid fed to lambs. Journal of Animal Science, 2000, 78(11): 2980-2989.
[23] Sheperd A C, Kung L J. Effects of an enzyme additive on composition of corn silage ensiled at various stages of maturity. Journal of Dairy Science, 1996, 79(10): 1767-1773.
[24] Jalc D, Laukova A, Simonova P M,etal. Bacterial inoculant effects on corn silage fermentation and nutrient composition. Asian Australasian Journal of Animal Sciences, 2009, 22(7): 977-983.
[25] Kleinschmit D H, Kung L J. The effects ofLactobacillusbuchneri40788 andPediococcuspentosaceusR1094 on the fermentation of corn silage. Journal of Dairy Science, 2006, 89(10): 3999-4004.

