血清IL-28A在强直性脊柱炎治疗前后的表达及临床意义
焦大敏,常琼洁,2,李 萍*
(1.吉林大学中日联谊医院 风湿免疫科,吉林 长春130033;2.郑州人民医院 风湿免疫科,河南 郑州450053)
强直性脊柱炎(AS)是一种长期慢性炎性刺激引起的脊柱进行性关节炎。炎症及炎症因子反应可导致脊柱活动受限及骨骼结构的损伤[1]。白介素-28A(interleukin-28A,IL-28A)属于Ⅲ型干扰素,通过激活细胞信号通路发挥抗病毒、抗增殖、抗肿瘤和免疫调节作用[2-4]。近年研究表明,Ⅲ型干扰素与诸多风湿性疾病[系统性红斑狼疮(SLE)、系统性硬化症(SSc)和类风湿关节炎(RA)]的发病有一定的相关性[5-7],但是IL-28A是否参与了AS的发病机制目前尚不清楚。本研究通过检测AS患者血清IL-28A的表达水平及其与疾病活动指标的相关性,探讨IL-28A在AS治疗前后的变化及意义,为进一步深入了解AS发病机制、开发AS治疗有效药物提供依据。
1 对象与方法
1.1研究对象
本研究收集了2015年9月至2016年9月期间在吉林大学中日联谊医院风湿免疫科住院的AS患者40例,年龄21-42岁,中位数为26岁,其中男性37例,女性3例,病程6个月-8年。所有入组AS患者均符合1984年修订的AS纽约标准[8],排除感染、糖尿病、心力衰竭、肾功能衰竭、肝炎、肝衰竭、恶性疾病以及其他活动性炎性疾病(例如RA、克罗恩病、SLE、SSc),入组前1个月内未使用改善病情抗风湿药物(DMARDs)、糖皮质激素等可影响免疫系统的药物,并且入组前均处于疾病活动期,即Bath AS疾病活动指数(BASDAI)≥4[9]或使用C-反应蛋白(CRP)的AS疾病活动评分(ASDAS-CRP)≥2.1[10]。所有患者均给予1种DMARDs(包括传统DMARDs或生物DMARDs)联合1种非甾体类抗炎药物(NSAIDs)(包括塞来昔布,双氯芬酸和依托考昔)治疗,共随访6个月。在治疗前和治疗1、3和6个月后分别进行疾病活动指标采集。同时选取本院同期体检中心40例年龄和性别匹配的健康志愿者作为健康对照组(HC),年龄22-44岁,平均(24.8±5.7)岁,其中男性37例,女性3例。此项研究获得吉林大学中日联合医院伦理委员会批准,所有受试者均签署了知情同意书。
1.2实验室检查
所有受试者于开始治疗前、治疗后1、3和6个月4个时间点分别采集空腹血,CRP采用乳胶增强免疫比浊法测定, 红细胞沉降率(ESR)采用魏氏法测定。低温离心后得到的血清存于-80℃冰箱待检,通过购买的IL-28A(GenWay Biotech,Inc,GWB-SKR146)酶联免疫吸附测定法(ELISA)检测试剂盒按说明进行AS患者血清IL-28A测定。
1.3疾病活动度评分
BASDAI:由5个项目的平均分组成:A疲乏、B脊柱痛、C关节痛、D肌腱端炎、E脊柱炎症=0.5×(晨僵程度+晨僵时间),每个项目得分为患者近一周疾病活动的总体情况的自我评价的VAS(0-10)评分。BASDAI=0.2×(A+B+C+D+E)[9]。
ASDAS-CRP=0.122×腰背痛+0.061×晨僵持续时间+0.119×患者的总体评价+0.210×血沉的平方根+0.383×(C反应蛋白+1)的自然对数[10]。
1.4统计学方法

2 结果
2.1HC和AS患者治疗前后疾病活动指标和血清IL-28A水平
如表1所示,AS患者治疗前和治疗后血清IL-28A水平显着高于HC(P<0.01),且治疗后血清IL-28A明显高于治疗前(P<0.01)。比较治疗后1个月和3个月、1个月与6个月、3个月与6个月的结果发现, 血清IL-28A水平在治疗后3个时间点间无显著性差异(P>0.05),表明AS患者血清IL-28A水平在治疗后1个月已达稳定。同时还发现AS患者ESR、CRP在治疗1个月后显著下降(P<0.01),之后趋于稳定,ASDAS-CRP在治疗1、3个月时持续下降,6个月时趋于稳定,而BASDAI在6个月治疗期间持续下降。

表1 HC和AS患者治疗前后疾病活动指标和血清IL-28A水平
注:^^P<0.01,与HC比较;**P<0.01,与AS治疗前比较;##P<0.01,与AS治疗后1个月比较;&&P<0.01,与AS治疗后3个月比较
2.2AS患者血清IL-28A水平与疾病活动指标的相关性
如表2所示, 治疗前AS患者血清IL-28A水平与疾病活动指标之间无相关性(P>0.05)。治疗后1个月和治疗后6个月时IL-28A与ESR呈负相关(P<0.05);治疗后3个月,IL-28A与BASDAI呈负相关(P<0.05)。如图1所示,AS患者治疗后明显升高的IL-28A水平与疾病活动度评分明显降低的趋势相反,提示血清IL-28A水平与AS疾病活动指标之间有一定的关联。
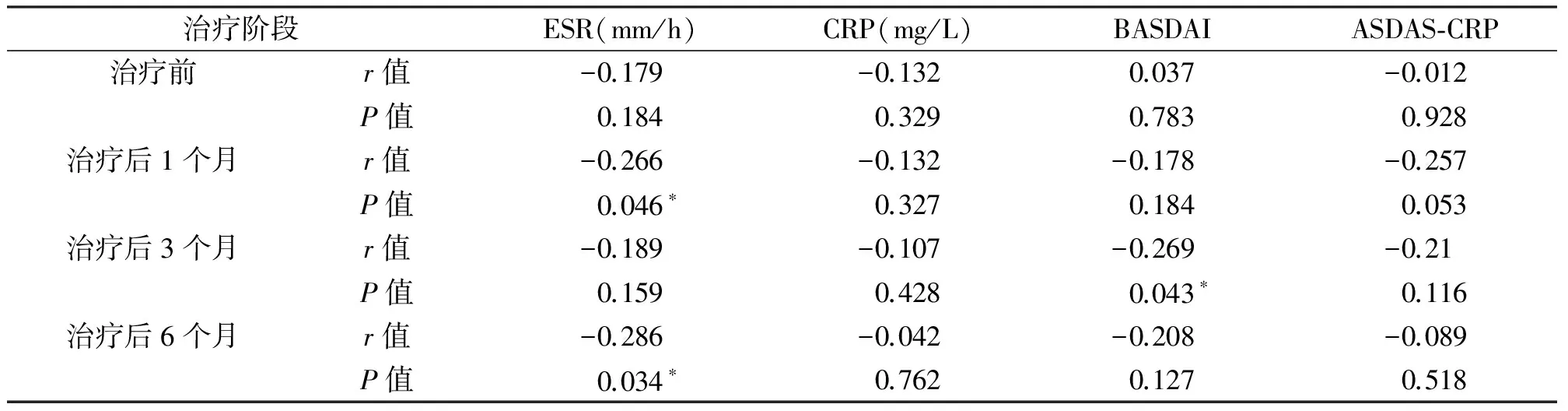
表2 治疗各阶段AS患者血清IL-28A的水平与疾病活动指标的相关性
注:“*”表示P<0.05
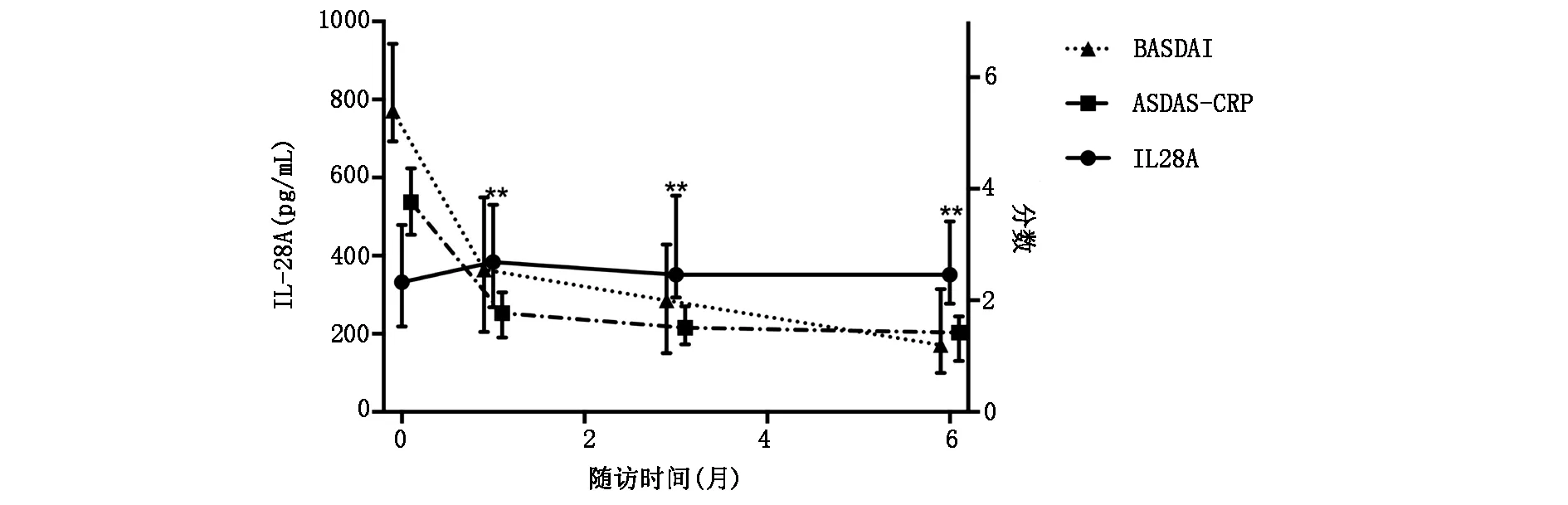
**P<0.01,AS患者治疗后与治疗前的比较图1 治疗后血清IL-28A及BASDAI、ASDAS-CRP的变化
如表3所示,AS患者治疗后的3个阶段IL-28A水平变化(ΔIL-28A)和疾病活动指标变化(Δ疾病活动指标)之间没有显著的相关性(P>0.05)。

表3 治疗各阶段AS患者血清IL-28A的变化与疾病活动指标的变化的相关性
3 讨论
目前的研究发现IL-28A具有抗病毒、抗增殖、抗肿瘤、免疫调节的重要作用[2-4]。然而,IL-28A在自身免疫性疾病和慢性炎症性疾病中的作用尚不完全清楚。最近的研究发现,血清IL-28表达水平降低与过敏性哮喘的严重程度和病情恶化之间存在强烈的联系,而在哮喘模型鼠的研究中发现IL-28A可以调节肺树突状细胞的功能,促进体内Th1细胞分化,抑制气道中Th2细胞介导的反应,抑制过敏性气道疾病[11]。有研究表明贝赫切特病(Behcet's disease,BD)患者外周血单个核细胞对IL-28A敏感性增加,促进了Th1细胞反应,这一过程参与BD的发生发展[12];在SLE患者血清及活化的CD4+T细胞中发现IL-28水平较正常人明显升高,这种表达的失调提示IL-28可能参与SLE的发病机制[13]。本研究发现活动期AS患者血清IL-28A水平显著高于HC,这个结果与Diana Castillo-Marti'nez等在RA领域的研究结果相似,他们的研究发现活动期RA患者血清IL-28A的水平显著高于HC[14]。本研究结果表明IL-28A在AS患者中的表达失调,提示其可能参与了AS的发病机制。
本研究监测了6个月治疗期间不同时间点的疾病活动指标变化,并探究他们与患者血清IL-28A水平的关系。虽然没有发现治疗前IL-28A与疾病活动指标存在相关性的直接证据,但是本研究发现,治疗后患者疾病活动指标明显降低,而治疗后AS患者血清中IL-28A水平显著高于治疗前,且治疗后1个月和治疗后6个月IL-28A与ESR呈负相关,治疗后3个月IL-28A与BASDAI呈负相关,说明IL-28A与AS的疾病活动存在有一定的关联。AS的发病机制与RA相似,都是由于炎症破坏了正常的骨稳态,导致骨吸收和形成的失衡[15]。最近的研究发现,用IL-28A治疗胶原诱导的关节炎(collagen-induced arthritis,CIA)小鼠,可通过抑制中性粒细胞IL-1β产生和中性粒细胞迁移来逆转CIA小鼠疾病严重程度和关节损伤,并且证明IL-28A治疗显著减少了关节和腹股沟淋巴结Th17和γδT细胞IL- 17的产生,提示IL-28A具有抗炎作用[16]。这些发现与本研究在AS患者治疗后血清IL-28A的水平较治疗前明显上升和治疗过程中始终高于健康对照的结果相一致,提示IL-28A可能在降低疾病活动和抗炎保护机体方面发挥了重要作用。本研究结果未发现治疗前IL-28A与疾病活动指标之间有任何显著的相关性,这可能是与本研究随访期短、样本量小、纳入标准严格以及缺乏其他对照(如非活动性AS患者和其他药物治疗组作为对照)等因素有关,有待进一步的实验去验证。
4 结论
本研究首次确定了活动期AS患者血清IL-28A表达水平,发现IL-28A可能参与了AS的发病机制,可能为AS的治疗提供新的靶点。
[1]Taurog JD,Chhabra A,Colbert RA.Ankylosing Spondylitis and Axial Spondyloarthritis[J].The New England journal of medicine,2016,374(26):2563.
[2]Brand S,Beigel F,Olszak T,et al.IL-28A and IL-29 mediate antiproliferative and antiviral signals in intestinal epithelial cells and murine CMV infection increases colonic IL-28A expression[J].American journal of physiology Gastrointestinal and liver physiology,2005,289(5):G960.
[3]Meager A,Visvalingam K,Dilger P,et al.Biological activity of interleukins-28 and -29:comparison with type I interferons[J].Cytokine,2005,31(2):109.
[4]Zanoni I,Granucci F,Broggi A.Interferon (IFN)-lambda Takes the Helm:Immunomodulatory Roles of Type III IFNs[J].Frontiers in immunology,2017,8:1661.
[5]Wu Q,Yang Q,Sun H,et al.Serum IFN-lambda1 is abnormally elevated in rheumatoid arthritis patients[J].Autoimmunity,2013,46(1):40.
[6]Amezcua-Guerra LM,Ferrusquia-Toriz D,Castillo-Martinez D,et al.Limited effectiveness for the therapeutic blockade of interferon alpha in systemic lupus erythematosus:a possible role for type III interferons[J].Rheumatology (Oxford,England),2015,54(2):203.
[7]Dantas AT,Goncalves SM,Pereira MC,et al.Interferons and systemic sclerosis:correlation between interferon gamma and interferon-lambda 1 (IL-29)[J].Autoimmunity,2015,48(7):429.
[8]van der Linden S,Valkenburg HA,Cats A.Evaluation of diagnostic criteria for ankylosing spondylitis.A proposal for modification of the New York criteria[J].Arthritis and rheumatism,1984,27(4):361.
[9]Garrett S,Jenkinson T,Kennedy LG,et al.A new approach to defining disease status in ankylosing spondylitis:the Bath Ankylosing Spondylitis Disease Activity Index[J].The Journal of rheumatology,1994,21(12):2286.
[10]van der Heijde D,Lie E,Kvien TK,et al.ASDAS,a highly discriminatory ASAS-endorsed disease activity score in patients with ankylosing spondylitis[J].Annals of the rheumatic diseases,2009,68(12):1811.
[11]Koltsida O,Hausding M,Stavropoulos A,et al.IL-28A (IFN-lambda2) modulates lung DC function to promote Th1 immune skewing and suppress allergic airway disease[J].EMBO molecular medicine,2011,3(6):348.
[12]Li B,Xie C,Lin X,et al.Interleukin-28A promotes IFN-gamma production by peripheral blood mononuclear cells from patients with Behcet's disease[J].Cellular immunology,2014,290(1):116.
[13]Lin SC,Kuo CC,Tsao JT,et al.Profiling the expression of interleukin (IL)-28 and IL-28 receptor alpha in systemic lupus erythematosus patients[J].European journal of clinical investigation,2012,42(1):61.
[14]Castillo-Martinez D,Juarez M,Patlan M,et al.Type-III interferons and rheumatoid arthritis:Correlation between interferon lambda 1 (interleukin 29) and antimutated citrullinated vimentin antibody levels[J].Autoimmunity,2017,50(2):82.
[15]Stavre Z,Upchurch K,Kay J,et al.Differential Effects of Inflammation on Bone and Response to Biologics in Rheumatoid Arthritis and Spondyloarthritis[J].Current rheumatology reports,2016,18(12):72.
[16]Blazek K,Eames HL,Weiss M,et al.IFN-lambda resolves inflammation via suppression of neutrophil infiltration and IL-1beta production[J].The Journal of experimental medicine,2015,212(6):845.

