慢性阻塞性肺疾病急性加重期外周血淋巴细胞免疫分型变化研究的临床价值
杨东升,刘培培,侯松萍
(吉林大学中日联谊医院 呼吸科,吉林 长春130033)
世界银行和世界卫生组织的资料表明,2020年,COPD将位居世界疾病经济负担的第5位,其居高不下的发病率和死亡率,为人类生存及经济负担提出了巨大挑战[1]。目前某些研究结果初步显示细胞免疫参与了COPD的病因、发病机制、恢复及预后整个过程[2,3]。如果能通过测定COPD患者外周血淋巴细胞亚群的变化,准确评估COPD急性加重期患者的气道炎症以感染为主,还是免疫损伤为主,或者两者并存,此外,还能对患者免疫力高低做出准确评估,对于指导临床应用激素或增强免疫力的药物时机的选择有重要意义。现本文通过检测COPD患者外周血淋巴细胞的免疫分型变化,了解T细胞、B细胞、NK细胞等在COPD急性加重期患者的变化,对COPD病人免疫功能进行评估,准确判断患者是否存在细胞免疫功能紊乱或机体免疫力低下,或者两者并存,为COPD患者何时用激素、何时用增强免疫力的药物提供一定的实验室依据。
1 材料与方法
1.1临床资料
选取吉林大学中日联谊医院2014年12月至2015年9月慢性阻塞性肺疾病患者90例,纳入标准:均符合中华医学会呼吸病学会2013年修订版慢性阻塞性肺疾病诊治指南[4]。排除标准:不能配合完成支气管舒张实验者,合并其它心肝肾等疾病者,近期使用激素、免疫抑制剂等影响免疫功能的患者,伴有其他部位慢性炎症的患者。确诊90例COPD患者,年龄35-77岁,平均65.01±9.76岁,其中男35例,女55例, 根据COPD患者肺功能FEV1占预计值百分比的数值结果,把患者分为Ⅰ(25例)、Ⅱ(18例)、Ⅲ(22例)、 Ⅳ(25例)四组;根据患者血气分析结果分为呼吸衰竭组(41例)和无呼吸衰竭组(49例);根据mMRC呼吸困难症状评级结果分为轻度(22例)、中度(21例)、重度(21例)、极重度(26例)四组[4];根据患者病程长短分为≤10年(32例)、10-20年(28例)、≥20年(30例)三组;分别测定上述观察指标的不同组别患者外周血淋巴细胞免疫分型CD3+、CD3+CD4+、CD3+CD8+、CD3-CD19+、CD3-CD56+、CD3+CD4+/CD3+CD8+比值。另选取25例健康人作为正常对照组,年龄36-75岁,平均65.89±11.67 岁,其中男10例,女性15例。
1.2方法
1.2.1仪器和试剂 CD45-FITC/CD4-PE/CD8-ECD/CD3- PC5(货号6607013);细胞裂解液:OptiLyse○RNO-lysing Solution(货号:A11894);流式细胞仪:Beckman Coulter FC500;以上所有试剂均购自美国Beckmen Coulter公司。肺功能测定采用MasterScreenPneumo型肺功能仪 (德国康尔福盛CareFusion公司),技术标准参考2005年美国胸科学会和欧洲呼吸协会共同制定的肺功能测试标准[5];血气分析测定采用GEMpremier3500分析检测仪(美国Instrumentation Laboratory公司)。
1.2.2血液样本制备 采集患者及正常健康人外周血2 ml,加入到EDTA抗凝的真空管中混匀。取两只流式细胞仪上样管,分别命名为同型对照管和实验管,每管中均加入100 μl抗凝全血,然后分别加入20 μl同型对照抗体和CD45-FITC/CD4-PE/CD8-ECD/CD3-PC5抗体和CD45-FITC/CD56-PE/CD19-ECD/CD3-PC5,充分混匀,避光室温孵育15 min;然后向每管中加入红细胞裂解液500 μl,充分混匀,避光孵育10 min后加入500 μl PBS,1 000 r/min离心5 min,弃上清,每管加入500 μl鞘液,混匀,等待上机检测。血气分析动脉血由专业人员采集,采用一次性威世德动脉血气针,型号3302通用性动脉血气针,由全自动血液细胞分析仪读取结果。
1.2.3指标测定 外周血淋巴细胞亚群及NK细胞检测均采用流式细胞检测技术,由我院中心实验室专人操作检测。每管获取细胞1×104个,以荧光抗体染色阳性细胞所占百分比记录结果。
1.3统计学方法
2 结果
2.1COPD 组与正常对照组的性别、年龄、身高无显著性差异,见表1。

表1 COPD急性加重期患者与正常人的一般资料比较
2.2COPD急性加重期患者不同肺功能分级外周血淋巴细胞免疫分型结果
肺功能III级组与正常对照组相比CD3+CD4+淋巴细胞明显增高(P<0.05),具体见表2。
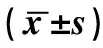
表2 COPD患者不同肺功能分级的外周血淋巴细胞免疫分型结果
与正常对照组相比较*P<0.05
2.3COPD急性加重期患者不同血氧程度的外周血淋巴细胞免疫分型结果
CD3+及CD3+CD4+淋巴细胞无呼吸衰竭组较呼吸衰竭组及正常对照组明显增高(均P<0.01)。CD3-CD56+NK细胞呼吸衰竭组较无呼吸衰竭组明显增高。CD3+CD4+/CD3+CD8+淋巴细胞比值无呼吸衰竭组与呼吸衰竭组及正常对照组相比均明显增高(P<0.05),具体见表3。
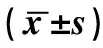
表3 COPD患者不同血氧程度的外周血淋巴细胞免疫分型结果
与正常对照组比较*P<0.05,**P<0.01;无呼衰组与呼衰组比较★P<0.05,★★P<0.01
2.4COPD患者呼吸困难不同严重程度的外周血淋巴细胞免疫分型结果
CD3+淋巴细胞mMRC 0-1级组与正常对照组及mMRC3-4级组比较,均明显增高,前者P<0.05,后者P<0.01;mMRC 2-3级组较mMRC3-4级组明显增高(P<0.05)。CD3+CD4+淋巴细胞mMRC2-3级组较正常对照组及mMRC3-4级组明显增高(均P<0.01),CD3+CD56+NK细胞mMRC3-4级组与mMRC 0-1级组比较明显增高(P<0.05),见表4。
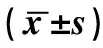
表4 COPD患者呼吸困难不同程度的外周血淋巴细胞免疫分型结果
与正常对照组比较*P<0.05,**P<0.01;mMRC 0-1级组与mMRC3-4级组比较,◢P<0.05,◢◢P<0.01;mMRC 2-3级组与mMRC3-4级组比较★P<0.05,★★P<0.01
2.5COPD急性加重期患者不同病程外周血淋巴细胞免疫分型结果
CD3+淋巴细胞病程≤10年组较正常对照组明显升高(P<0.05),见表5。
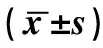
表5 COPD急性加重期患者不同病程外周血淋巴细胞免疫分型结果
与正常对照组比较*P<0.05
3 讨论
慢性阻塞性肺疾病是发病率居高不下的慢性炎症性疾病,越来越多的研究表明T、B、NK细胞等在调节COPD的慢性炎症反应中起到了重要作用,因此,研究免疫性致病因素在COPD疾病进展中的作用具有重要意义。本文表3显示:COPD急性加重期无呼吸衰竭的患者,外周血CD3+、CD3+CD4+淋巴细胞、CD3+CD4+/CD3+CD8+比值明显高于呼吸衰竭组及正常对照组;表4显示CD3+淋巴细胞mMRC 0-1级组与正常对照组及mMRC3-4级组比较,均明显增高;mMRC 2-3级组较mMRC3-4级组明显增高(P<0.05);表4还显示CD3+CD4+淋巴细胞mMRC2-3级组较正常对照组及mMRC3-4级组明显增高(均P<0.01)。结合表2显示COPD肺功能III级患者也以CD3+CD4+淋巴细胞增高为主;表5显示CD3+淋巴细胞病程≤10年组较正常对照组明显升高(P<0.05)。这些结果提示COPD早、中期患者,外周血CD3+、CD3+CD4+淋巴细胞反应明显强于正常人和呼吸衰竭病人。另外,表3还显示CD3-CD56+NK细胞呼吸衰竭组较无呼吸衰竭组明显增高,并且,表4也显示CD3+CD56+NK细胞mMRC3-4级组与mMRC 0-1级组比较也明显增高。总之,上述结果表明COPD患者早期至中期阶段,无呼吸衰竭之前,以CD3+、CD3+CD4+淋巴细胞参与COPD的炎症反应为主;有呼吸衰竭时以CD3-CD56+NK细胞参与COPD的炎症反应为主。
表3显示无呼吸衰竭的COPD患者其CD3+、CD3+CD4+、CD3+CD4+/CD3+CD8+比值明显增高,这可能是由于COPD患者出现呼吸衰竭前,机体的免疫系统受COPD急性加重因素的刺激,患者体内多种类型的淋巴细胞被显著激活、积极参与机体的免疫反应所致;表3还显示呼吸衰竭的COPD患者其CD3+、CD3+CD4+、CD3+CD4+/CD3+CD8+比值与正常对照组相比,无明显增高,考虑其原因是随着病情加重,COPD患者出现呼吸衰竭,机体缺氧、二氧化碳潴留严重,免疫功能受到一定程度的损伤,机体的免疫系统受COPD急性加重因素的刺激后,CD3+CD4+/CD3+CD8+虽然增高,但是,免疫系统对外来刺激免疫应答反应强度有限所致。
CD56分子是自然杀伤细胞 (NK细胞)表面主要的表面标志,NK细胞不仅是机体内的第一道免疫防御屏障,而且也具有免疫调节功能,对T、B淋巴细胞、骨髓干细胞具有调控作用(免疫自稳);在机体抗感染过程中也发挥重要作用。本文研究结果显示呼吸困难评分mMRC3-4级组以CD3+CD56+增高为主,CD3-CD56+NK细胞呼吸衰竭组较无呼吸衰竭组明显增高,说明NK细胞参与了COPD极重度患者的疾病进展过程,可能随着患者病情加重,NK细胞逐渐被激活,进一步发挥其免疫调控作用和抗感染作用。有研究结果表明COPD患者外周血NK、NK-T细胞数量下降,并且其细胞毒性功能也降低[6]。Ying Tang等研究表明NK细胞在COPD急性发作期数量显著增高,但是其分泌IFN-γ的功能下降[7]。因此,NK细胞在COPD患者急性加重期的数量和功能变化还有待进一步研究。
[1]Toy E L,Gallagher K F,Stanley E L,et al.The economic impact of exacerbations of chronic obstructive pulmonary disease and exacerbation definition:a review[J].COPD,2010,7(3):214.
[2]Tan D,Fernandez S,Price P,et al.Impaired function of regulatory T-cells in patients with chronic obstructive pulmonary disease (COPD)[J].Immunobiology,2014,219(12):975.
[3]Jia H,Yongchang S,Yu H,et al.Imbalance between subpopulations of regulatory T cells in COPD.[J].Thorax,2013,68(12):1131.
[4]慢性阻塞性肺疾病诊治指南(2013年修订版),中华医学会呼吸病学分会慢性阻塞性肺疾病学组[J].中华结核和呼吸杂志,2013,36(4):255.
[5]Pellegrino R,Viegi G,Brusasco V,et al.Interpretative strategies for lung function tests.[J].European Respiratory Journal,2005,26(5):948.
[6]Urbanowicz R A,Lamb J R,Todd I,et al.Altered effector function of peripheral cytotoxic cells in COPD[J].Respiratory Research,2009,10:53.
[7] Tang Y,Li X,Wang M,et al.Increased numbers of NK cells,NKT-like cells,and NK inhibitory receptors in peripheral blood of patients with chronic obstructive pulmonary disease[J].Clinical & Developmental Immunology,2013,2013(5):198.

