静态磁场对生物滴滤池强化的研究——以三氯乙烯废气的去除及细菌群落结构研究为例
权 跃,吴 昊,尹振浩,郭春雨,尹成日,*
静态磁场对生物滴滤池强化的研究——以三氯乙烯废气的去除及细菌群落结构研究为例
权 跃1,2,吴 昊2,尹振浩3,郭春雨2,尹成日2,3*
(1.延边大学农学院环境科学系,吉林 延吉 133002;2.延边大学理学院化学系,吉林 延吉 133002;3.延边大学分析测试中心,吉林 延吉 133002)
构建了实验室规模磁场强化的生物滴滤池(MF-BTF),并设对照生物滴滤池(S-BTF),以火山石为载体,接种活性污泥,处理目标废气三氯乙烯(TCE).研究了不同磁场强度下,2种生物滴滤池在稳定运行期间对TCE的去除效果,并采用高通量测序技术对滴滤池中细菌群落结构与功能进行了分析.实验结果表明:在好氧条件下,当空床停留时间(EBRT)为202.5s,苯酚浓度为0.20g/L,TCE浓度范围为53.6~337.1mg/m3时,对TCE的去除效果依次为MF-BTF(60.0mT)>MF-BTF(30.0mT)>S-BTF (0.0mT)>MF-BTF(130.0mT),其去除率(RE)和最大去除容量(EC)分别为92.2%~45.5%, 2656.8mg/(m3×h); 89.8%~37.2%, 2169.1mg/(m3×h); 89.8%~29.8%, 1967.7mg/(m3×h); 76.0%~20.8%, 1697.1mg/(m3×h).高通量测序结果表明:磁场强度为60.0mT时,细菌群落均匀度(Shannon index, Simpson index)及丰富度(OTUs,Chao1,ACE)均小于0.0mT的情况;但是60.0mT下优势门、纲、属为Proteobacteria, Gammaproteobacteria,,丰度明显大于0.0mT,丰度分别为73.3%,36.8%,34.7%;69.6%,18.2%,10.9%.实验结果表明合适的磁场强度可以增大优势菌群的丰度,提高对TCE的去除效果.本实验为提高生物滴滤池的工业废气处理效果提供了有效的借鉴,具有广泛的应用前景.
磁场;生物滴滤池;三氯乙烯;细菌群落;高通量
生物法净化处理有机废气(VOCs)具有高效、低能耗、运行管理方便等特点,目前成为主要的处理方法[1].生物处理技术中生物转鼓和膜反应器对废气处理效果好,但是前者密封要求高,工程放大比较困难;后者的膜材料价格高,成本高于其他生物反应器[2].而生物滴滤技术具有占地面积小、操作简单、压降低,填料使用寿命长,耐酸代谢产物的优势能力[3-4].但由于疏水性VOCs的溶解度小,气液传质受限制,生物滴滤池对其处理效果差.
近年来出现很多提高生物滴滤池对疏水性有机废气降解效果的新技术,如添加表面活性剂、构建真菌生物滴滤池、组合的生物过滤技术等.表面活性剂可以增加疏水性VOCs在气液界面的传质速率及在水相中的溶解度,能有效降低气液间的传质阻力[5],如皂苷、十二烷基磺酸钠均能提高正己烷在生物反应器中的降解效果[6-7].而海藻酸R810-60未能提高生物滤池降解TCE,四氯乙烯性能[8].表面活性剂容易被微生物降解,产生一些中间副产物,另外表面活性剂具有清洗作用,减少生物量[9].真菌比细菌对疏水性VOCs具有很高的去除能力,但是真菌需要特定的生长条件(pH值、湿度、温度及营养物质)[10],菌丝的过度生长会使反应器压降升高,引起填料堵塞等问题.组合生物过滤技术中紫外光解技术作为一种化学预处理技术,把疏水性有机废气光解为可溶的小分子化合物,提高生物滴滤池处理效果[11],但是容易产生O3和一些毒性更强的副产物.另外,光催化氧化技术是在紫外光的照射下,利用半导体如TiO2、ZnO、WO3、FeTiO3和SrTiO3等材料对有机污染物进行光诱导使其分解成水溶性较高且可生化性强的物质[12].但是,光催化氧化技术费用高,易产生很多种有害副产物,而且存在催化剂易失活的缺点,使得光解效率下降[13-15].
因此寻求一种高效、经济环保的生物滴滤技术对提高对疏水性VOCs的降解效果十分必要.磁技术强化微生物降解有机物是近几年新兴的一项生物强化技术,作为一种环保、无毒、无须额外的能源和药剂投入的方法[16],可以提高废水中氨氮、COD、甲醛、苯酚、染料和重金属的去除效果[17-20].但到目前为止,磁场在废气协同生物降解中未见报道.三氯乙烯(TCE)作为一种优良的溶剂广泛应用于多个行业,由于不合理的排放和意外泄露,它被大量释放到环境中[21].TCE属于氯代挥发性持久有机污染物,在环境中很难降解,所以探索高效、经济、环保的有效治理途径尤为重要.
基于上述研究背景分析,本研究以TCE为目标废气,构建了实验室规模磁场强化的生物滴滤池(MF-BTF)和对照生物滴滤池(S-BTF),考察稳定期运行期间,不同磁场强度对TCE降解效果的影响,并应用高通量测序技术对60.0mT、0.0mT、IAS(原始活性污泥)中细菌群落结构和功能进行分析.以期为磁场条件下提高生物滴滤技术对疏水性VOCs的处理效果提供有效借鉴.
1 材料与方法
1.1 生物滴滤池的构建与启动
本实验在室温(21±2)℃条件构建了外加磁场MF-BTF反应器及其对照反应器S-BTF,如图1所示.滴滤池材料为有机玻璃,高度为1000mm,内径为110mm,工作容积可达2.7L,内部填料为粒径8~10mm的长白山火山石.磁场是由两块磁铁(长120mm,宽100mm)产生的异级磁场,磁铁材料为钕铁硼,磁场强度由HT20型特斯拉计(上海亨通磁电技术有限公司)测量.
向MF-BTF反应器内注入已驯化的活性污泥并于24h后排放.反应器采用气液逆流的方式运行.即TCE与空气混合后从滴滤池底部通入,通过质量流量计控制进气浓度和流量,流量设置为0.8L/min,对应的空床停留时间(EBRT)为202.5s;无机盐营养液通过蠕动泵每隔8h,由滴滤池顶部喷洒10min,速度为3L/h,每2d更换一次营养液,每天都对营养液的pH值进行监测,并调节pH值为7.2左右.
1.2 微生物的培养与接种
好氧活性污泥取自延吉市污水处理厂的曝气池.取回的活性污泥静置24h,弃去上清液,加入营养液在水桶内曝气培养一周.之后对其进行驯化,即每隔2d排除上清液,添加新的营养液,营养液中逐渐减少乙酸钠的含量,相反增大苯酚浓度至0.20g/L,并加入低浓度的TCE溶液,直到培养驯化60d结束.营养液为:0.60g/L乙酸钠,0.46g/L磷酸氢二钾,0.38g/L磷酸二氢钾,0.48g/L硫酸铵,0.40g/L氯化钠,0.1g的微量元素混合液,pH值调节为7.2.微量元素混合液(g/L)的成分有: CuSO4·5H2O,0.01;KI,0.01;CaCl2·2H2O,0.132;Na2MoO4·2H2O,0.02;KAl(SO4)2·12H2O,0.02;MnSO4·H2O,0.045;CoCl2·6H2O,0.05;FeCl3,0.12;H3BO3,0.05; ZnSO4·7H2O,0.075.
1.3 分析方法
TCE浓度由岛津GC-2010气相色谱仪测定,FID检测器,色谱柱型号为Rtx-1701 (30m× 0.25mm×0.25μm).分析条件为:进样口和检测器的温度为220℃,毛细管柱的温度为80℃,载体的氮气流速为136.3mL/min,柱体流速为1.32mL/ min.采用分流模式,分流比为100.在此条件下,TCE的保留时间约为2.59min.
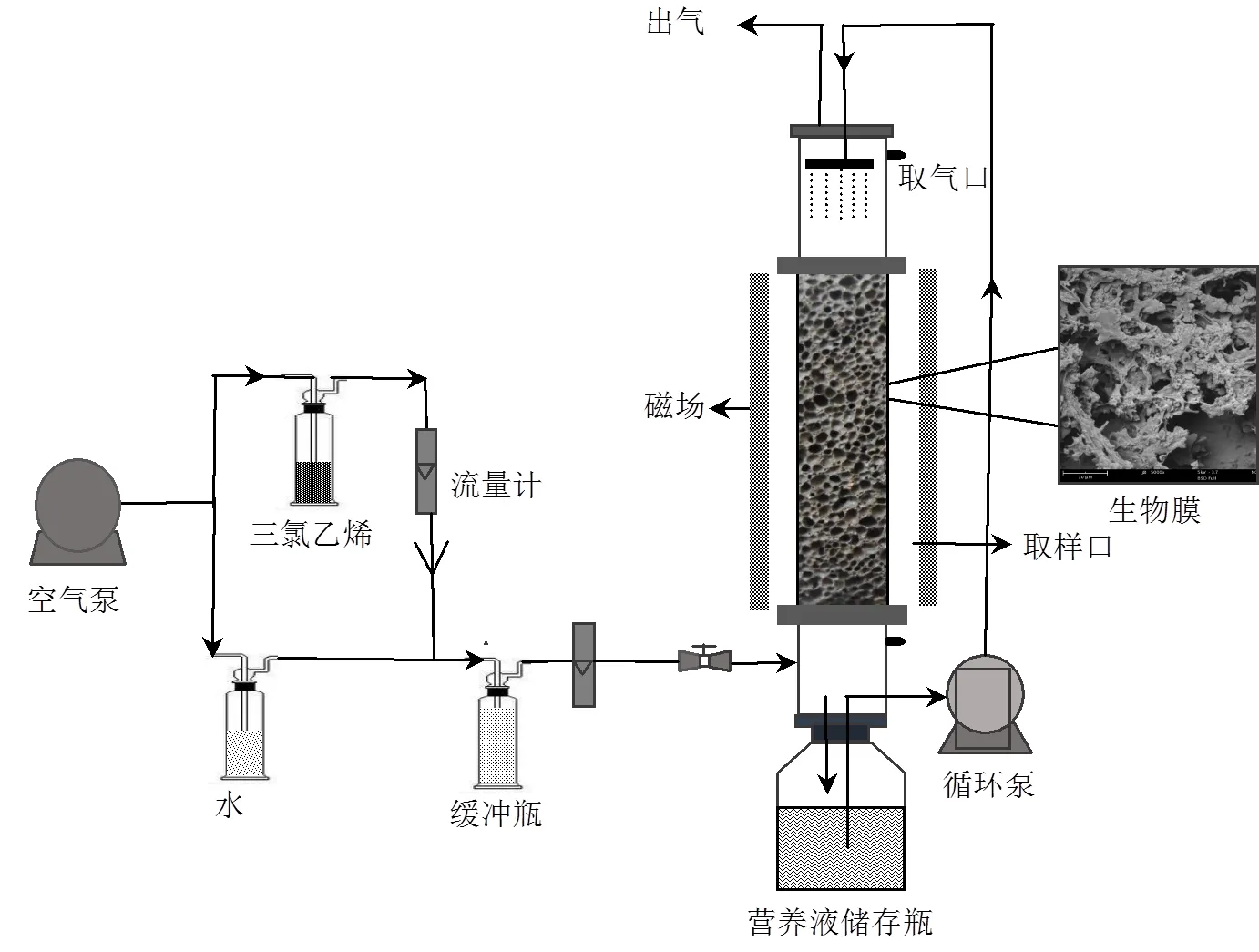
图1 磁场强化生物滴滤池装置示意及填料挂膜后SEM图像
1.4 细菌群落分析
1.4.1 基因组DNA提取 为分析有、无磁场对生物膜中细菌群落结构的影响,本实验选取MF-BTF反应器最佳磁场强度为60.0mT(31d, 182.4mg/m3TCE)和S-BTF反应器(0.0mT,15d, 171.1mg/m3TCE)下的生物膜.取自延吉市污水处理厂的原始活性污泥(IAS) 作为对照.按照Power Soil DNA试剂盒的说明提取基因组DNA.提取的DNA在1%的琼脂糖凝胶电泳上检测,并测定DNA浓度,稀释至5.0ng/μL待用.DNA样品在进行后续的分析之前贮存在-80℃的温度下.
1.4.2 PCR扩增反应 对细菌DNA的16S rRNA的V4区域进行扩增,引物为515F(5¢- GTGCCAGCMGCCGCGGTAA-3¢)和806R(5¢- GGACTACHVGGGTWTCTAAT-3¢).PCR反应采用50.0μL体系,包含:0.3μL Taq DNA聚合酶(上海生工,5.0U/μL), 6.0μL dNTP mix (2.5mmol/L), 0.6μL BSA, 1.2μL 引物(10μmol/L), 6.0μL 10×ExTaq 缓冲液, 1.0μL DNA和43.7μL无菌去离子水.PCR反应条件为:94℃预变性5.0min, 94 ℃下变性1min,55℃复性30s, 72℃延伸45s,重复31个循环,最终在72℃下延伸10.0min.扩增产物在加入嗅化乙锭的2%的琼脂糖凝胶上检测.使用TaKaRa DNA Fragment Purification Kit Ver.2.0进行DNA纯化回收.
1.4.3 高通量测序 使用TruSeq® DNA PCR- Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用HiSeq2500PE250进行上机测序(北京诺禾致源生物信息科技有限公司).
1.4.4 生物信息学分析 对原始序列截去Barcode和引物序列,后使用FLASH软件对每个样品的reads进行拼接,得到的拼接序列为原始Tags数据[22];再对其经过严格的过滤处理得到高质量的Clean Tags[23].之后参照Qiime的Tags质量控制流程进一步对Tags进行截取和长度过滤[24];所得Tags序列通过UCHIME Algorithm[25]与数据库(Gold database)进行比对检测、去除嵌合体序列[26],从而得到最终的有效数据(Effective Tags).对所有样品的Effective Tags进行聚类,以97%的一致性将序列聚类组合为OTUs,该OTUs是基于Uparse软件的距离矩阵[27].对OTUs代表序列用Mothur方法与SILVA的SSUrRNA数据库进行物种注释分析(设定阈值为0.8-1),获得分类学信息并分别在各个分类水平,统计各样本的群落组成.使用Qiime软件(Version 1.7.0)计算Chao1,Shannon,Simpson,ACE,Goods-coverage指数,使用R软件(Version 2.15.3)绘制稀释曲线等.原始数据已被上传到NCBI数据库, SRA: SRP1104671.
2 结果与讨论
2.1 磁场强度对生物滴滤池去除性能的影响
磁现象是一种普遍存在的物理现象,人们每时每刻都生存在地球这个大磁场之中.有研究表明,外加磁场和生物体自身的磁场均能对生物体代谢产生影响,即生物磁效应[28].低磁场强度对微生物生长有正效应,提高其对有机物的降解能力,然而磁场强度过大,起抑制作用[29].因此,为了确定不同磁场强度对反应器性能的影响,本实验在反应器稳定运行期,以0.20g/L苯酚作为共代谢底物,EBRT为202.5s,探讨了0.0,30.0,60.0和130.0mT条件下,两个种反应器对TCE的降解效果,进气浓度为53.6~337.1mg/m3条件下,结果见图2.
评价生物滴滤池性能的主要指标之一是有机物的去除率 (RE),RE是指处理后有机物浓度占进气浓度的比率.从图2可以看出,无论是S-BTF还是MF-BTF,随着TCE浓度的增大,RE都呈现缓慢下降的趋势.在稳定期1~19d, TCE进气浓度控制在53.6~326.8mg/m3,S-BTF(0.0mT)的RE从89.8%下降到29.8%;而在MF-BTF中,磁场强度为30.0mT, RE从89.8%下降到37.2%,由此说明在开始几天RE相差不多,但随着时间的延长,磁场对提高生物滴滤池降解TCE效果较为明显,尤其是到19d,MF-BTF的RE降至37.2%,大于S-BTF反应器的29.8%.而接着在21~39d, MF-BTF反应器中磁场强度为60.0mT,TCE浓度为53.6~326.8mg/m3,RE从92.2%下降到45.5%.由此说明,60.0mT磁场强度下对TCE的降解效果好于30.0mT和0.0mT.接着增大磁场强度为130.0mT,此时的TCE浓度控制为58.7~ 337.1mg/m3,RE为76.0%~20.8%,此时RE最差,甚至小于0.0mT,这说明当磁场强度为130.0mT时,磁场对生物滴滤的TCE降解起到抑制作用.
评价生物滴滤池性能的另一个主要指标是有机物的降解能力(EC),EC是指单位体积滤料在单位时间内有机物的降解量.进气负荷(ILR)对EC的影响见图3.由图3可知,EC均表现为相同的趋势,随着进气负荷的增大,EC均表现为先增大,增大到某一值后,均表现为下降趋势.4种条件下对EC的影响趋势为MF-BTF(60.0mT) > MF- BTF (30.0mT) > S-BTF (0.0mT) > MF-BTF (130.0mT).最大的EC在这4个阶段分别为 2656.8,2169.1,1967.7和1679.1mg/(m3•h),所对应的进气负荷(ILR)分别为4253.0, 3732.4, 4681.4和4290.8mg/(m3•h).截至目前,利用生物滴滤池去除TCE的文献报道仅有一篇[30],G4作为降解菌,陶粒为填料,牛肉汤为营养液,苯酚为共代谢底物,EBRT为3.8~9.8min, TCE进气负荷为492.0~1708.0mg/(m3×h),所获得的最大的EC仅为1167mg/(m3×h).由此可见,MF-BTF (60.0mT)对TCE的去除效果较好,其EC值[2656.8mg/(m3×h)]是上述数值的近2倍.
通过对上述RE和EC的评价,表明60.0mT磁场强化下生物滴滤池对TCE去除效果较好.已有研究表明弱磁场或中等强度的磁场可以促进微生物生长,如370mT磁场强度下,通过缩短生长滞后期和对数期,生长速度提高28%,活性增加10%,苯酚的降解率提高34%[19].在17mT磁场强化下可促进等氨氧化菌的生长,提高氨氧化速率,从而促进亚硝酸盐的积累[31].另外磁场可以提高活性污泥的污染物去除效果,外加80mT磁场的活性污泥系统较对照系统的COD、NH3-N、PO43--P去除率分别提高10.7%、0.4%和6.1%[32].20~ 40mT磁场,可以促进活性污泥在低温5℃产生较多的不饱和脂肪酸,提高脱氢酶含量[33].除此之外,磁场条件下可以提高培养液里溶解氧的含量,从而促进需氧菌的生长,进而提高生物膜中的溶解氧,提高废水废气的微生物降解效果[34].通过以上研究分析,作者认为在外加60.0mT磁场下的生物滴滤器对TCE具有较好的降解效果,分析原因为生物膜中的溶解氧含量增加,促进好氧菌的生长速度,生物膜中胞外多糖和蛋白质含量增加,功能酶的含量提高;此外,在磁场强化下,微生物抵御不良条件的能力也增强.

图2 0, 30.0, 60.0, 130.0mT下的进气浓度与去除率曲线

图3 0.0,30.0,60.0,130.0mT下,TCE进气负荷对生物滴滤池去除能力的影响
2.2 细菌群落多样性分析
本次测序各样品原始序列数分布均匀,基本在160,000条左右,如表1所示.除去识别错误以及质量差的序列后,有效序列数在IAS、MF- BTF、S-BTF中分别为161,309、157,078和152, 160条.对不同样品的有效序列在97%一致性阈值(148,419)下的Alpha Diversity分析指数进行统计,见表1.物种多样性有两种含义:其一是丰富度,指的是物种数目的多寡;其二是均匀度,指的是各物种个体数目分配的均匀程度.OTUs、Chao1和ACE指数反映着细菌的丰富度; Shannon index 和Simpson index反映了细菌的均匀度[35].
由表1可见,细菌的丰富度和均匀度依次为IAS>MF-BTF>S-BTF.这是由于IAS是直接取自污水处理厂,含有较多的细菌.而活性污泥经过驯化后,通过竞争和选择作用,一些细菌被淘汰,适应性强的细菌存活下来,致使丰富度和均匀度均变小.而MF-BTF中细菌的丰富度和均匀度均小于S-BTF,说明一些细菌不适应在磁场条件下生存,磁场的存在对有些细菌产生抑制作用,而有些细菌适合生长在磁场条件下.所有样品的测序深度均为0.99,表明获取自每一样品中的序列可以覆盖细菌的多样性.

表1 MF-BTF,S-BTF和IAS中细菌丰富度和多样性指数
稀疏曲线进一步解释了样品测序深度的合理性和准确性,当曲线趋向平坦时,说明测序数据读取量逐渐合理,并间接反映样品中物种的丰富度.该曲线是从样品中随机抽取一定测序量的数据,统计它们所代表物种数目(即OTUs数目),以抽取的测序量与对应的物种数来构建曲线,如图4.由图4可知,MF-BTF中的OTUs数目始终低于IAS和S-BTF,说明MF-BTF中细菌丰富度最小;而当所读取的序列数超过150,000时,曲线趋于平缓,说明测序达到了要求,如果继续读取更多的序列数,新产生的物种很少,会造成浪费.

图4 高通量测序中IAS,S-BTF和MF-BTF细菌群落稀释曲线
2.3 细菌群落结构分析
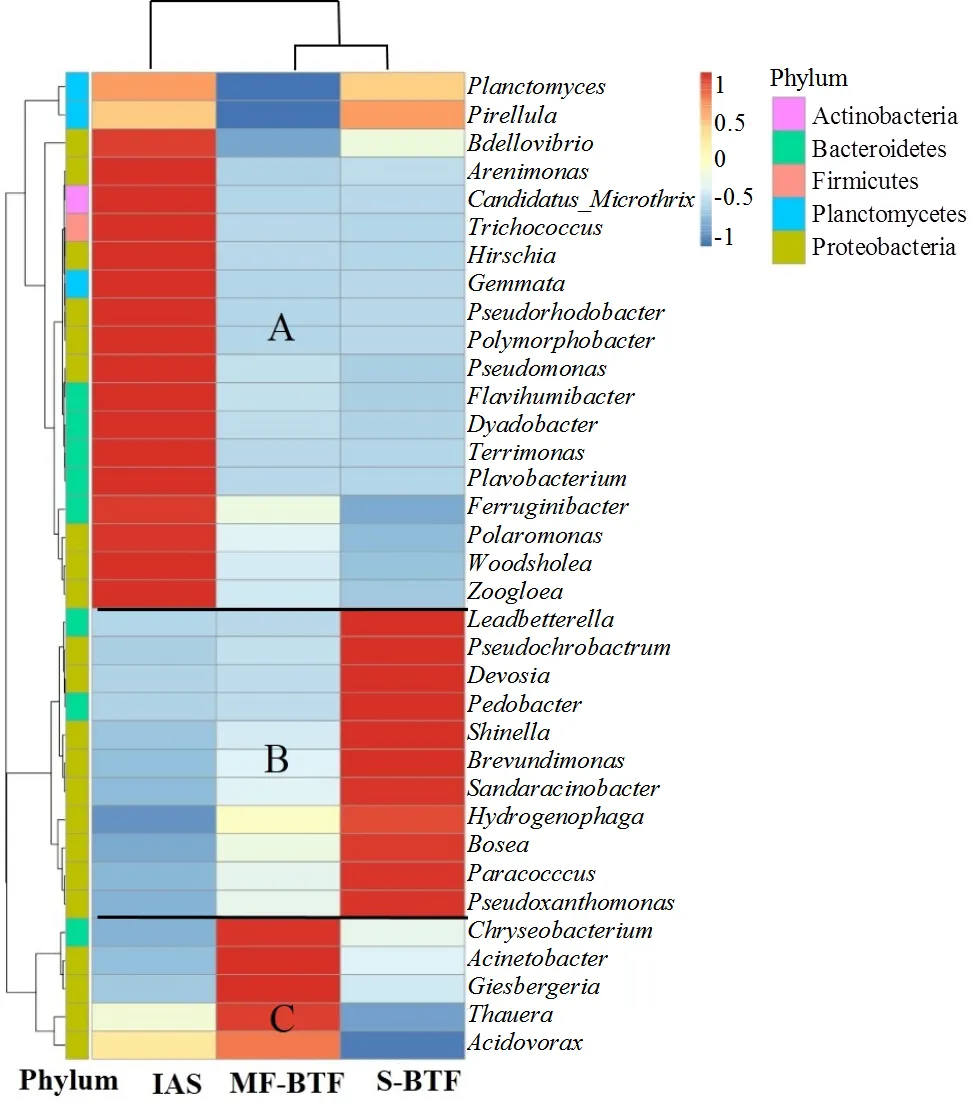
图5 细菌群落层次聚类
根据所有样品在属水平的物种注释及丰度信息,选取丰度排名前35的属,根据其在每个样品中的丰度信息,从物种和样品两个层面进行聚类,绘制成热图,用来直观的观察样品中细菌群落结构的差别,如图5所示.3个样品被聚为2类,IAS单独为一类,2个反应器中细菌群落被聚为一类,主要原因为IAS为污水厂原始活性污泥,而MF-BTF和S-BTF均经过苯酚和TCE的驯化,所以被聚为一类.由图5可见所有细菌分成A组、B组、C组3大类,群落丰度在3个样品中差别明显.A组细菌的丰度在IAS中较大,B组细菌的丰度在S-BTF中较大,C组细菌在MF-BTF中较大,环境差别造成了群落丰度的明显差别.
为了进一步明确3个样品细菌群落的差别,对所有样品进行均一化处理绘制韦恩图(图6).从图6可知,3个样品中共有的OTUs为785,所占比例为28.0%;IAS和MF-BTF中共有的OTUs为973,所占比例为48.8%;IAS和S-BTF样品中共有的1008,所占比例为50.2%,MF-BTF和S-BTF中共有的OTUs为974,占总OTUs的54.3%.由此说明MF-BTF和S-BTF中细菌群落相似性最大,主要是由于2者所处的环境相似性大于IAS,而受磁场的影响二者的相似性仅为54.3%,说明磁场对细菌群落结构有很大影响.

图6 高通量测序中IAS, S-BTF和MF-BTF细菌群落韦恩
2.4 细菌在门、纲、属分类单元的差别
选取每个样品在分类水平(门、纲、属)上最大丰度排名前10的物种,做成物种相对丰度柱形累加图,如图7所示.图7a中,在IAS、MF-BTF、S-BTF中排名前10门的相对丰度之和占总细菌的比例分别为86.9%、87.5%和88.4%. Bacteroidetes和Proteobacteria是其中2个优势门.Bacteroidetes的相对丰度在IAS中为30.7%,而在MF-BTF、S-BTF中明显下降仅为10.1%, 8.7%.另外Proteobacteria经过驯化在MF-BTF和S-BTF中所占丰度为73.3%和69.6%,明显大于IAS中的46.2%.

图7 IAS、MF-BTF和S-BTF中细菌群落在门、纲、属水平的相对丰度
这表明驯化环境抑制Bacteroidetes的生长,而Proteobacteria门的丰度在TCE降解过程中显著增加,是苯酚共代谢降解TCE的优势菌门.已报道的苯酚降解优势菌门也属于Proteobacteria,与本研究结果一致[36-37].
图7b表明了3个样品中丰度较大的前10个细菌纲.在IAS、MF-BTF和S-BTF中,前10个纲的细菌分别占总细菌的81.4%,85.9%,86.1%.优势纲为Gammaproteobacteria,在MF-BTF中最高为36.84%,而在S-BTF和IAS中分别18.2%和10.4%.Gammaproteobacteria作为优势纲与已报道的作为苯酚降解菌纲一致[36-37].
图7c描述了前10个丰度较大的细菌属.在IAS、MF-BTF和S-BTF中,前10个属的细菌分别占总细菌丰度的20.2%,55.0%和49.2%.其中优势属属于Proteobacteria门, Gammaproteobacteria纲.其相对丰度MF-BTF (34.7%)中的为S-BTF(10.9%)中的3倍,为IAS(5.2%)中的6倍.这表明在MF-BTF反应器中磁场可以促进优势属生长,明显提高在细菌群落中的丰度sp. 已应用于多种污染物的生物修复中,如阿特拉津[38]、邻苯二甲酸二丁酯[39]、柴油[40]、萘[41]等.近年来,由于对苯酚具有较高的生物降解活性[42-44],而受到广泛关注,被应用到TCE的共代谢降解中.另外两种细菌属于和,二者以TCE和苯酚降解过程中的中间体作为碳源.在MF-BTF中,的相对丰度最大为4.2%,而S-BTF和IAS中仅为1.6%和0.6%.可降解多种有机氯农药,并利用其作为唯一碳源和能源[45],这意味着他可以降解TCE共代谢过程中的中间产物.sp.被报道为TCE共代谢的一种菌,另外还可以降解喹啉[46],聚丁二酸丁二醇酯薄膜[47]和有机酸[48-49]等.sp.的相对丰度在MF-BTF(3.8%)中高于S-BTF (2.2%),这可能与降解过程中产生的有机酸以及TCE共代谢降解有关.MF-BTF反应器中和的相对丰度明显高于S-BTF,表明磁场促进功能微生物的生长和苯酚加氧酶的产生,从而提高TCE去除效果.门、纲和属水平的细菌群落分析结果表明MF-BTF反应器中优势群落丰度大于S-BTF和IAS,从而提高MF-BTF反应器对TCE的降解效果.
3 结论
3.1 0.20g/L苯酚为共代谢底物,EBRT为202.5s,进气浓度为53.6~337.1mg/m3,不同磁场下生物滴滤池对TCE降解能力为60.0mT>30.0mT> 0.0mT>130.0mT.磁场强度为60.0mT下的生物滤池对TCE的RE为92.2%~45.5%,最大EC为2656.8mg/(m3×h),而无磁场(0.0mT)条件下的RE和最大EC仅为89.8%~29.8%和1967.7mg/ (m3×h).
3.2 高通量测序结果表明磁场对细菌群落结构影响明显,MF-BTF(60.0mT)和S-BTF(0.0mT)中的细菌群落聚为一类,但菌群相似率仅为54.3%.另外,MF-BTF(60.0mT)中细菌的丰富度、均匀度均低于S-BTF(0.0mT)和IAS,但是共代谢降解TCE的优势菌在门、纲、属水平分别为Proteobacteria、Gammaproteobacteria, MF-BTF(73.3%、36.8%、34.7%)中的相对丰度远大于S-BTF(69.6%、18.2%、10.9%)和IAS(46.2%、10.4%、5.2%).
[1] 郑江玲,朱润晔,於建明,等.生物滴滤塔同步降解多组分挥发性有机物的实验研究[J]. 中国环境科学, 2012,32(11):1971- 1978.
[2] Barbusinski K, Kalemba K, Kasperczyk D, et al. Biological methods for odor treatment-a review [J]. Journal of Cleaner Production, 2017,152:223-241.
[3] 刘秀红,周 瑶,孟雪征,等.气水比对曝气生物滤池N2O产生的影响 [J]. 北京工业大学学报, 2016,42(5):795-800.
[4] Hu J, Zhang L L, Chen J M, et al. Performance and microbial analysis of a biotrickling filter inoculated by a specific bacteria consortium for removal of a simulated mixture of pharmaceutical volatile organic compounds [J]. Chemical Engineering Journal, 2016,304:757-765.
[5] Kumari B, Singh S N, Singh D P. Characterization of two biosurfactant producing strains in crude oil degradation [J]. Process Biochemistry, 2012,47(12):2463-2471.
[6] Cheng Y, He H J, Yang C P, et al. Effects of anionic surfactant on n-hexane removal in biofilters [J]. Chemosphere, 2016,150:248- 253.
[7] Tu Y H, Yang C P, Cheng Y, et al. Effect of saponins on n-hexane removal in biotrickling filters [J]. Bioresource Technology, 2015,175:231-238.
[8] Kim J Q, Terkonda P K, Lee S D. Gaseous CAH removal by biofiltration in presence and absence of a nonionic surfactant [J]. Bioprocess Engineering, 1998,19(4):253-259.
[9] Cheng Y, He H, Yang C, et al. Challenges and solutions for biofiltration of hydrophobic volatile organic compounds [J]. Biotechnology Advances, 2016,34(6):1091-1102.
[10] 杨凯雄,李 琳,刘俊新.挥发性有机污染物及恶臭生物处理技术综述 [J]. 环境工程, 2016,34(3):107-111.
[11] Zhu R, Christian K, Cheng Z, et al. Styrene removal in a biotrickling filter and a combined UV-biotrickling filter: Steady- and transient-state performance and microbial analysis [J]. Chemical Engineering Journal, 2015,275:168-178.
[12] Shayegan Z, Lee C S, Haghighat F. TiO2photocatalyst for removal of volatile organic compounds in gas phase-A review [J]. Chemical Engineering Journal, 2018,334:2408-2439.
[13] Huang H, Huang H, Zhan Y, et al. Efficient degradation of gaseous benzene by VUV photolysis combined with ozone- assisted catalytic oxidation: Performance and mechanism [J]. Applied Catalysis B Environmental, 2016,186:62-68.
[14] Gunschera J, Markewitz D, Bansen B, et al. Portable photocatalytic air cleaners:efficiencies and by-product generation [J]. Environmental Science and Pollution Research, 2015,23(8): 7482-7493.
[15] He Z G, Li J, Chen J Y, et al. Treatment of organic waste gas in a paint plant by combined technique of biotrickling filtration with photocatalytic oxidation [J]. Chemical Engineering Journal, 2012, 200-202(34):645-653.
[16] 曹 贝,李锦祥,关小红.弱磁场强化零价铁对水中铬(Ⅵ)去除效能 [J]. 化工学报, 2017,68(8):3282-3290.
[17] 郭宝东. Ag/TiO2光催化剂在磁场中降解有机染料的研究 [J]. 环境保护与循环经济, 2016,36(9):43-45
[18] Łebkowska M, Narożniak-Rutkowska A, Pajor E. Effect of a static magnetic field of 7mT on formaldehyde biodegradation in industrial wastewater from urea-formaldehyde resin production by activated sludge [J]. Bioresource Technology, 2013,132(2): 78-83.
[19] Křiklavová L, Truhlář M, Škodová P, et al. Effects of a static magnetic field on phenol degradation effectiveness andgrowth and respiration in a fed-batch reactor [J]. Bioresource Technology, 2014,167(3):510-513.
[20] 靳小蓓,巢云龙,李宏君,等.磁场与微生物固定技术处理酸性镀铜废水[J]. 环境工程学报, 2016,10(3):1041-1047.
[21] 赵天涛,何 芝,张丽杰,等.甲烷及三氯乙烯驯化对垃圾填埋场覆盖土细菌群落结构的影响 [J]. 应用生态学报, 2017,28(5): 1707-1715.
[22] Magoč T, Salzberg S L. FLASH: fast length adjustment of short reads to improve genome assemblies [J]. Bioinformatics, 2011, 27(21):2957-2963.
[23] Bokulich N A, Subramanian S, Faith J J, et al. Quality-filtering vastly improves diversity estimates from Illumina amplicon Sequencing [J]. Nature methods, 2013,10(1):57-59.
[24] Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data [J]. Nature methods, 2010,7(5):335-336.
[25] Edgar R C, Haas B J ,Clemente J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011,27(16):2194-2200.
[26] Haas B J, Gevers D, Earl A M , et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454- pyrosequenced PCR amplicons [J]. Genome research, 2011,21(3): 494-504.
[27] Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads [J]. Nature methods, 2013,10(10): 996-998.
[28] 周晓玮,陆宇苗,陈 露,等.磁场对短程硝化工艺运行效果的影响[J]. 环境工程, 2017,35(3):34-37.
[29] Gao M X, Zhang J L, Feng H. Extremely low frequency magnetic field effects on metabolite of[J]. Bioelectromagnetics, 2011,32(1):73-78.
[30] Lee E Y. Continuous treatment of gas-phase trichloroethylene byG4in a two-stage continuous stirred tank reactor/trickling biofilter system [J]. Journal of Bioscience and Bioengineering, 2003,96(6):572-574.
[31] Filipič J, Kraigher B, Tepuš B, et al. Effect of low-density static magnetic field on the oxidation of ammonium byand by activated sludge in municipal wastewater [J]. Food Technology and Biotechnology, 2015,53(2):201-206.
[32] 隋卫燕,宋 鹏,韩甜甜,等.磁场强化活性污泥法处理城镇污水研究[J]. 安徽农业科学, 2011,39(33):20469-20471.
[33] Niu C, Liang W, Ren H, et al. Enhancement of activated sludge activity by 10-50mT static magnetic field intensity at low temperature [J]. Bioresource Technology, 2014,159:48-54.
[34] 靳 峰,刘 陶,李发荣,等.静磁场处理液体培养基对三种需氧菌生长的影响[J]. 生物医学工程学杂志, 2009,4:757-760.
[35] 张 秀,夏运生,尚艺婕,等.生物质炭对镉污染土壤微生物多样性的影响[J]. 中国环境科学, 2017,37(1):252-262.
[36] Fang H, Cai L, Yu Y L, et al. Metagenomic analysis reveals the prevalence of biodegradation genes for organic pollutants in activated sludge [J]. Bioresource Technology, 2013,129(2):209- 218.
[37] Jiang Y, Wei L, Zhang H N, et al.Removal performance and microbial community in a sequencing batch reactor treating hypersaline phenol-laden wastewater [J]. Bioresource Technology, 2016,218:146-152.
[38] Yang F, Jiang Q, Zhu M R, et al. Effects of biochars and MWNTs on biodegradation behavior of atrazine byDNS32 [J]. Science of the Total Environment, 2017,577:54-60.
[39] Thotsaporna K, Tinikulb R, Maenpuen S, et al. Enzymes in the-hydroxypheny lacetate degradation pathway of[J]. Journal of Molecular Catalysis B: Enzymatic, 2016,134:353-366.
[40] Chen Y, Yu B, Lin J J. et al. Simultaneous adsorption and biodegradation (SAB) of diesel oil using immobilizedon porous material [J]. Chemical Engineering Journal, 2016,289:463-470.
[41] 姜 岩,张晓华,杨 颖,等.基于约氏不动杆菌的萘生物降解特性[J]. 化工学报, 2016,67(9):3981-3987.
[42] 纪南南,武文丽,颜家保,等.耐酚异养硝化菌的筛选及其对苯酚降解特性的研究 [J]. 化学工程师, 2015,29(10):1-3.
[43] 张海涛,刘文斌,杨海君,等.一株耐盐高效苯酚降解菌的筛选、鉴定、响应面法优化与降酚动力学研究 [J]. 环境科学学报, 2016,36(9):3200-3207.
[44] Sharma V, Lin J. Draft genome sequence of phenol degradingsp. Strain V2, isolated from oil contaminated soil [J]. Brazilian Journal of Microbiology, 2017,48(2):189-190.
[45] Qu J, Xu Y, Ai G M, et al. Novelsp. PYR2degrades various organochlorine pesticides (OCPs) and achieves enhancing removal and complete degradation of DDT in highly contaminated soil [J]. Journal of Environmental Management, 2015,161:350–357.
[46] 李 静,李文英.喹啉降解菌筛选及其对焦化废水强化处理[J]. 环境科学, 2015,36(4):1385-1391.
[47] 丁子洋,于博文,王 硕,等.降解菌株的筛选及其对聚丁二酸丁二醇酯薄膜的降解 [J]. 中国塑料, 2017,31(3):94-99.
[48] Singleton D R, Jones M D, Richardson S D, et al. Pyrosequence analyses of bacterial communities during simulated in situ bioremediation of polycyclic aromatic hydrocarbon-contaminated soil [J]. Applied Microbiology and Biotechnology, 2013,97(18): 8381-8391.
[49] Heylen K, Lebbe P D, Vos L.sp nov., a denitrifying species with genetically diverse isolates from activated sludge [J]. International Journal of Systematic and Evolutionary Microbiology, 2008,58(1):73-77.
The strengthening effect of a static magnetic field on biotrickling filter—Study on trichloroethylene removal and bacterial community.
QUAN Yue1, WU Hao2, YIN Zhen-hao3, GUO Chun-yu2, YIN Cheng-ri2,3*
(1.Department of Environmental Science, Agricultural College, Yanbian University, Yanji 133002, China;2.Department of Chemistry, College of Science, Yanbian University, Yanji 133002, China;3.Analytical and Testing Center, Yanbian University, Yanji 133002, China)., 2018,38(3):1099~1108
A laboratory-scale biotrickling filter combined with a magnetic field (MF-BTF) and a single BTF (S-BTF) packed with laver rocks were set up to treat trichloroethylene (TCE) gasthrough inoculation of activated sludge. The influences of different MF intensities were investigated andhigh-throughput sequencing was studied to bacteria community and functions. The results showed that in aerobic conditions, with 0.20g/L of phenol, 53.6 to 337.1mg/m3of TCE, and empty bed residence times (EBRT) of 202.5s, the performances followed the order MF-BTF (60.0mT) > MF-BTF (30.0mT) > S-BTF (0.0mT) > MF-BTF (130.0mT), and the removal efficiencies (REs) and maximum elimination capacities (ECs) corresponded to: 92.2%~45.5%, 2656.8mg/(m3×h); 89.8%~37.2%, 2169.1mg/(m3×h); 89.8%~29.8%, 1967.7mg/(m3×h); 76.0%~20.8%, 1697.1mg/(m3×h), respectively. High-throughput sequencing indicated that the bacterial diversity was lower, whereas the relative abundances of predominant bacteria: Proteobacteria, Gammaproteobacteria, Acinetobacter were higher in MF-BTF (60.0mT: 73.3%, 36.8%, 34.7%) than that in S-BTF (0mT: 69.6%, 18.2%, 10.9%). Results confirmed that a proper MF could improve TCE removal performance in BTF.
magnetic field;biotrickling filter;trichloroethylene;bacterial community;high-throughput sequencing
X505
A
1000-6923(2018)03-1099-10
权 跃(1978-),女,吉林九台市人,讲师,博士,主要从事有机污染物生物降解方面的研究.发表论文50余篇.
2017-08-22
国家自然科学基金(21662038)
* 责任作者, 教授, cryin@ybu.edu.cn

