自拟养阴活血益胃汤联合胰岛素强化治疗对非糖尿病胃癌根治术后应激性高血糖患者糖代谢、应激状态、能量代谢的影响
叶 圳,李 炯,杨吉勇,顾宏刚
(上海中医药大学附属龙华医院,上海 200030)
1 临床资料
1.1 一般资料
选择上述时期在我院普外科拟择期行胃癌根治术,且术后发生应激性高血糖的82例患者为研究对象,均经胃镜和病理组织学证实为胃癌,无远处转移,有手术指征,既往无糖尿病病史,术后即刻~12 h内发生应激性高血糖,即术后空腹血糖≥7.0 mmol/L或随机血糖≥11.1 mmol/L[5]。排除严重心、肝、肾功能障碍者,既往腹部手术史者,术前感染者,术前2周内接受过糖皮质激素、降糖药物治疗者,术前有严重贫血和低蛋白血症者,精神障碍者。将82例患者随机分为2组:观察组40例,男29例,女11例;年龄49~72(53.28±8.45)岁;TMN分期中Ⅰ期6例,Ⅱ期12例,Ⅲ期12例,Ⅳ期10例;病理分型中腺癌31例,鳞癌3例,未分化癌7例。对照组42例,男28例,女14例;年龄44~74(55.67±9.28)岁;TMN分期中Ⅰ期6例,Ⅱ期14例,Ⅲ期13例,Ⅳ期9例;病理分型中腺癌33例,鳞癌4例,未分化癌5例。2组性别、年龄、TMN分期、病理分型比较差异均无统计学意义(P均>0.05),组间具有可比性。
1.2 治疗方法
2组均行择期全麻下胃癌根治术,术后给予常规普通外科相关护理和治疗,包括给予抗生素预防感染、抑酸保护胃黏膜、通便、维持水电解质酸碱平衡、肠内或肠外营养补充能量[热量目标值为25 kcal/(kg·d),1 cal=4.2 J]。对照组在此基础上给予胰岛素强化治疗,即采用胰岛素微量泵(通化东宝药业股份公司) 注射,泵入速度为1~2 IU/h,24 h内血糖维持目标为4.44~6.11 mmol/L,根据具体血糖水平调整泵速,血糖<4.50 mmol/L时停药,发生低血糖(<3.90 mmol/L)时立即补充葡萄糖液体。观察组在对照组治疗基础上给予自拟养阴益胃汤治疗,方药组成:黄芪30 g、党参25 g、地黄15 g、天冬12 g、石斛12 g、莪术15 g、茯苓15 g、白术12 g、薏苡仁10 g、水蛭8 g、藤梨根9 g、蜀羊泉12 g、甘草6 g。每日1剂,术后当天开始分2次胃管注入,患者恢复进食后改为口服,疗程7 d。
1.3 观察指标
①观察2组治疗前及治疗3 d、5 d、7 d空腹血糖、血清胰岛素、胰岛素分泌指数(HOMA-β)、胰岛素抵抗指数(HOMA-IR)、血清C反应蛋白(CRP)、白细胞计数(WBC)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、前白蛋白(PA)、白蛋白(ALB)、呼吸商(RQ)和静态能量消耗(REE)情况,其中RQ、REE采用间接能量测定仪测定(美国MedGraphic公司生产),均在清晨8:00完成测定。②统计2组治疗3 d、5 d、7 d空腹血糖控制情况,其中空腹血糖<6.11 mmol/L为正常,空腹血糖6.11~7.80 mmol/L为糖耐量受损,空腹血糖>7.80 mmol/L为应激性高血糖。③记录2组术后临床结局,包括胃肠道临床结局(包括术后排便、排气、肠鸣音恢复时间,进食时间)和一般临床结局(包括感染、肠道损伤、死亡等并发症发生情况,住院时间,住院费用)。
1.4 统计学方法

2 结 果
2.1
2组治疗前后不同时间点血糖代谢指标比较 2组治疗3 d、5 d、7 d后空腹血糖、血清胰岛素水平和HOMA-IR、HOMA-β均显著改善(P均<0.05),且观察组以上指标改善情况均显著优于对照组(P均<0.05)。见表1。
2.2
2组治疗后不同时间点血糖控制情况比较观察组治疗3 d、5 d、7 d后空腹血糖恢复率均高于对照组(P均<0.05)。见表2。
表1 2组治疗前后不同时间点血糖代谢指标比较
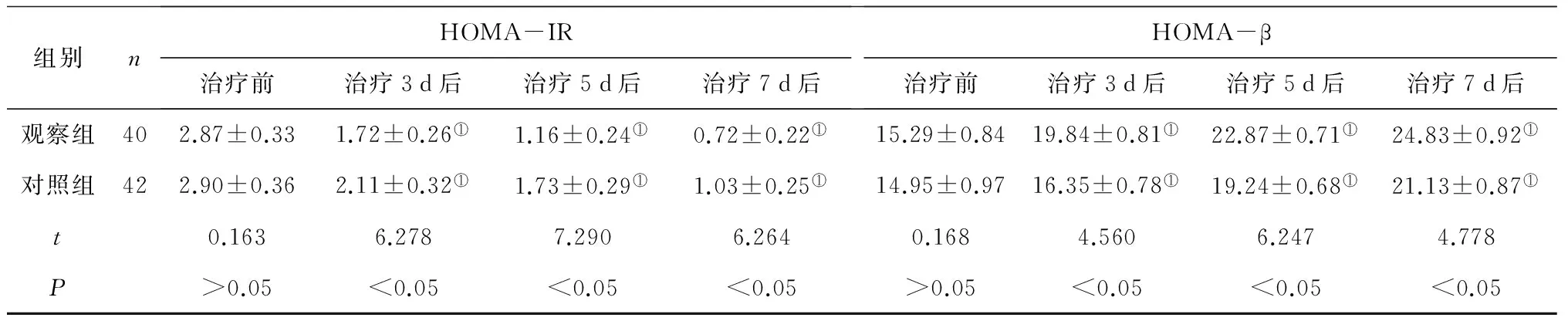
组别nHOMA-IR治疗前治疗3d后治疗5d后治疗7d后HOMA-β治疗前治疗3d后治疗5d后治疗7d后观察组402.87±0.331.72±0.26①1.16±0.24①0.72±0.22①15.29±0.8419.84±0.81①22.87±0.71①24.83±0.92①对照组422.90±0.362.11±0.32①1.73±0.29①1.03±0.25①14.95±0.9716.35±0.78①19.24±0.68①21.13±0.87①t0.1636.2787.2906.2640.1684.5606.2474.778P>0.05<0.05<0.05<0.05>0.05<0.05<0.05<0.05
注:①与治疗前比较,P<0.05。

表2 2组治疗后不同时间点血糖控制情况比较 例(%)
2.3
2组治疗前后不同时间点应激反应指标比较 2组治疗3 d、5 d、7 d后血清CRP、WBC、IL-6、TNF-α水平均显著降低(P均<0.05),且观察组以上指标水平均显著低于对照组(P均<0.05)。见表3。
2.4
2组治疗前后不同时间点能量代谢指标比较 2组治疗3 d、5 d、7 d后血清PA、ALB水平均明显增高(P均<0.05),且观察组均高于对照组(P均<0.05);RQ和REE均明显降低(P均<0.05),且观察组均低于对照组(P均<0.05)。见表4。
2.5
2组临床结局情况比较 观察组术后排便、排气、肠鸣音恢复时间和进食时间均明显短于对照组(P均<0.05),感染、肠道损伤发生率均明显
表3 2组治疗前后不同时间点应激反应指标比较
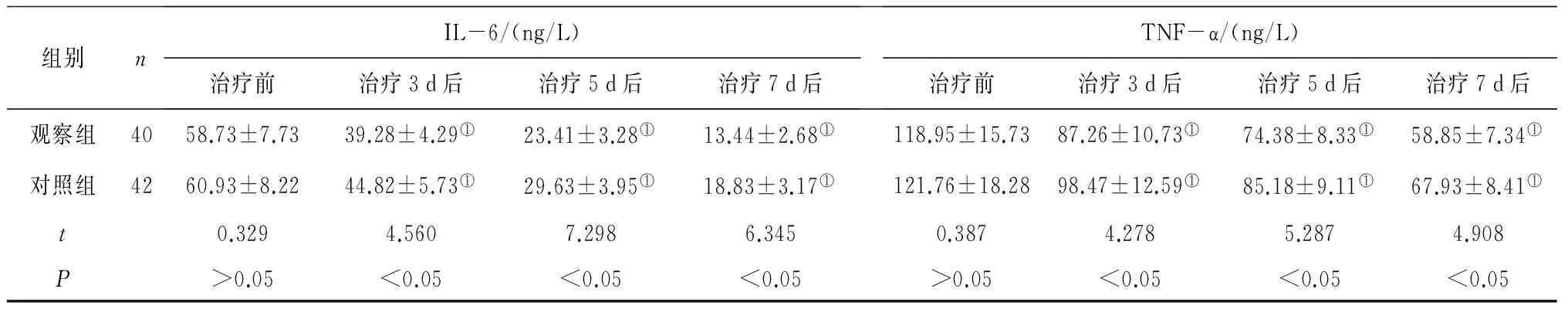
续表
注:①与治疗前比较,P<0.05。
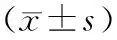
表4 2组治疗前后不同时间点能量代谢指标比较

组别nRQ治疗前治疗3d后治疗5d后治疗7d后REE/(kcal/d)治疗前治疗3d后治疗5d后治疗7d后观察组401432.18±154.291208.23±98.21①1126.45±93.73①1014.39±82.56①0.87±0.200.76±0.15①0.73±0.17①0.70±0.12①对照组421427.76±134.851317.66±93.27①1243.54±97.81①1137.41±87.24①0.89±0.180.82±0.20①0.78±0.18①0.75±0.14①t0.1896.2908.3296.7820.1734.2904.5605.225P>0.05<0.05<0.05<0.05>0.05<0.05<0.05<0.05
注:①与治疗前比较,P<0.05。
低于对照组(P均<0.05),住院费用明显少于对照组(P<0.05),住院时间明显短于对照组(P<0.05)。见表5。
3 讨 论

表5 2组临床结局情况比较
外科手术后患者常出现胰岛β细胞功能受损,导致胰岛素抵抗、机体自身血糖调节能力失调,出现应激性高血糖,应激性高血糖通常发生在术后12 h内,可持续至术后5~7 d[6]。目前,关于术后应激性高血糖的发病机制尚不完全明确,与手术造成的创伤、麻醉效应和炎性反应诱发的应激反应密切相关。CRP、WBC、IL-6、TNF-α是反映机体炎性反应和应激反应的重要指标,手术创伤能够激活下丘脑-垂体-肾上腺轴,不仅引起去甲肾上腺素、肾上腺素等儿茶酚胺类物质释放,还引起CRP、WBC、IL-6、TNF-α显著升高,导致胰岛β细胞功能受损,抵抗素抵抗,外周组织摄取葡萄糖功能障碍,最终引起血糖升高[7-8]。
应激性高血糖目前已经被认为是非糖尿病患者外科手术后预后不良的独立危险因素,能够对机体各系统、各器官造成多种危害:①术后应激性高血糖患者由于交感神经兴奋,引起机体代谢速度增加,患者处于高代谢状态,表现为外周组织蛋白、脂肪动员加快,能量消耗增加,反映机体能量代谢状态的血清PA、ALB含量显著降低,而REE、RQ则显著升高,不利于术后组织损伤修复和预后康复[9-10]。②术后应激性高血糖能够削弱机体抵抗力,增加术后感染的风险;高血糖还能够诱发肠道黏膜水肿充血、微循环障碍,引起肠道黏膜屏障损伤,不利于术后胃肠道功能恢复,因此不仅增加了治疗难度和医疗成本,还增加各种并发症发生率[11]。
外科手术围术期的血糖管理一直是临床关注的重点,主要目标是将血糖控制在正常范围内,并最大限度地保护受损的胰岛功能。胰岛素强化治疗能够通过持续、稳定的输注胰岛素而平稳有效地降低血糖水平,改善胰岛β细胞功能,减轻胰岛β细胞负担,增强外周组织对胰岛素的敏感性[4,12],还可有效抑制机体应激反应和CRP、IL-6、TNF-α等炎性因子的合成,促进胃肠道功能恢复,减少并发症,缩短术后住院时间[13]。
中医学认为恶性肿瘤为本虚标实之证,正气亏虚为本,瘀血和邪毒为标,患者机体正不胜邪而发病;同时由于手术创伤造成气血阴阳平衡进一步失调,出现气阴亏虚、气滞血瘀,引起脾胃虚弱,脏腑功能和代谢功能失调。由此可见“气阴亏虚”是发病的重要基础,瘀血是“气阴虚亏”的病理产物,亦是致病环节。本研究采用的自拟养阴活血益胃汤方中黄芪、党参益气固表、生津养血、升阳举陷;天冬、石斛、地黄养阴生津;水蛭、莪术通经消积、活血破瘀;茯苓健脾和胃,渗湿利水;白术补脾益胃;薏苡仁健脾益气;藤梨根、蜀羊泉防癌抗癌,清热解毒;甘草缓急解毒、补脾益气。全方共奏扶正固本、滋阴养阴、活血通络、和血养胃等功效。现代药理学研究显示,黄芪具有增强机体抵抗力、抗炎、抗肿瘤、抗应激、抗菌、利尿、保肝、改善营养状态和能量代谢等功效[14],还能够保护结直肠癌患者术后肠道屏障,促进术后胃肠道功能恢复[15];黄芪含有的黄芪多糖还能够降低IL-6、TNF-α等细胞因子水平,改善胰岛素抵抗,促进胰岛β细胞功能恢复,调节血糖[16]。地黄含有的环烯醚萜甙类物质能够改善脏器微循环,抑制胰岛素抵抗,调节血糖、血脂[17]。茯苓含有的茯苓酸、茯苓多糖和软磷脂能够抗肿瘤、安神、抗应激、增强免疫、控制血糖、调节胃肠激素分泌,改善胃肠道功能等[18]。
本研究结果显示,2组治疗3 d、5 d、7 d后空腹血糖、血清胰岛素、HOMA-IR和血清CRP、WBC、IL-6、TNF-α水平均逐渐降低, HOMA-β逐渐升高,且观察组以上指标改善情况均显著优于对照组;观察组治疗3 d、5 d、7 d空腹血糖恢复率和血清PA、 ALB水平均高于对照组,RQ和REE均低于对照组;观察组胃肠道功能恢复情况、一般临床结局均优于对照组。提示自拟养阴活血益胃汤联合胰岛素强化治疗能够显著改善非糖尿病胃癌根治术后患者胰岛β细胞功能,促进血糖恢复,抑制应激反应,改善能量代谢、营养状态及临床结局,减少并发症。
[1] 夏海娜,牛桂林,历冰,等. 非糖尿病胃癌患者手术应激性高血糖对术后感染及预后的影响分析[J]. 中华医院感染学杂志,2017,27(12):2740-2743
[2] 张然,许勤,陈丽. 非糖尿病胃癌手术患者营养支持期间应激性高血糖现状及影响因素分析[J]. 护理学报,2016,23(11):9-13
[3] 张然,许勤,陈丽,江娟. 血糖不稳定指数对胃癌术后应激性高血糖患者预后的预测价值[J]. 江苏医药,2016,42(1):20-22
[4] 李少玉,陈根本,郭链钿,等. 短期胰岛素强化治疗对围手术期高血糖患者胰岛β细胞功能的影响[J]. 岭南现代临床外科,2015,15(3):283-285
[5] 中华医学会麻醉学分会. 围术期血糖管理专家共识(快捷版)[J]. 临床麻醉学杂志,2016,32(1):93-95
[6] 章扬,汪欢,耿英杰,等. 围术期高血糖调控的研究进展[J]. 哈尔滨医科大学学报,2015,49(1):88-90
[7] 王春亮,张乐,赵海歌,等. 围术期高血糖的发生机制与研究进展[J]. 医学研究与教育,2016,33(4):52-56
[8] 刘红磊,马顺茂,任瑞锋,等. 糖预处理对胃肠道肿瘤手术后胰岛素抵抗及炎性反应的影响[J]. 中国医师进修杂志,2014,37(23):3-5
[9] 李雪娇,黄迎春,彭南海,等. 胃癌术后肠内营养支持对患者人体成分及能量代谢变化的影响[J]. 临床与病理杂志,2015,35(11):1948-1953
[10] 曾春平,陈幼萍,杨清水,等. 非糖尿病性高血糖对腹腔镜结直肠癌根治术后并发症的影响[J]. 中华胃肠外科杂志,2015,18(7):684-687
[11] 何韵彬. 腹腔镜结肠系膜切除术后机体应激反应及能量代谢观察[J]. 西南国防医药,2015,25(4):396-399
[12] 王茂云,隋翠珍,韩小红,等. 两种胰岛素强化治疗在围手术期患者中的应用[J]. 实用糖尿病杂志,2014,10(4):36
[13] 孙文栋,张国炳. 强化胰岛素治疗对上消化道穿孔修补术后高血糖的影响[J]. 海峡药学,2014,26(12):163-165
[14] 刘诗泆,刘素兰,尹秋林. 黄芪四君子汤联合不同营养方式对肝硬化肝癌大鼠肝部分切除术后营养状态与免疫功能的影响[J]. 中国老年学杂志,2016,36(23):5807-5809
[15] 王倩竹,陈小平,黄建平,等. 黄芪、角针药对方对结直肠癌患者术后肠道屏障功能的影响[J]. 中国中西医结合杂志,2015,35(11):1307-1312
[16] 高慧. 黄芪竹叶汤治疗消渴病气阴两虚证及对改善胰岛β细胞功能和胰岛素抵抗的作用研究[J]. 陕西中医,2016,37(8):1019-1020
[17] 龚普阳,谭睿,李佳川,等. 地黄合剂中不同地黄炮制品对小鼠糖脂代谢的影响[J]. 中药材,2014,37(12):2182-2185
[18] 岳美颖. 茯苓主要药理作用及临床应用[J]. 亚太传统医药,2016,12(7):68-69

